川芎嗪对社区获得性肺炎合并缺血性血管疾病BALF中细胞因子的影响*
杨锡兰 张高峰 沙梦龙 史刚 王冬梅
我国老年人群数量庞大,缺血性血管疾病尤其心脑血管疾病发病率连年居高不下。盐酸川芎嗪在临床中治疗缺血性血管疾病,尤其是脑梗死、冠心病取得良好的效果。老年人机体免疫力低下,容易发生感染,临床上缺血性血管疾病合并社区获得性肺炎(CAP)患者的数量不断上升。目前,川芎嗪在减轻急性肺损伤、缓解肺动脉高压等方面研究较多,但在治疗CAP的研究较少。本文研究川芎嗪对CAP合并缺血性血管疾病的细胞因子影响,为寻找有效的治疗手段提供新方向,报道如下。
1 资料与方法
1.1 一般资料
选择2019年6月-2020年12月50例在宿州市立医院新入院的CAP合并缺血性血管疾病患者为研究对象,纳入标准:(1)符合文献[1]《中国成人社区获得性肺炎诊断和治疗指南(2016年版)》中制定的CAP诊断标准,同时合并慢性缺血性血管疾病;(2)合并冠心病、脑梗死、脑动脉供血不足。排除标准:(1)合并哮喘等其他肺部疾病;(2)合并意识障碍;(3)有严重的心、肝、肾等脏器损伤;(4)合并血液病;(5)合并红斑狼疮等系统性疾病;(6)肿瘤、创伤等其他因素引起的缺血性疾病。随机分成两组,川芎嗪组25例和非川芎嗪组25例。川芎嗪组,男12例,女13例;年龄37~73岁,平均(62.44±8.30)岁;病程 7~14 d,平均(9.04±1.70)d;合并脑梗死或脑动脉供血不足13例,冠心病12例。非川芎嗪组,男14例,女11例;年龄 42~79 岁,平均(65.60±10.59)岁;病程 7~14 d,平均(9.56±1.94)d;合并脑梗死或脑动脉供血不足14例,冠心病11例。两组一般资料比较,差异无统计学意义(P>0.05),有可比性。患者已签署相关知情文件,本课题通过本院伦理委员会同意。
1.2 方法
川芎嗪组和非川芎嗪组均按照常规处理,包括抗感染(初始使用β内酰胺类药物,之后依据药敏调整合适抗生素)、祛痰(静推氨溴索注射液)、舒张支气管(静脉推注二羟丙茶碱、每日3次雾化吸入)等。在以上治疗基础上,川芎嗪组静脉滴注注射用盐酸川芎嗪(哈尔滨三联药业股份有限公司,国药准字H20041175)80 mg+氯化钠注射液(宜昌三峡制药有限公司,国药准字H20123141)250 ml,1 次 /d。两组疗程均为 7~14 d。
1.3 观察指标
入院治疗前及治疗后两组患者行支气管肺泡灌洗,支气管内注入生理盐水20~25 ml后回抽,每次回收率应达75%以上,以上反复操作3次。灌洗液按 3 000 r/min,离心 10 min,回收上清液,储存于-20 ℃冰箱。测定肺泡灌洗液中的丙二醛(MDA)、肿瘤坏死因子-α(TNF-α)、髓过氧化物酶(MPO)、白介素-6(IL-6)、白介素-8(IL-8)、白介素-10(IL-10)、核转录因子-κB1(NF-κB1)和高迁移率族蛋白-1(HMGB1)含量。以上试剂均购自上海酶联生物科技有限公司,测定均按酶联免疫法或各自的试剂盒步骤进行。
1.4 统计学处理
本研究数据采用SPSS 23.0统计学软件进行分析和处理,计量资料以(±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 BALF中MDA、MPO、NF-κB1和HMGB1含量
治疗后,两组BALF中MDA、MPO、NF-κB1和HMGB1含量均显著低于同组治疗前(P<0.01),川芎嗪组均低于非川芎嗪组(P<0.01),见表1。
表1 两组治疗前后BALF中MDA、MPO、NF-κB1和HMGB1含量对比[ng/L,(±s)]
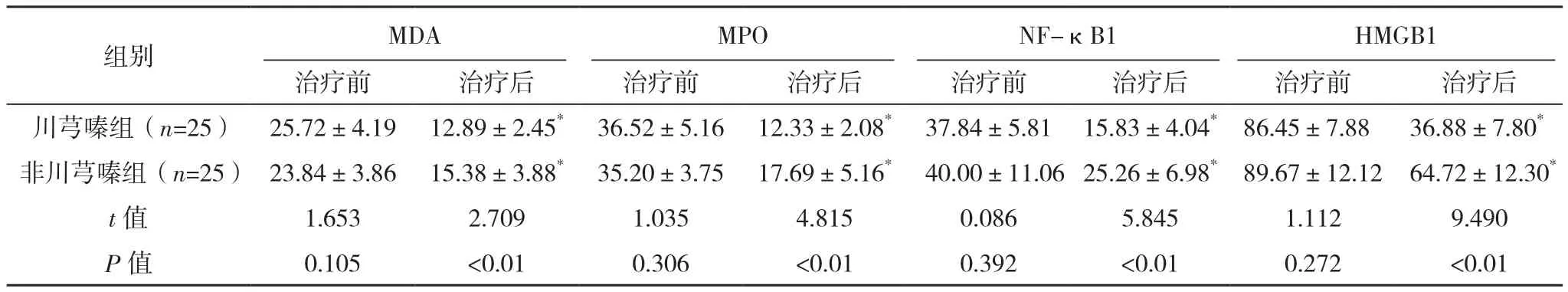
表1 两组治疗前后BALF中MDA、MPO、NF-κB1和HMGB1含量对比[ng/L,(±s)]
*与同组治疗前比较,P<0.01。
?
2.2 BALF 中 IL-6、IL-8、IL-10、TNF-α 含量
治疗后,两组 BALF中 IL-6、IL-8、IL-10、TNF-α含量均低于同组治疗前(P<0.01),川芎嗪组治疗后低于非川芎嗪组(P<0.01),见表2。
表2 两组治疗前后BALF中IL-6、IL-8、IL-10、TNF-α含量对比[ng/L,(±s)]
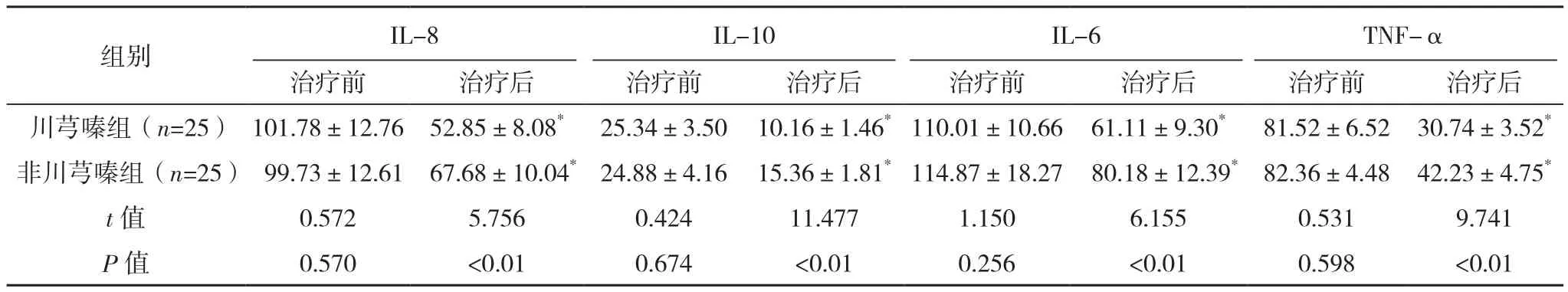
表2 两组治疗前后BALF中IL-6、IL-8、IL-10、TNF-α含量对比[ng/L,(±s)]
*与同组治疗前比较,P<0.01。
?
3 讨论
社区获得性肺炎是呼吸系统最常见的疾病之一,常因病原微生物侵袭致肺实质病变。病原微生物进入呼吸道后,损伤黏膜物生理屏障,进一步加剧细菌侵袭。脂质氧化应激反应是CAP发生的常见机制,细菌结合细胞膜上的脂质和蛋白,造成细胞膜破坏、多种酶活性降低。有研究显示,脂质氧化应激过程中生成的内源性乙醛,能促进炎症因子级联放大,加重肺炎损伤[2]。脂质经复杂的连锁反应后最终生成醛基(MDA、乙醛等)、酮基、羟基、氧自由基等,其中,氧自由基反过来进一步使脂质过氧化,造成机体蛋白、核酸等损伤。所以,组织中提取的MDA总量越高提示脂质过氧化越强烈,机体受损就越重[3]。本研究结果显示,治疗前两组MDA含量均明显偏高,经治疗后两组均有下降,同时川芎嗪组明显低于非川芎嗪组,差异均有统计学意义(P<0.05)。以上提示,CAP合并缺血性血管疾病患者经联合应用川芎嗪可以减轻脂质氧化的程度,促进疾病的恢复。
MPO是广泛参与机体杀菌过程的成分之一。当细菌进入机体后,激活超氧化物歧化酶(SOD)产生过氧化氢,后者在MPO作用下生成次氯酸,产生强大的杀菌能力[4]。所以,MPO含量代表中性粒细胞的杀菌水平[5]。此外,除中性粒细胞外,机体同时快速激活多种免疫细胞,产生大量的炎性因子及介质,比如TNF-α、IL-8、IL-6等。其中,TNF-α具有调节免疫、介导炎症反应、诱导凋亡等功能,在整个炎症过程中较早出现,其在急性肺损伤的病程中起到重要作用[6]。IL-8也属早期炎性因子,具有激活呼吸道内的T细胞及促进炎性细胞聚集等功能,与肺损伤有密切联系[7]。IL-6在机体应答中广泛活化急性反应性蛋白,调节B淋巴细胞的增殖,在机体炎症反应中起重要作用[8]。IL-10主要由T辅助细胞产生,可抑制T细胞及单核巨噬细胞释放细胞因子及介质,在CAP发生发展过程中起重要作用。重症CAP相关研究显示,重症组IL-10明显升高,且随病情严重程度有上升趋势[9]。此外,在炎症过程的晚期,内毒素及细胞因子均可通过HMGB1引起炎症反应加剧。HMGB1通过激活NF-κB信号通路,快速诱导炎性细胞产生各种炎性因子,如TNF-α、IL-6等[10-12]。有研究表明,HMGB1抗体或特异拮抗剂可显著降低脂多糖诱导的小鼠感染死亡率,提示HMGB1在感染过程中起到重要作用[13]。本研究显示,CAP合并缺血性血管疾病患者治疗前BALF中MPO、TNF-α、IL-8、IL-6、IL-10、HMGB1、NF-κB1含量均偏高,经治疗后均有明显下降,且川芎嗪组低于非川芎嗪组(P<0.01)。提示感染后机体快速产生炎症反应,且经川芎嗪应用后机体炎症反应明显减轻。
盐酸川芎嗪是从植物川芎的根茎中提取并研制的生物制剂,广泛应用于心脑肺血管疾病的治疗。川芎嗪减轻CAP患者肺损伤的机制可能有,(1)抗氧化:基础研究表明,川芎嗪可以通过抑制黄嘌呤氧化酶、增加MDA含量等途径提高SOD活性,有效减缓大脑缺血再灌注中氧自由基的产生[14]。相似的研究也贯穿于脓毒症所致的心肌损伤过程中[15]。笔者之前的研究,脂多糖诱导的大鼠急性肺损伤模型中,川芎嗪可以有效减少肺泡灌洗液中的MDA和MPO,有效减轻感染引起的氧自由基损害[16]。(2)抗炎:黄旺业等[17]研究发现,脓毒症引起的肺损伤患者经川芎嗪治疗后,血清中TNF-α、IL-6等炎症因子含量均低于治疗前。本次的研究也表明川芎嗪治疗后多种炎症因子均有显著下降。(3)减轻肺水肿:在大鼠肺损伤模型中,应用川芎嗪可以有效减轻大鼠湿肺重量、肺泡水肿、出血等情况,其机制可能与水通道蛋白1、5的表达有关[18]。(4)抑制气道早期纤维化:有研究显示,用博莱霉素诱导大鼠肺纤维化后,应用川芎嗪可以减轻肺组织中胶原和羟脯氨酸含量,进而减轻肺纤维化水平[19]。
综上所述,CAP合并缺血性血管疾病患者免疫应答细胞集聚,释放大量炎性因子,包括早期、晚期炎性因子及抑炎因子,经常规联合川芎嗪治疗后可明显减轻炎症反应及脂质过氧化,有利于疾病的恢复。

