基于乙酰胆碱酯酶抑制的有机磷农药生物传感器研究进展
彭邹君,邱 萍
(南昌大学 化学系,江西 南昌 330031)
农药自问世以来就被用于保护农作物,对高产丰收方面具有十分重要的意义[1]。根据现有农药的化学成分可将其大致归为有机氯农药、拟除虫菊酯类农药、氨基甲酸酯类农药和有机磷农药四类[2-4]。其中有机磷农药(OPs)因成本低、合成简单、杀虫活性高和防治对象范围广而得到了广泛的使用,是改革开放以来我国农业中使用量最多的一类农药,也是世界上发展中国家最常见的杀虫剂之一[5-6]。
为了达到更好的杀虫效果,农民经常会将多种农药混合使用以增强其毒性,但这些农药最终会通过食物链进入到人体内,极大地威胁人类的身体健康和生命安全[7-9]。世界各国和各组织对农药残留量均有相关规定,其中欧盟农药数据库中报告的果蔬最大残留限量为0.01 mg/kg[7],美国环境保护署(EPA)规定的水体最大污染水平为0.001~0.25 mg/L[10]。有机磷农药使人中毒的机制是容易与乙酰胆碱酯酶(AChE)的活性位点相结合,使酶发生磷酰化反应,致使其失去酶活性。与此同时,神经递质乙酰胆碱(ACh)因无法被失去活性的AChE水解,而在体内大量累积,导致胆碱能受体神经长期处于兴奋状态,对大脑的神经系统和呼吸系统均造成难以弥补的影响,最终导致死亡[6,11-13]。
目前常见的有机磷农药检测技术主要有高效液相色谱法、液相色谱-质谱联用法、气相色谱法、酶联免疫法等[14-17]。虽然这些检测技术的最低检出限能达到相关要求,但是耗时较长、价格昂贵,且必须由专业技术人员操作执行,不适合在现场条件下,尤其是在紧急情况下进行快速检测。随着生物技术和传感技术的快速发展,酶生物传感器因具有灵敏度高、选择性好、对环境友好和携带便捷等诸多优点,已成为近年来国内外研究的热点,是上述经典方法最有前途的替代方法,可更快、更简单地检测有机磷农药[18]。
当前已查阅到11篇相关的综述,介绍了各种基于酶抑制作用检测有机磷农药的方法,以及收集了不同性质农药的信息,如反应机理、催化酶以及特定类别的纳米材料。本综述总结了近年来,基于AChE的抑制作用检测有机磷农药的新方法和新生代实时检测技术,以及应用于农药检测领域的传感装置,例如量子点材料、速测卡和智能手机可视化技术。同时,分析了酶抑制法生物传感器改进的复杂性和局限性,并对其检测有机磷农药的前景进行了展望。
1 传感原理
对有机磷农药(OPs)检测的AChE生物传感器,主要通过AChE作为识别元件和催化元件。根据底物不同,存在两条不同的催化路线。如图1所示,在A线路中,底物为乙酰硫代胆碱(ATCh),在AChE的作用下能被催化分解为硫代胆碱(TCh)和乙酸。TCh上的巯基(—SH)具有还原性和络合能力,乙酸能使环境中的pH值发生变化。在B线路中,底物为乙酰胆碱(ACh),在AChE的作用下能被催化分解为胆碱(Choline)和乙酸,而胆碱作为底物在胆碱氧化酶(ChO)的催化下能被分解为甜菜碱(Glycine betaine)和过氧化氢。同样,在这条线路中,乙酸能使环境中的pH值发生变化,而过氧化氢的产生使得检测策略更加丰富多彩。
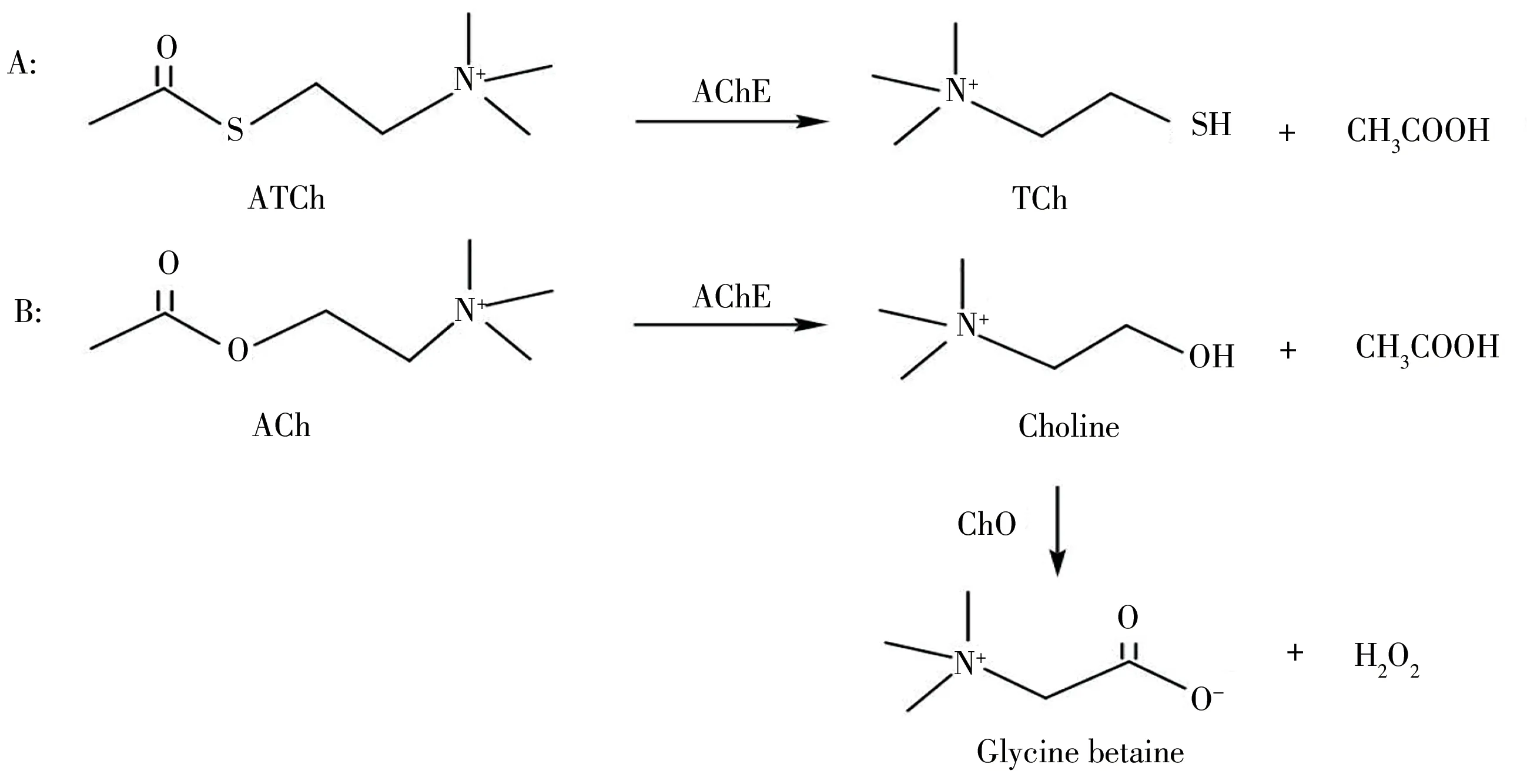
图1 基于AChE抑制检测有机磷农药的不同策略示意图Fig.1 Different strategies for detecting organophosphorus pesticides based on AChE inhibition
1.1 基于氧化还原反应的检测策略
众所周知,含有长共轭封闭结构的有机物质通常具有荧光性质,如4-氨基-3-羟基-1-萘甲酸(AHNSA)在460 nm处有较强荧光强度。使用二氧化锰纳米片(MnO2NS)作为荧光探针能够使AHNSA的荧光发生猝灭,基于该原理可实现甲基对硫磷的检测最低检出限为0.18 ng/mL。该传感策略是通过OPs抑制AChE来阻断TCh与MnO2NS发生氧化还原反应,从AHNSA的荧光强度变化可以定量计算出OPs的浓度[19]。在另一项研究中,MnO2NS还可以直接将无色形态的3,3’,5,5’-四甲基联苯胺(TMB)氧化成蓝色的氧化形态(oxTMB),其特征吸收峰位于652 nm。由于MnO2NS被TCh上的巯基分解,TMB不会被氧化,导致吸光度降低。通过快速监测吸光度,该策略可用于1~100 ng/mL对氧磷的检测[20]。Li等[21]采用简单的一锅水热法,分别使用20种天然氨基酸作为原始材料,合成了一系列荧光碳点(CDs)。实验结果表明,苯丙氨酸合成的CDs具有类过氧化物酶活性,可在H2O2存在下有效催化TMB。该策略测试甲基对硫磷、敌敌畏和乐果的最低检出限可分别低至7.12、8.47、14.6 nmol/L。
近年来,上转换纳米粒子(UCNPs)已成为基于荧光检测分析物的合适选择。这种纳米材料可通过多光子或双光子机制在近红外光的激发下发出强可见光,从而将长波长辐射转换为荧光。此外,UCNPs还具有许多优势,如特殊的化学和光学结构,更强的组织穿透性、细胞低毒性和光漂白抗性。Li等[22]使用MnO2NS制备了NaY/GdF4∶Yb和Er UCNPs用于快速、高选择地检测OPs。Wang等[23]以MnO2包覆的金纳米粒子(GNP@MnO2SPs)为探针,在单粒子水平上设计了一种用于OPs定量分析的生物传感器。基于GNP的局域表面等离子体共振原理,暗场光学显微镜可在单粒子水平上观察到粒子的颜色和散射强度的变化(如图2)。通过计算绿色和红色通道中单个GNP@MnO2SPs的散射强度比(Rg/r),可以精确量化OPs的含量,最低检出限为0.006 pg/mL,远低于其他方法。
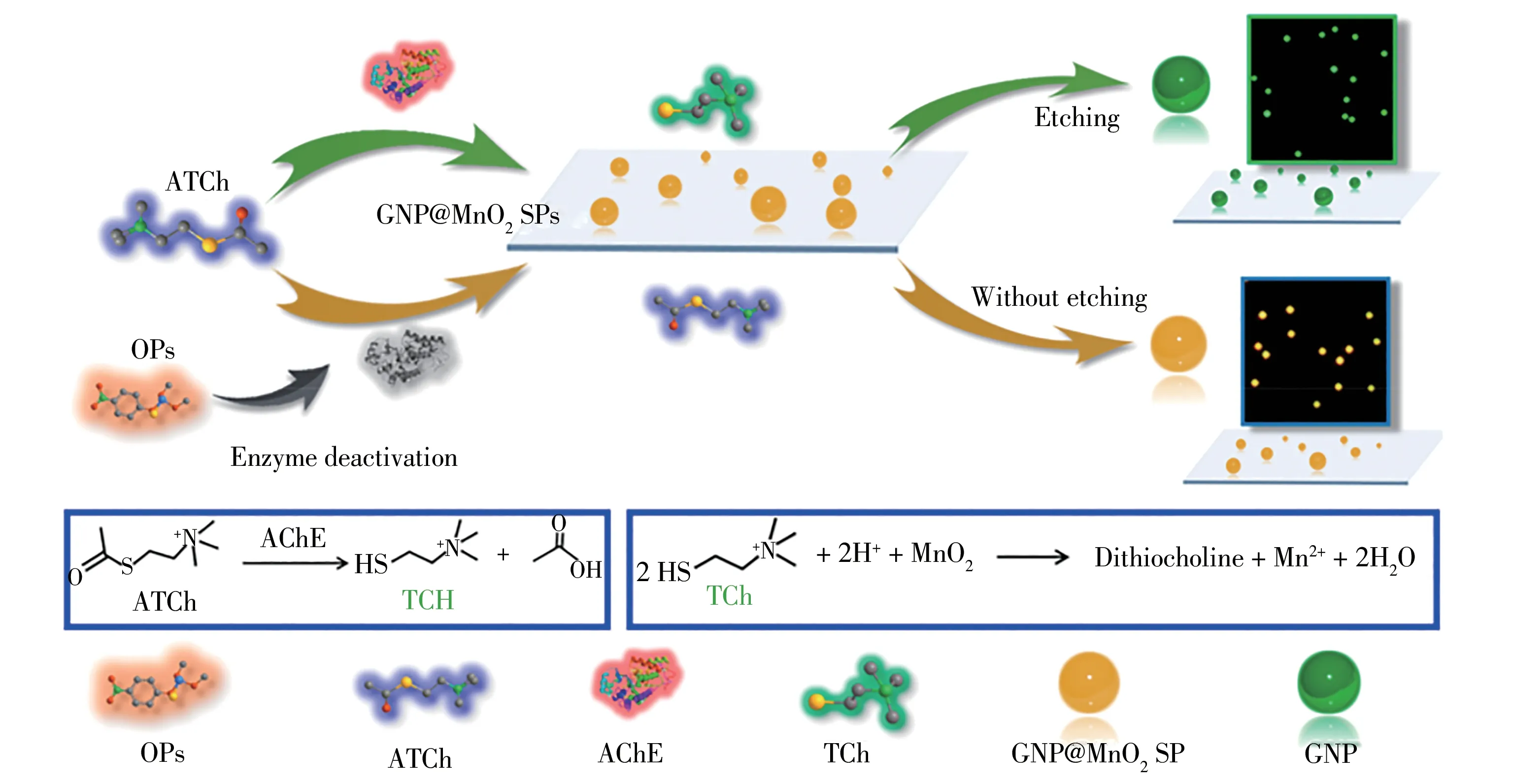
图2 GNP@MnO2 SPs的检测原理[23]Fig.2 Detection principle of GNP@MnO2 SPs[23]
1.2 基于络合反应的检测策略
Liu团队[24]构建了一种基于罗丹明B覆盖金纳米粒子(RB-AuNPs)的高灵敏双读数法——比色法和荧光法,检测复杂溶液中的OPs。检测机制是AuNPs能够猝灭RB的荧光,同时溶液为红色,而TCh的巯基能与AuNPs结合恢复RB的荧光强度,并使溶液的颜色保持蓝色。通过这种双读数法测定策略,获得甲萘威、二嗪磷、马拉硫磷和甲拌磷的最低检出限分别为0.1、0.1、0.3、1 ng/mL,均低于欧盟农药数据库和美国农业部报告的最大残留限量。类似地,牛血清白蛋白(BSA)包裹金银复合纳米团簇(BSA@AuAgNC)后在650 nm处有强烈的荧光强度,而二价铜离子(Cu2+)能够猝灭该纳米复合物的荧光强度[25]。Suo等[26]基于碳量子点(CQD)和金纳米团簇(AuNCs)之间的荧光共振能量转移(FRET)原理,开发了一种比例荧光系统用于灵敏检测OPs的含量。通过一锅法合成的CQD-AuNCs分别在420 nm和680 nm处有发射峰,通过测量F680/F420与OPs的增加比率进行线性拟合。与之类似的是,银纳米颗粒(AgNPs)能够降低改性石墨烯氮化碳(g-C3N4)的荧光强度。AChE催化ATCh水解后形成TCh,能诱发AgNPs的聚集,导致g-C3N4的蓝色荧光恢复,最低检出限为0.032 4 ng/mL[27]。
Zhao团队[28]报道了一种基于AChE活性抑制和功能化DNA,铜催化点击化学高灵敏检测OPs的均相荧光分析方法。Cu2+作为DNA探针点击化学连接的催化剂,在链置换后,使得荧光信号降低(如图3)。值得注意的是,由于Cu2+介导的信号放大效应,即使Cu2+的微小变化也能极大地影响点击效率,提高OPs检测的灵敏度。寡绿是一种非荧光染料,但其荧光强度在不同碱基或DNA结构的存在下变化很大,已被广泛用于生物分析。Zhou等[29]发现,寡绿在刚性T-Hg2+-T DNA结构中具有非常强的荧光强度。基于寡绿对该结构的特异性选择以及巯基与Hg2+的强亲和力,开发出一种寡绿响应的无标记荧光传感器用于检测OPs,最低检出限可达2.9 pg/mL。

图3 Cu2+作为DNA探针策略的检测原理[28]Fig.3 Detection principle of Cu2+as DNA probe strategy[28]
1.3 基于pH值变化的检测策略
导体量子点(QDs)由于超小的尺寸、高的水分散性和强的荧光性,通常被认为是构建传感器荧光团的期望替代物。碲化镉量子点(CdTe QDs)具有良好的水分散性,能发射出明亮的橙红色光,而质子化的CdTe QDs会降低荧光强度。AChE催化ACh水解为CH3COOH后,可使CdTe QDs质子化,从而实现对OPs的灵敏检测,最低检出限为0.027 ng/mL[30]。Zhao等[31]发现4-吗啉基硼酸(4-MPBA)在pH 3.0~5.8范围内变化敏感,从而将其设计成一种新型pH响应荧光探针,用于检测果汁中的OPs。Li等[32]将二硫苏糖醇(DTT)与氯金酸(HAuCl4)通过一步氧化还原反应合成S-S-AuNCs。该化合物能在655 nm处发射出超小尺寸和高分散度的亮红光。令人感兴趣的是,S-S-AuNCs对低pH值表现出独特的响应,可作为检测OPs的高效生物传感器。
1.4 基于蚀刻反应的检测策略
随着科学研究的发展,金纳米棒(AuNRs)的刻蚀技术已发展成为一种多色的检测技术。AuNRs的棒长度不同,表观的颜色不同,最大吸光度的出峰位置也不同。碘单质分子(I2)能对AuNRs进行刻蚀,使之长度缩短,表观颜色发生变化,最大吸光度的出峰位置发生偏移;存在于底物ATCh中的碘离子(I-)能与额外加入的碘酸根离子(IO3-)发生归中反应,生成I2;而TCh中的巯基能与I2反应生成二硫键,阻断其对AuNRs的刻蚀[33],检测原理如图4所示。
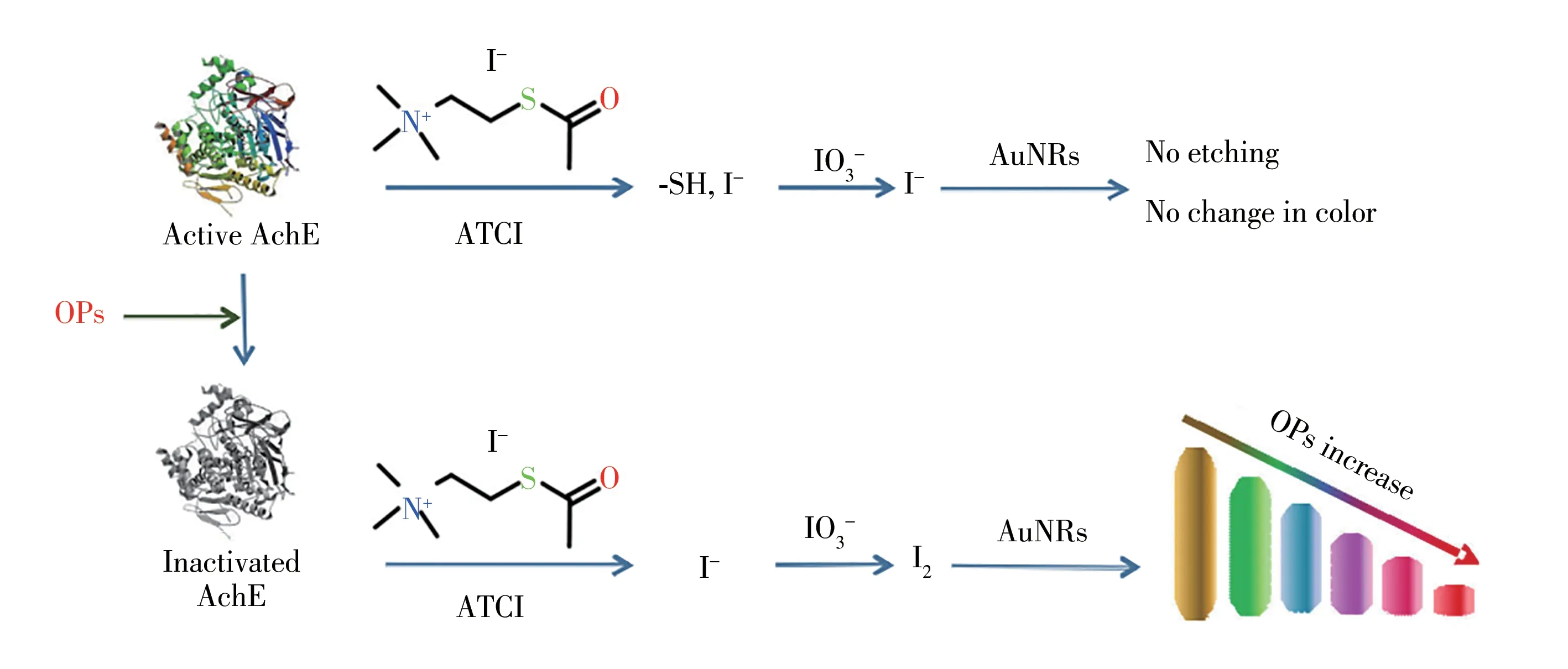
图4 基于AuNRs刻蚀技术的检测原理[23]Fig.4 Detection principle of AuNRs etching technology[23]
作为金属有机骨架(MOFs)的典型代表,类沸石咪唑骨架结构材料(ZIFs)因其孔径微小、比表面积高和生物可降解而被广泛用于生物传感器领域。ZIFs所具有的独特孔隙率使得各种纳米材料均可嵌入其中,并用于荧光传感。Cai团队[34]通过AChE和ChO的酶解产物H2O2在AuNCs@ZIF-8上的双重作用,实现了荧光和比色信号相结合检测OPs。该方法通过破坏ZIF-8的菱形十二面体结构,以削弱对AuNCs的限制,从而使荧光猝灭,且释放的AuNCs作为过氧化物模拟酶可催化TMB呈蓝色。
1.5 基于电化学技术的检测策略
电化学发光(ECL)技术一直致力于解决比色和荧光传感器中存在的问题,可作为灵敏可信的OPs残留测定方法。Li等[35]基于二氧化锰纳米片(MnNFs)和三(2,2’-联吡啶)合钌([Ru(bpy)3]2+)研制出一种均相ECL传感器。通过静电相互作用,形成MnNFs-Ru纳米复合材料,由于[Ru(bpy)3]2+被限制在纳米复合材料中,导致MnNFs呈现微弱的ECL信号。然而,当ATCh水解为TCh后,MnNFs-Ru纳米复合材料中的MnNFs被还原成Mn2+,[Ru(bpy)3]2+释放到溶液中。基于该策略以及OPs对AChE活性的抑制作用,可测定对氧磷的含量,最低检出限为0.053 ng/mL。He等[36]设计了一种以羧基功能化的纳米粒子(c-PFBT NPs)为阳极ECL探针,L-半胱氨酸封端的CdS量子点(L-CdS QDs)为阴极ECL探针的新型双信号组合纳米探针。通过酶催化反应原位产生的H2O2被开发为同时调节两种信号的双功能调节剂(如图5所示)。类似地,Oana等[37]将羧酸功能化的单壁碳纳米管和聚(3,4-亚乙基二氧噻吩)(CSWCNT:PEDOT)均匀电沉积在工作电极上,开发了基于AChE的生物传感器;该研究发现敌敌畏对AChE的抑制信号与其质量浓度在1~600 ng/mL范围内成正比,使用微分脉冲伏安法的检出限为0.447 ng/mL[37]。
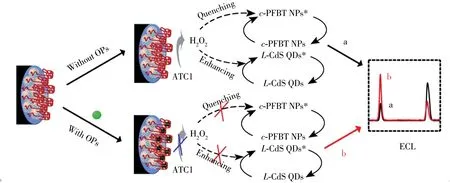
图5 c-PFBT NPs@CdS QDs双信号组合纳米探针的检测原理[36]Fig.5 Detection principle of c-PFBT NPs@CdS QDs dual signal combination nano-probe[36]
然而,与电化学技术相关的工作均需在电极表面进行繁琐复杂的修饰和固定,这可能会干扰分子的生物活性和电极制造的重复性,且成本高,反应条件苛刻,程序繁琐。
1.6 其他检测策略
Yang团队[38]合成了一种多酶靶向荧光探针(3CP)用于靶向多种水解酶,其具有大的斯托克斯位移(130 nm)和良好的生物相容性。在酶催化水解时产生强烈荧光,释放荧光的物质命名为HPQ,可用于检测多种农药的存在。受水凝胶的长效化学发光性质和MOF-Pt材料的高度稳定类过氧化氢酶活性的启发,Lu等[39]构建出一种具有长效化学发光体系的N-(4-氨基丁基)-N-乙基异鲁米诺/Co2+/壳聚糖(ABEI/Co2+/CS)传感器。在MOF-Pt和Co2+的协同催化下,H2O2分解产生的羟基自由基和超氧阴离子能够缓慢扩散到水凝胶的孔径中,产生强烈的荧光发射信号。由于水凝胶的高粘度性质,分子在体系中扩散缓慢,ABEI-H2O2体系的荧光强度非常持久,在2 h后仍有60%的保留。
总之,基于AChE抑制检测OPs的生物传感器因易于操作、灵敏度高和响应快速的特点而受到越来越多的关注。近年来构建的多种用于OPs检测的生物传感器,具有不同的AChE作用环境,不同的特性、工作范围和检出限[40-49](如表1)。
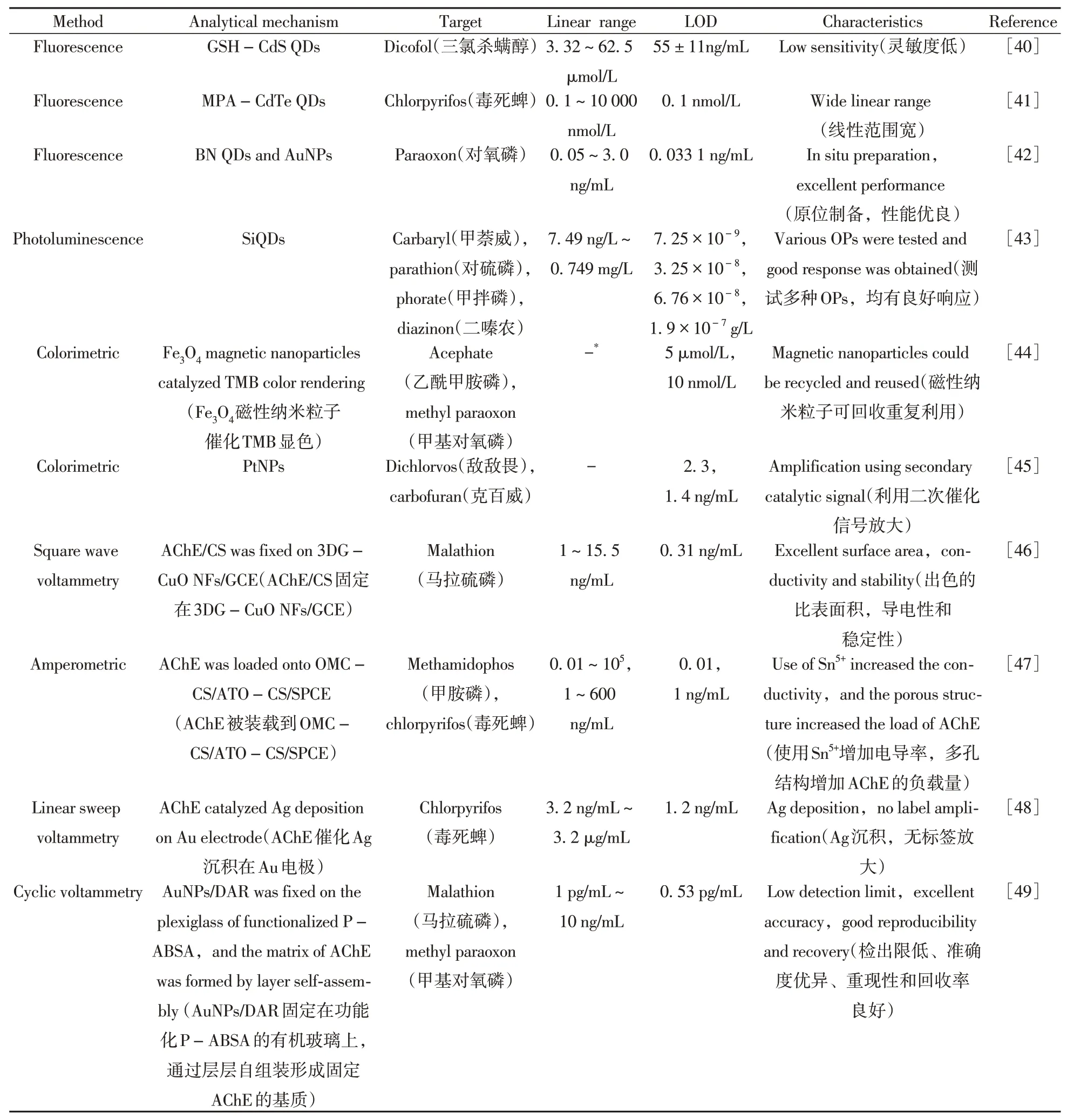
表1 基于乙酰胆碱酯酶抑制检测有机磷农药的策略总结Table 1 Summary of strategies for detecting of OPs based on AChE inhibition
2 传感装置
2.1 纸基传感装置
基于AChE抑制的实验室纸基生物传感器因价格低廉、便携式和可视化读出模式的实际优势,已成为检测OPs的一种强有力方法。最近,Huang等[50]利用γ-MnOOH纳米线(NWs)作为可降解纳米酶,以TMB为指示剂,设计了一种比色纸传感器。这种便携式传感器在溶液和固体状态下均表现出良好的选择性和抗干扰能力,在真实血清和蔬菜样品中的测试结果准确度较高。这表明了纸基传感装置在食品、环境和医疗领域应用的优越性。在其他研究中,研究者基于海藻酸盐水凝胶的混合纤维素酯(MCE)滤纸,以AChE作为传感元件构建了一种定量纸基传感器[51]。该策略借助ACh水解改变溶液的酸碱度,以释放Ca2+引发海藻酸盐的水凝胶化进行检测。溶液的粘度变化能够导致滤纸上斑点溶液的扩散直径发生显著变化,通过测量扩散直径能够定量确定OPs的浓度(如图6所示)。
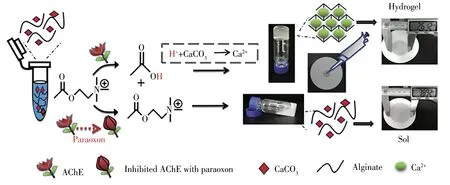
图6 用海藻酸盐水凝胶的混合纤维素酯滤纸为传感平台[5]Fig.6 Sensing platform of cellulose ester filter paper mixed with alginate brine gel[5]
类似地,Chen等[52]利用聚集诱导发射(AIE)原理制作了一种高性能的荧光纸分析装置(PAD)。该试纸条具有较高稳定性,能够获得无设备的OPs视觉传感效果,最低检出限为1.60 ng/mL。此外,基于化学发光(CL)的多酶偶联可折叠纸基传感器具有良好的准确性和稳定性,可用于现场甲基毒死蜱的检测[53]。而利用多酶偶联反应,能构建使用羟基氧化钴纳米片(CoOOH NFs)的CL测试条用于甲基对硫磷检测[54]。但多酶偶联的原理使得检测系统较为复杂,试纸制作成本相应提高。总之,便携式纸基传感装置能够破除地域限制,为OPs的分析检测走出实验室提供了新途径。
2.2 智能手机可视化技术
由于现代智能手机摄像头强大的成像功能,使用手机进行比色和定量检测越来越受到科研工作者的关注,但一个主要限制因素是照明条件对观察的颜色强度会产生影响。为了克服这一影响,研究人员已转向制作外部附件或手机内部的软件分析和校正图像[55-58]。Yu等[59]设计了一种条形码格式的检测芯片,通过位于部分条形码下方的聚二甲基硅氧烷(PDMS)通道板,制作整个条形码,以便智能手机上的条形码扫描应用程序能直接读取。当目标农药的存在或缺失导致条形码上编码的数据发生变化时,可获取检测的定性信息,使用应用软件对编码数据进行分析可实现定量检测。
便携式纸基传感装置虽成本低廉,但仅能通过裸眼大致估计OPs的残留含量,无法得到较为精确的具体数值。而与智能手机结合使用时,可以将比色卡显示出的颜色分解为三原色,以获得R(红)、G(绿)、B(蓝)值。通过R、G、B三者之间的数量关系,可进一步得到OPs的具体浓度。基于聚集诱导发射(AIE)纳米粒子(PTDNPs-0.10)和二维MnO2纳米片(2D-MnNF)设计的纸基分析装置[60],可通过G值和B值的数量关系,得到对氧磷含量的最低检出限为0.73 ng/mL,低于相关文件所规定的最大残留限量(10 ng/mL)[7]。同样,基于AuNCs@ZIF-8设计的体系中,灰度值与OPs含量具有线性关系,最低检出限为0.4 ng/mL[34]。将多酶偶联系统的水凝胶试剂盒与智能手机检测技术相结合,同样能用于OPs的现场筛选。通过将MnO2NFs嵌入到海藻酸钠水凝胶中,可构建基于靶向响应水凝胶的试剂盒。通过比较,获得的结果与传统实验室微孔板读数器得到的结果一致[61]。
智能手机可视化技术显示出超高便携性、易于普及性和操作可控性,将OPs的实时检测与新生代互联网技术相结合,可为未来目标物的检测提供新思路。
2.3 3D打印技术
3D打印技术是一种制造成本低、效益好、可面向客户定制的强大技术,在单个物体的制造过程中能够做到逐层构建器件的要求,近年来展现出强大的表面改造性和功能化的能力[62]。微型马达(SPM)是一种真正实现在线检测的新系统。利用3D打印技术构建的微型马达,能够在水下不同深度巡航,以现场探测不同水域中的OPs残留量[63]。这种方法是第一次将OPs检测同3D打印技术相结合,为未来现场检测设备的发明提供了新的可能。在另一项研究中,利用熔融沉积建模(FDM)技术的3D打印机实现了设备组件的快速原型制作[53]。利用三维设计平台创建设备组件的三维模型,然后使用专有软件对3D模型进行切片,将其转换为一系列薄层进行打印。这些工作为设计迷你暗箱提供了有利支撑,为化学发光的折叠式纸基生物传感器用于现场检测提供了稳定条件,也为智能手机的稳定成像发挥了重要作用。
3 结 论
多年来,基于AChE抑制的生物传感器已成为检测OPs残留的最佳候选,并在环境和食品分析应用中变得越来越重要。本综述总结了基于AChE抑制的各种检测OPs传感策略的工作原理和分析性能。尽管大多数OPs生物传感器显示出超强的灵敏度、精确度和稳定性,但使用更加新颖的方法将这些OPs生物传感器从实验室推向商业市场仍差强人意。这是因为大多数OPs生物传感器的设计经过了繁琐的过程,并且涉及有毒有害物质和高浓度的酶。此外,大多数OPs生物传感器所使用的AChE从电鳗和果蝇体内提取,在实际样品中因受温度和pH值影响并不十分稳定。
基于相关报道的检索可发现,由于荧光和紫外测试所需时间少、操作简单、样品无须另外加工、数据稳定可靠和灵敏度高,因此大部分传感策略的数据处理集中在荧光分光光度计和紫外可见分光光度计。在上述传感策略中某些策略使用到双酶甚至三酶的系统。对于大规模的实际应用,基于AChE的生物传感装置易于制造,成本低,并且有足够的保存时间,而在传感策略中使用双酶或者三酶显然增加了难度,提高了成本。因此,较少考虑使用多酶系统来设计传感装置和应用程序进行OPs的检测。
在对现有研究工作进行深入分析的基础上,本综述讨论了制约OPs生物传感器领域应用的局限,并提出了AChE辅助OPs生物传感器设计的改进策略。设计高灵敏度的基于AChE抑制的生物传感系统,仍是未来一部分科技工作者的主要课题。

