短时体外受精周期中受精失败的影响因素分析
惠燕,周晗璟,罗金,王雅琴,张怡,谢青贞*,漆倩荣*
(1.武汉大学人民医院生殖医学中心,武汉 430060;2.三峡大学第一临床医学院,宜昌市中心人民医院,宜昌 443003)
体外受精(IVF)和卵胞浆内单精子注射(ICSI)是治疗不孕不育的主要方法,IVF主要适用于输卵管性不孕、排卵障碍等非男性因素的不孕患者,而ICSI适用于男性因素不育、前次IVF受精失败、胚胎植入前遗传学检测的患者[1]。目前IVF方法主要分为常规IVF和短时IVF两种。常规IVF是将卵母细胞和精子共培养过夜后(16~20 h)进行脱颗粒;而短时IVF是将精子与卵母细胞共培养4~6 h进行脱颗粒,若出现受精失败或受精率不理想(2pb率<30%),可及时进行早期补救性ICSI(rescue ICSI,R-ICSI)以提高受精率。在精子质量正常的情况下仍有一部分患者会出现完全受精失败(TFF)或受精结果不理想。据报道,TFF的发生率为5%~20%,其可能的原因是精卵功能异常或精卵结合障碍,但很难在每个受精失败周期中进行研究以明确原因[2]。尽管已经证实短时IVF结合早期R-ICSI可有效降低周期取消率,但临床上IVF失败的预测仍非常困难,同时R-ICSI是否对妊娠结局有不利影响也存在争议[3]。本研究回顾性分析了我中心2016年1月至2019年12月进行的短时IVF周期,比较短时IVF组与早期R-ICSI组患者的临床特点和妊娠结局,以确定短时IVF失败的潜在影响因素以及R-ICSI对妊娠结局的影响。
资料与方法
一、研究对象
回顾性分析武汉大学人民医院生殖医学中心2016年1月至2019年12月共8 107个短时IVF周期的临床及胚胎实验室资料。根据短时IVF周期是否进行了R-ICSI分为短时IVF组(n=7 214)和R-ICSI 组(n=893)。
纳入标准:(1)在我中心行短时IVF助孕的患者;(2)短时IVF成功组(短时IVF组):短时受精评估受精率>30%;(3)R-ICSI组:短时观察受精率<30%并进行了R-ICSI。
二、诊疗回顾
1.控制性促排卵:本研究将不孕原因大致分为女方因素(包括输卵管因素、排卵障碍、子宫内膜异位症等可证实的女性不孕原因)、男方因素(精子数量或质量受损、无精子症致供体精液、性功能障碍等)以及不明原因不孕。根据患者情况采用本中心标准黄体期长方案、卵泡期长方案、拮抗剂、以及高孕激素状态下促排卵方案(PPOS)等方案进行促排卵。根据患者卵巢反应、激素水平及卵泡大小调整促性腺激素(Gn)剂量,当卵泡直径和激素水平达到扳机标准时,给予剂量为5 000~10 000 U HCG进行扳机,36 h后进行超声引导下取卵,具体方法参考本中心已发表文献[4]。所有患者均签署了IVF治疗和随访的知情同意书。
2.精子准备、短时IVF和R-ICSI:取卵时采集精液标本,37℃下至少液化30 min。根据WHO第5版人类精液检查与处理实验手册对精液标本的精子浓度、形态和前向运动进行评估,符合IVF指征的精液标本采用密度梯度离心+上游法处理,收集上游后的精子与卵丘-卵母细胞复合体在受精培养液(COOK,澳大利亚)中进行IVF。受精后4~6 h进行脱颗粒,在显微镜下观察第二极体(2pb)排出情况。如果2pb比例低于30%则进行R-ICSI:将具有正常形态的活动精子在PVP液滴中制动后,显微注射到未受精的MⅡ卵母细胞中。受精后的卵母细胞转移至卵裂期培养基(COOK,澳大利亚)并置于培养箱中培养。
3.受精评估与胚胎培养:在采卵后第1天(08:00 am~09:00 am)观察原核,包括原核数目和原核评级。采卵后第3天对胚胎进行评级后,将胚胎转移至囊胚培养液(COOK,澳大利亚)中继续培养,第5天和第6天观察囊胚形成情况并采用Gardner囊胚等级评分系统进行囊胚分期和评分。符合新鲜周期胚胎移植标准的患者于第3天或第5天移植1~2枚优质胚胎,剩余胚胎采用玻璃化冷冻法进行冷冻。具体方法和流程参考本中心已发表文献[4]。
4.妊娠结局评估:移植后给予黄体支持,移植后第10~14天测定血清β-HCG水平,若检测呈阳性(β-HCG≥10 U/L),则继续给予黄体支持至妊娠第12周。胚胎移植后30~35 d进行超声检测确定是否宫内妊娠、孕囊数量以及胎心情况。电话随访妊娠结局,包括自然流产、异位妊娠、分娩情况和新生儿状况。
三、分析指标
短时IVF组和R-ICSI组患者的一般资料(年龄、不孕年限、不孕原因、不孕类型、卵巢储备功能);促排卵及受精培养资料(促排卵方案,Gn用量和Gn使用天数,HCG日E2、P和LH水平,胚胎实验室资料);胚胎移植结局(临床妊娠率、流产率、异位妊娠率和活产率等)。
四、统计分析
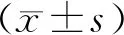
结 果
一、两组患者的一般情况
本研究纳入了我中心2016年1月至2019年12月共8 107个短时IVF周期的数据,其中有893周期因出现IVF失败进行了R-ICSI,IVF失败率为11.02%。
根据短时IVF周期是否进行了R-ICSI分为短时IVF组(n=7 214)和R-ICSI 组(n=893)。两组患者间年龄、BMI、抗苗勒管激素(AMH)以及月经周期第2天E2、FSH和LH水平均无显著性差异(P>0.05);R-ICSI组不孕年限显著长于短时IVF组(P<0.05),原发不孕和不明原因性不孕比例均显著高于短时IVF组(P<0.05)(表1)。
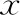
表1 患者一般情况比较[(-±s),n(%)]
二、两组患者促排卵资料比较
两组患者间促排卵方案、Gn使用天数、Gn用量、HCG日E2水平、HCG日卵泡数(>14 mm)、获卵数均无显著性差异(P>0.05);但R-ICSI组HCG日LH和孕酮(P)水平显著高于短时IVF组(P<0.05)(表2)。
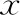
表2 患者促排卵资料比较[(-±s),n(%)]
三、两组患者胚胎实验室资料比较
两组患者采卵日精液分析结果、2PN受精率、1PN受精率和0PN卵裂率均无显著差异(P>0.05);R-ICSI组多PN(≥3PN)受精率显著低于短时IVF组(P<0.05);两组患者间TFF率、2PN卵裂率、优质胚胎率、囊胚形成率、冷冻胚胎数目均无显著性差异(P>0.05)(表3)。
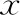
表3 两组患者胚胎实验室资料比较[(-±s),%]
四、两组患者胚胎移植结局比较
短时IVF组共3 824个周期进行了鲜胚移植,其中2 803周期为第3天(D3)卵裂期胚胎移植,1 021周期为D5囊胚移植;R-ICSI组共有488周期进行了鲜胚移植,其中369例为D3胚胎移植,119例为D5囊胚移植。
两组患者间鲜胚移植率(53.01% vs. 54.64%)和周期取消率(1.70% vs. 2.35%)均无显著性差异(P>0.05)。两组患者间D3胚胎移植数目和D5囊胚移植数目均无显著性差异(P>0.05);两组患者间D3胚胎和D5囊胚的临床妊娠率、流产率、异位妊娠率、活产率、以及胎儿出生体重均无显著性差异(P>0.05)(表4)。
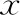
表4 两组患者鲜胚移植周期妊娠结局比较[(-±s),%]
续表
讨 论
受精是一个复杂的生理过程,需要精子与成熟卵母细胞之间进行精细的相互作用,包括精子获能、顶体反应、精子穿透、第二极体排出完成减数分裂、父系和母系原核的形成等[5]。受精障碍的原因主要是少弱精子症,这类患者可采用ICSI进行助孕[6]。然而有一部分患者,即使精子的各项指标正常,或有过自然妊娠史,或前次IVF受精正常,仍有可能出现IVF失败。受精失败是导致IVF周期取消的主要原因之一,给IVF患者造成了巨大的经济损失和精神压力,但其影响因素和发生机制仍不明确,临床上也难以对有受精失败风险人群进行预测。
在IVF过程中,根据精子和卵母细胞共培养的时间可分为常规IVF和短时IVF。关于常规IVF和短时IVF的选择仍存在争议:与精卵结合培养过夜的常规IVF相比,短时IVF可在受精当天根据第二极体排出的情况,判断是否需要进行早期R-ICSI,在一定程度上降低了IVF失败率和周期取消率;另一部分学者则认为短时IVF过早的脱颗粒不利于精卵结合,精卵培养时间过短以及R-ICSI是否会对胚胎发育造成不利影响仍不明确,而常规IVF更符合精卵结合的生理过程[7];但常规IVF中若出现受精完全失败或受精率不理想,再进行晚补救ICSI时会导致胚胎发育潜能降低[8-9]。有研究对IVF患者的姊妹卵母细胞分别进行了短时和常规IVF操作,结果显示两组卵母细胞受精率、异常受精率、胚胎质量、临床妊娠率和着床率均无显著差异[10]。无论是短时还是常规IVF,如何准确地根据IVF患者的临床或实验室特点对受精方式进行评估,是生殖医师和胚胎学家关注的热点问题之一。
本研究共纳入了8 107个短时IVF周期,其中有893周期因出现受精失败进行了R-ICSI,受精失败率为11.02%,与文献报道受精失败率一致[11]。我们在本研究中根据短时IVF周期是否进行了R-ICSI分为短时IVF组(7 214周期)和R-ICSI 组(893周期)。结果显示,两组患者年龄、卵巢储备功能、促排卵方案和促排药物使用,以及男方精液常规分析结果均无显著性差异(P>0.05)。尽管R-ICSI组原发不孕比例显著高于短时IVF组,但R-ICSI组仍有43.45%患者为继发不孕,提示继发性不孕仍有可能发生IVF失败;R-ICSI组患者不孕年限和不明原因性不孕比例也显著高于短时IVF组,因此长期原发性不明原因性不孕患者发生受精失败的风险明显增加。有研究者指出这类患者在无ICSI指征的情况下,可考虑行常规IVF+Half-ICSI以预防受精失败的风险[12],然而这种方式一方面会导致患者治疗费用增加、胚胎实验室人力和物力资源的浪费,另一方面也会人为导致ICSI应用比例严重升高[13]。本研究中,短时IVF组原发性不孕以及不明原因性不孕患者绝对数量远多于R-ICSI组,因此原发性不孕或不明原因性不孕尚不能作为IVF+Half-ICSI或ICSI的指征。另外,本研究结果显示R-ICSI组受精率与IVF组无显著差异,表明短时IVF结合R-ICSI能够有效避免IVF失败,避免资源浪费,而不孕原因和不孕类型在短时受精评估有争议时可提供一定参考价值。
研究证据表明,HCG日孕酮(P)值升高可导致子宫内膜容受性与胚胎发育不同步而对妊娠结局不利[14-15],但P值对卵母细胞受精的影响仍不清楚。我们的结果显示R-ICSI组患者HCG日LH和P水平均显著高于短时IVF组。研究报道,LH和P水平增加可能会导致卵母细胞的卵丘和颗粒细胞过早黄素化,透明带变硬,而卵丘细胞也通过自分泌和旁分泌机制影响精卵结合和雄原核的形成[16-17]。Huang等[18]的研究也发现HCG日P值与IVF周期的受精失败发生率呈正相关,提示P值升高可能会导致卵母细胞的卵丘细胞或透明带功能异常,导致受精失败。有研究指出颗粒细胞分泌的E2随着体外培养时间的延长而增加,导致胚胎透明带硬化,影响囊胚的孵出,从而对胚胎发育产生不利影响,但E2水平是否会影响卵母细胞透明带仍不明确[19-20]。我们的结果显示两组患者HCG日E2水平无显著差异,提示血清E2对卵母细胞受精失败的预测无明显意义。
双原核(2PN)的出现是卵母细胞正常受精的金标准,短时IVF中第二极体(2pb)的排出则是判断是否受精的最早标准。然而,在胚胎实验室实际工作中,部分患者可能表现为碎极体,或存在第2极体延迟排出的情况,导致受精评估存在偏倚,这种情况下实施R-ICSI有可能增加多精受精率[10,21]。我们的结果显示,R-ICSI组中多PN率显著低于短时IVF组,并未增加多精受精的风险,因此短时IVF后根据2pb对是否受精进行预测是安全有效的。R-ICSI组仍有1.57%患者出现了完全受精失败,这一部分患者则可能是由于卵母细胞激活失败或精卵功能异常导致[22-24]。
随着人类辅助生殖技术的广泛应用,其安全性问题也受到了越来越多生殖学者的关注。IVF过程中,精子浓度过高可能会导致多精受精而形成多倍体,降低了卵母细胞利用率。文献报道IVF中多精受精率在5%~10%;ICSI通过单精子注射方式,大大降低了多精受精率,但ICSI是一种侵入性操作,可能会损伤卵母细胞骨架和纺锤体,增加了非整倍体率。短时IVF结合R-ICSI在精卵共培养的基础上又增加了ICSI的侵入性操作,因此对胚胎发育以及妊娠结局的影响一直存在争议[13],尤其是欧美等国家并不采用R-ICSI技术,而是以ICSI为主导来降低受精失败风险和增加卵母细胞利用率[13]。本研究中关于胚胎实验室数据和妊娠结局的分析结果显示,两组患者的受精率、卵裂率、优胚率、囊胚形成率、可利用胚胎数、周期取消率、鲜胚移植妊娠率、流产率和活产率均无统计学差异(P>0.05),提示短时IVF结合R-ICSI并不会对胚胎发育和妊娠结局造成不利影响,也不会导致流产率增加。
综上,本研究比较了短时IVF和因短时IVF失败行早期R-ICSI患者的临床及胚胎实验室的周期特点,以及两组患者鲜胚移植的妊娠结局。结果显示,不孕年限长、原发不孕以及不明原因性不孕、HCG日LH和P值升高可导致IVF失败的风险增加。短时IVF组和R-ICSI组的胚胎实验室结局、临床妊娠率、流产率、活产率和胎儿出生体重均无显著差异,说明早期R-ICSI可有效改善短时IVF失败患者的结局。

