基于直肠给药系统的研究和最新进展
周春慧,韩晓璐,李蒙,王增明,李春梅,王向涛,郑爱萍*
(1.哈尔滨商业大学药学院,黑龙江 哈尔滨 150076;2.军事科学院军事医学研究院毒物药物研究所,北京 100850)
直肠给药是最古老的药物剂型之一,两千年前,东汉张仲景首创了肛门栓剂和灌肠术,东晋葛洪首创灌肠器械筒,唐孙思邈开发最早的保留灌肠技术[1]。20世纪,由脂肪基(硬脂肪)组成的栓剂也开始在欧洲国家和日本市场上流行。特别是直肠给药用于儿童、老年和昏迷患者的疾病治疗已延续了几个世纪[2]。
常规直肠剂型可分为三类:液体剂型(如灌肠剂),固体剂型(如栓剂,胶囊和片剂)和半固体剂型(如凝胶剂,泡沫剂和乳膏剂)[3]。随着现代药剂学发展,衍生出许多的直肠给药新剂型,如热敏液体栓剂、微型灌肠剂、热敏性直肠凝胶及纳米粒子直肠剂型等。直肠给药法显效快、生物利用度高、无明显不良反应和副作用,是一种绿色疗法。但直肠给药的普及受限于给药器械舒适性,需开发先进、便于给药、规范化的直肠推注和肛注专用器具,提高直肠用药依从性。本文对近几年来直肠给药制剂的特点及优势,影响直肠给药吸收的因素、常见给药装置和新型直肠给药剂型进行探讨。
1 特点及优势
直肠给药是一种通过肛门输送药物入肠管释放发挥药效,以治疗全身或局部疾病的给药方法。其主要方法有:①直肠推入法(小剂量直肠推注、大剂量直肠灌注);②直肠滴入法;③栓剂塞入法。直肠给药时药物溶于直肠分泌液中,通过肠黏膜吸收药物主要有3条途径(如图1):①药物通过直肠中静脉、下静脉和肛管静脉,绕过肝脏直接进入(下腔静脉)大循环,可避免首过效应;②通过直肠上静脉,经门静脉进入肝脏代谢后,再循环至全身;③通过直肠淋巴系统吸收后,通过乳糜池、胸导管进入血液循环。一直以来,直肠给药广泛应用于临床治疗便秘、痔疮、肛裂、炎症和高钾血症等局部治疗和用于治疗疼痛、发烧、恶心和呕吐、偏头痛、过敏和镇静等全身治疗,经统计国内外临床批准用于局部和全身吸收的直肠制剂[4-5]见表1。
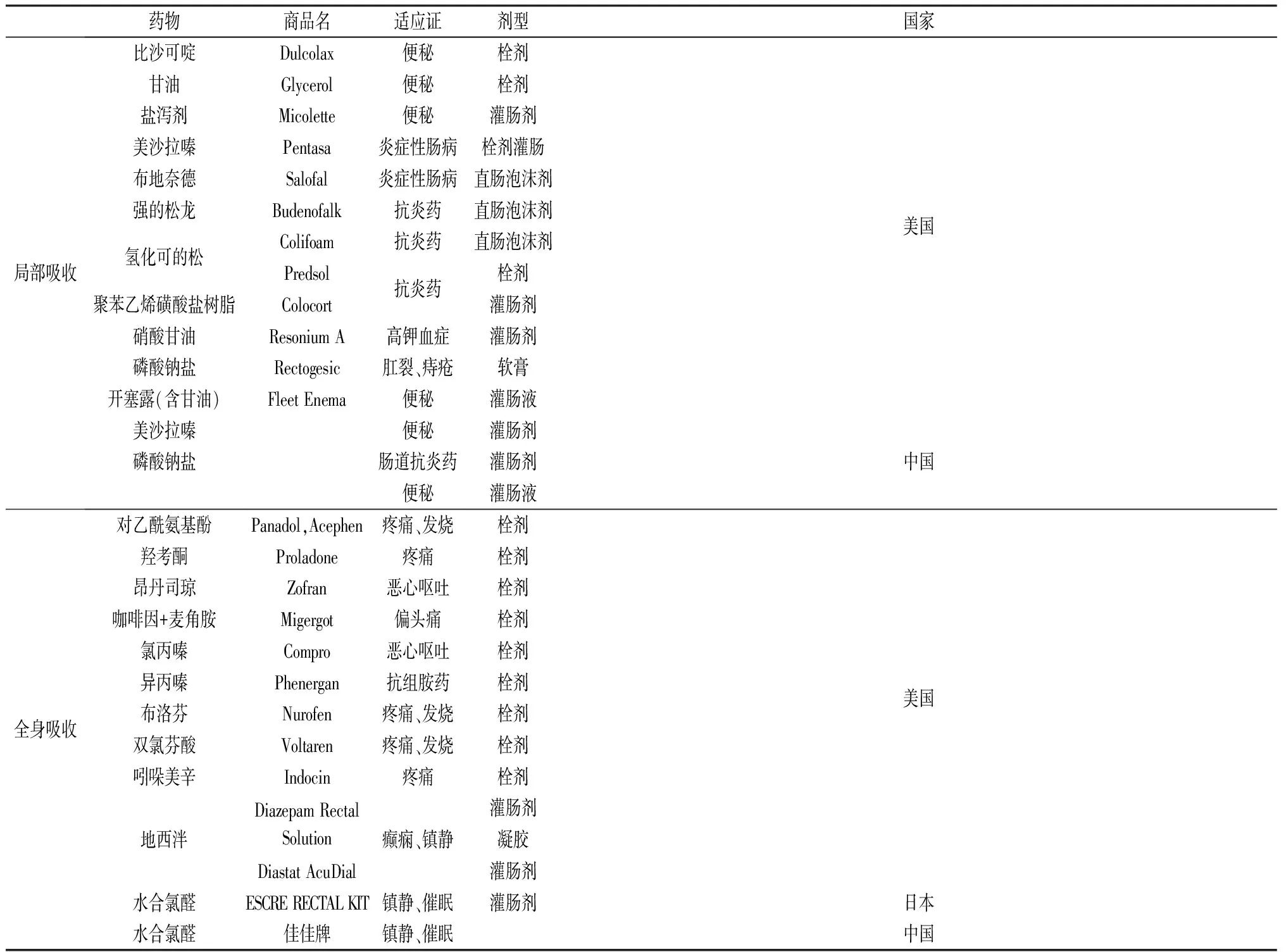
表1 国内外临床批准用于局部吸收和全身吸收的直肠制剂
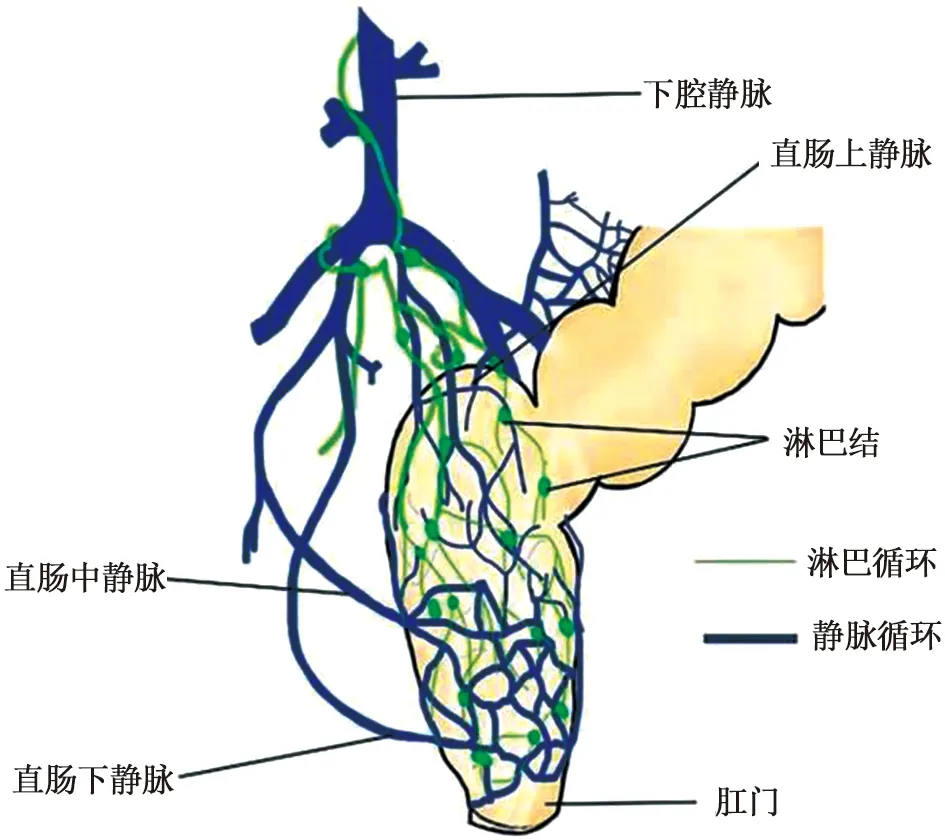
图1 直肠吸收途径示意图
与口服给药相比,直肠给药避免药物直接刺激胃而产生恶心、呕吐、胃胀等症状,中药通过直肠给药还可减轻患者口服中药的痛苦,且药物50%~70%可通过肠黏膜吸收,不经肝脏直接进入血液循环,从而减少药物的肝毒性及副作用[6]。与静脉注射相比,直肠给药无须注射即可达到一致的血药浓度,避免了肌肉注射的疼痛和静脉输液可能出现的不良反应,吸收快速且无痛,对不愿静脉注射的患者或儿童是一种有效的给药途径。同时直肠给药技术安全、治疗风险小、操作简单、简易的给药器具低廉易得,适合基层医院医生的临床应用和推广[7]。
2 影响直肠给药的因素
2.1 生理因素
2.1.1 吸收途径 药物的直肠吸收主要依据经典细胞转移理论[8],主要吸收途径是跨细胞或细胞旁吸收。由于直肠缺乏酶,药物直肠降解率相对低于上消化道[9]。药物经直肠上皮细胞(穿过细胞)或经紧密连接处(细胞间质)通过直肠壁吸收,是一种浓度高向浓度低扩散的单纯扩散,故可迅速达到有效血药浓度。
2.1.2 pH及直肠液缓冲能力 直肠平均表面积约为200~400 cm2,直肠液平均体积为1~3 mL[10],pH为7.2~7.4,有利于pKa值接近或高于生理范围的药物吸收[2]。直肠液缓冲能力较低,药物溶解可显著改变直肠pH。直肠pH变化可影响药物的电离状态,从而影响药物的吸收,并可能导致黏膜的刺激或损伤[11]。故在制剂研发时应考虑这些因素,以确保直肠给药安全有效。
2.1.3 内容物 直肠主要作为排便过程中的运输管道或临时储存场所,肠黏膜仅极少参与从胃肠道内容物中吸收水和电解质。直肠内粪便的存在会影响直肠内容物的黏度,从而影响药物溶解性、稳定性以及药物与黏膜壁的接触被吸收[12]。在无粪便存在的情况下,药物可接触直肠和结肠较大的吸收表面,可得到理想效果,故应用制剂之前先灌肠排便。
2.1.4 保留时间 直肠给药后可能存在渗漏,影响药物与直肠黏膜的接触时间,从而影响药物疗效[13]。且药物需穿过作为直肠上皮保护剂和药物吸收屏障的黏液层到达直肠壁上皮细胞,周转时间为3~4 h[14-15]。直肠给药后一般保留15 min即可满足药物吸收[16-17];中药灌肠可保留30 min左右,最长可保留1 h[18]。
2.2 药物性质
2.2.1 脂溶性与解离度 大多数用于直肠给药的原料药具有较高的油水分配系数(log P),并且分子量较小(分子重量<500 g·mol-1),这有助于药物通过直肠黏膜被快速吸收[2]。研究报道显示,脂溶性药物比水溶性药物更易吸收;分子型药物比离子型药物更易吸收;药物吸收与其解离常数有关,未解离的分子愈多,吸收愈快[19-20]。
2.2.2 溶解度与粒径 直肠给药制剂应具有足够的亲水性可溶于直肠液,并具有足够的亲脂性以穿过上皮细胞。许多药物水中溶解度小,需利用增溶技术来提高其溶解度,如减小粒径、形成盐、使用表面活性剂或将其封装到纳米颗粒中[21]。其中活性成分和辅料的粒径控制,可极大影响药物的溶解和吸收速率[22]。
2.3 剂型因素 对于直肠给药的固体剂型,在药物吸收进入黏膜之前,需要经过崩解、液化和溶解的过程[23]。因此,与液体剂型相比,固体剂型吸收通常较慢,悬浮液或溶液通常比栓剂吸收得更快。其中栓剂药物使用仅限于直肠和乙状结肠,而灌肠剂根据其容量可到达结肠的更近端。
2.4 吸收促进剂 直肠给药时,直肠黏膜充当物理屏障,可加入吸收促进剂改变药物处方来增加直肠吸收[24]。常用的直肠促进剂有水杨酸盐、5-甲氧基水杨酸、表面活性剂、非甾体抗炎药、胆汁盐、脂肪酸、甘油一酸酯、甘油二酸酯和甘油三酸、烯胺及其衍生物等,增加细胞膜通透性或细胞旁途径的吸收[25-26]。
2.5 给药剂量、温度及深度 给药剂量:给药量会影响直肠药物的滞留时间,大于80 mL的容量通常会刺激排便,故量大时可采用分次给药或肛滴[7]。
给药温度:肛缘皮肤感觉神经末梢丰富,对外来刺激较敏感。故一般直肠给药温度应控制在35~40 ℃,过高或过低易引起便意,不利于药物保留[27]。
给药深度:插入肛门的距离会影响药物的生物利用度。一般要达到全身给药,栓剂应塞入距肛缘2 cm左右,较4 cm处的生物利用度高,距肛门口6 cm处首过作用就较大[28]。成人直肠炎插管深度为5~7 cm,婴儿插管肛门约3~4 cm[29]。
3 给药装置
由于直肠给药部位特殊,多数需配备给药装置。液体和半固体灌肠剂通常被封装在直肠给药器中或给药时再装到单独给药装置给药,固体栓剂有的无须装置辅助直接给药,有的也需装置辅助给药[30]。下文对几种常见直肠给药装置进行简述。
3.1 直肠推入装置 直肠推注给药是用注射器和直肠注药管,将药液直接推注到直肠内。装置通常为上面有刻度、内有芯杆和活塞的硬质圆柱体一次性储药器和材质柔软的注药肠管组成,如图1 a所示。注药肠管通常边角圆润,前端开有侧孔、头端无孔,避免操作时粪块堵塞。使用时可用液状石蜡润滑,增加舒适感。也有简易一体的肛门直肠给药器弹簧液体瓶(如图1 b所示),其注药肠管前端也通常开有侧孔、头端无孔,一次性储药器为可伸缩挤压的弹簧液体瓶。这两种装置常见且装置简单,单剂量给药成本低、给药方便无痛,广泛用于直肠给药。

图1 a.一次性直肠给药注射器接灌肠管装置外观;b.肛门直肠给药器弹簧液体瓶装置
一种新型装置梅西导管(Hospi公司)是由美国食品药品监督管理局(FDA)于2014年批准的用于直肠给药的医疗设备,可用于溶液或混悬液的直肠给药[31-32],产品外观见图2。梅西导管由双端口、双管腔球囊管组成,该管插入直肠中括约肌上方的直肠中,在此处将保留球囊充气将装置固定到位,气球比直肠粪便小且柔软,不适感小。梅西导管用为一次性的装置,可应用于许多护理环境中,无须重复侵犯患者隐私或重新安置,可重复给药,使用方便简单,有良好耐受性,具有良好的临床应用前景[33]。
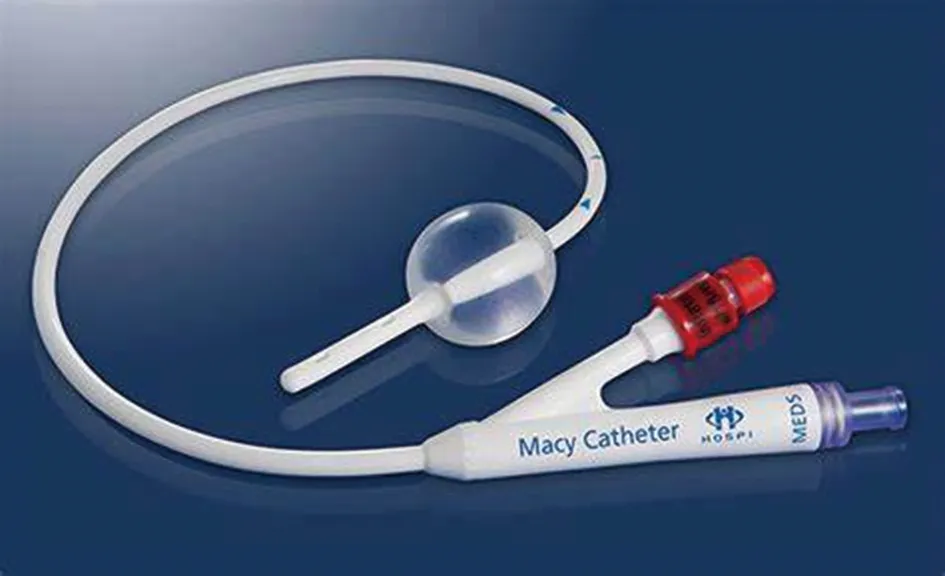
图2 梅西导管(Macy Catheter)装置外观
相较于制剂给药时再装药的给药装置,市面上流行的通常是药品和给药装置一体化的直肠给药方式,给药更方便,剂量更准确,省时省力,避免了装药过程的烦琐及不确定性。如图3a地西泮直肠凝胶(Diastat©AcuDialTM)是一种非无菌、预填充、单次给药的直肠给药系统。包括一个塑料涂药器,具有可弯曲的模制尖端,柔软,方便给药。常见的还有一次性预灌封给药器,如图3 b日本的水合氯醛灌肠剂(ESCRE©RECTAL KIT),使用时拆下枪管尖端的粉色盖子,在圆弧形的枪管尖端侧面分排有3个正方形小孔,给药时便于药物均匀分布于直肠,促进药物吸收。

图3 a.地西泮直肠凝胶预装注射器;b.水合氯醛灌肠剂一次性预灌封给药器
3.2 直肠滴注装置 直肠滴注是从肛门插入导尿管后将液体药物放置输液瓶注入直肠的给药方式,与静脉输液相似,装置多为医护人员用输液器连接一次性导尿管而成,与灌肠器相比,直肠滴注给药容量大,剂量大,且能增加插管的深度,便于药物的保留和吸收。由于采用输液器连接输液瓶,便于直接观察到滴速,以便控制和调节滴速,从而达到有效的治疗目的[34]。直肠滴注装置简单,器具易得,便于临床上各种药物的应用,对基层医院有较好的推广意义。一般可将临床上口服的中西药制成灌肠液通过直肠滴注装置给药[35]。

图4 医院一次性直肠滴注装置
3.3 栓剂塞入装置 直肠栓剂可通过患者的肛门推入直肠内逐渐溶化发挥疗效。目前,临床上多采用手指放置药栓的给药方法[36]。因用手指放置药栓存在深度难掌握或放置过浅被排出的问题,故也需栓剂塞入装置以克服相关问题。如图5 a所示的栓剂塞入装置包括用于盛放栓剂的装药器和栓剂的推药器;插入深度可固定,可使栓剂到达直肠理想位置发挥治疗效果[2]。也有简易直肠栓插入器如图5 b所示,给药时再装上药栓。

图5 a.栓剂插入器(North Coast Medical,Inc.);b.简易直肠栓插入器(Medintin公司)
4 新型直肠给药剂型
4.1 直肠泡沫剂和直肠自乳化给药剂 直肠泡沫剂是一种胶体剂型,具有含发泡剂的亲水性液体连续相和气态分散相[23]。直肠给药后,它们在黏膜表面从泡沫状态转变为液体或半固体状态。主要用于治疗痔疮、肛裂和远端直肠结肠炎等[37],给药方便、不适感和渗漏小。尽管有这些优点,但市售的直肠泡沫制剂并不多。直肠泡沫剂通常套件提供,包含载药气雾罐,并带有多个用于泡沫给药的涂有石蜡润滑剂的聚氯乙烯(PVC)涂抹器。Makoto等[38]发现在不同的布地奈德外用制剂中,布地奈德泡沫剂药物扩散和保留及更广泛的患者接受度更好。
直肠自乳化给药剂是指通过自乳化药物给药系统(Self-Emulsifying Drug Delivery System,SEDDS)配制用于直肠的非水性液体或半固体剂型。利用该体系的油相获得自乳化同时,可得到一种具有广泛接触直肠黏膜和快速吸收优点的非水性液体或半固体产品[39]。SEDDS可通过提高药物溶解度和改善膜渗透性来提高生物利用度。Kauss等[40]评估了使用SEDDS以提高作为新生儿直肠抗生素的头孢曲松的全身生物利用度。家兔直肠给药后的体内结果显示,SEDDS制剂中头孢曲松可快速吸收,与头孢曲松胶囊直肠给药(粉末对照制剂)相比,生物利用度达到128%。
4.2 纳米凝胶、纳米栓剂 凝胶较常用于纳米微粒的直肠给药制剂中。凝胶通过在制剂基质中使用黏膜黏附聚合物、热敏聚合物获得的黏性有助于延长制剂在直肠中的保留时间,并增强与直肠黏膜的接触促进药物吸收[41]。其中Melo等[42]研究了聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]纳米颗粒并入热敏聚合物(泊洛沙姆407)形成复合系统后加入抗艾滋病毒(human immunodeficiency virus,HIV)杀微生物剂模型药物达匹韦林的结直肠分布和保留。体外研究表明,与直接分散到磷酸盐缓冲盐水或热敏灌肠基质中的达匹韦林相比,载有达匹韦林的复合系统具有更快的药物释放。小鼠体内研究表明,纳米微粒热敏聚合物在结直肠区域表现出更广泛的分布,在结直肠中的保留也明显增强。
相比液体和半固体剂型,栓剂是最常用于将纳米微粒纳入用于直肠给药的固体剂型。Katata等[43]研究制备了含治疗HIV的一线药物洛匹那韦的纳米粒栓剂,以克服洛匹那韦口服给药时溶解度差、生物利用度低的问题。通过纳米沉淀成功制备洛匹那韦纳米粒并通过融合法装入栓剂中。表征结果表明,该药物纳米粒被封装进栓剂后与基质无相互作用,并且可能成为受控药物递送的潜在载体。在PEG基质中配制的栓剂比在脂肪酸栓剂基质中配制的栓剂具有更好的释放特性,表明释放良好,可以进一步研究作为儿童HIV治疗的更好的给药途径。
4.3 热敏液体栓剂,中空型栓剂,酒窝型栓剂 热敏液体栓剂在直肠内融化后属于热敏直肠凝胶,因制剂中使用的基础材料是在生理温度(37 ℃)下会变成凝胶的热敏聚合物[44]。黏度、胶凝时间和温度阈值是热敏液体栓剂制备的主要考虑因素。Mohamed等[45]通过使用甲基纤维素(MC)等黏膜黏附聚合物来优化和评估基于泊洛沙姆P407/P188的用于类风湿及风湿性关节炎治疗的托美汀钠热敏液体栓剂,分别对托美汀钠热敏液体栓剂与口服Rhumtol胶囊进行药代动力学分析。结果表明,与Rhumtol胶囊相比,生物利用度提高了4.6倍。液体栓剂可提高托美汀钠的直肠生物利用度和体内安全性。
中空型栓剂包含一个中空的腔,其中可填充固体、液体或半固体形式的药物[46]。中空型栓剂的固体外壳可由亲水性或亲脂性基质材料组成,并且可结合其他材料以赋予额外的黏膜黏附和缓控释性能。具有可控制药物的剂量和防止药物与基材发生相互作用的优点。据报道,中空型栓剂在治疗一些慢性疾病(如哮喘等)优于传统的栓剂[47]。Entidhar等[48]研究不同类型(常规和中空型)栓剂在不同基质中对非甾体类抗炎镇痛药吡罗昔康释放度的影响。与常规栓剂相比,吡罗昔康溶液形式的中空型栓剂达到最大释放度。
Matsumoto等[49]开发了胰岛素酒窝型栓剂,这些栓剂在嵌入药物的表面有一个或多个酒窝。将药物集中在栓剂表面的有限区域,将在直肠中产生更高的药物释放和吸收率。体外释放研究表明,单窝型栓剂的血糖水平高于三窝型栓剂,药物释放到50%的时间取决于用于密封的脂质熔点,而不是酒窝的数量。尽管单窝型栓剂的药物含量比三窝型栓剂少三分之一,在栓剂的有限表面积内浓缩胰岛素提高剂量给药可提高系统利用率,并减少吸收促进剂的用量。该技术可能为肠内渗透性差且不稳定的多肽和寡核苷酸等生物药物的肠内输送系统开辟新的途径。
5 结语
虽然直肠给药存在药物吸收不稳定、患者文化观念问题、可能引起的刺激、潜在的不适、粪便的存在和排便冲动或药物渗漏等缺点,部分患者直肠给药可接受度差[50],再加上国内市场直肠给药制剂的研发和应用较少等多种因素,阻碍了其在局部以及全身疾病治疗领域的发展进程。但其具有对易被酶解的蛋白质类药物、成分复杂而味道苦涩的中药、不适合口服给药的群体、直肠疾病等情况的独特优势和良好的应用前景,且在国家发展的宏观计划下,2017年由科技部牵头组织了重大新药创制科技重大专项课题申报工作,“直肠给药”明确纳入了国家的十三五规划,由此将直肠给药技术带入新高度。对直肠给药制剂应给予重视,深度开发对治疗结肠炎、慢性肠炎、前列腺炎等普药、老药的直肠给药制剂,也亟须突破给药装置种类少的问题,开发便于直肠给药、提高患者依从性的装置,以满足患者的需求。相信在广大科研人员的不懈努力下,直肠给药技术在应用范围和新剂型研究将进一步扩大,并加速从临床向个体给药转化。

