多配体蛋白聚糖-1细胞定位对人肝癌细胞侵袭的影响
赵晓雅,马 丛,孙美玲,于生金
(辽东学院 医学院,辽宁 丹东 118001)
肝癌是世界和亚洲发病率最高的恶性肿瘤之一[1]。目前,手术切除是治疗肝癌的首选方法,患者的5年生存率低于50%。肿瘤转移是危及恶性肿瘤患者生命的主要原因,而肿瘤细胞的异常侵袭是导致肿瘤转移的关键步骤[2]。精准靶向治疗已经成为恶性肿瘤治疗的发展趋势,因此,探讨肿瘤侵袭相关分子的表达模式,并探寻相关的干预靶点将有可能为新型抗肝癌药物的开发提供理论依据,为临床抗肝癌治疗提供新的方法和策略。
多配体蛋白聚糖-1(Syndecan-1,SDC-1)表达于细胞表面,是硫酸肝素蛋白聚糖家族成员之一,参与调控细胞黏附、分化、增殖等生理过程[3]。乙酰肝素酶(Heparanase,HPSE)是一种β-内切糖苷酶,能够降解细胞表面的SDC-1[4]。研究表明,肿瘤细胞表面SDC-1的定位发生异常改变与肿瘤的恶性进展密切相关,其中HPSE作用于SDC-1是导致SDC-1从肿瘤细胞表面脱落,进而促进肿瘤转移的重要因素[5],但该作用是否调控人肝癌转移还不明确。本研究旨在探讨SDC-1的定位改变对高转移人肝癌细胞MHCC97-H侵袭行为的影响。
1 材料与方法
1.1 细胞培养
人肝癌细胞MHCC97-H购自细胞生物学研究所(上海)。细胞生长在含有4.5 g/L葡萄糖和体积分数为10%的胎牛血清(Gibco,美国)的DMEM培养基(Gibco,美国)中,并在37 ℃和5%体积分数的CO2条件下培养。
1.2 HPSE小干扰RNA的转染
HPSE小干扰RNA(siHPSE)购自Santa Cruz公司(美国)。具体转染操作按照Invitrogen公司(美国)的脂质体Lipofectamine 2000转染说明书进行,以无关序列的小干扰RNA(siNC) 作为阴性对照。
1.3 低分子量肝素处理细胞
分别使用20、40 IU/mL的低分子量肝素(LMWH)(Pharmion公司,美国)处理MHCC97-H细胞,24 h后收集细胞进行后续实验,未处理的细胞作为对照。
1.4 荧光定量PCR(Real-time PCR)检测mRNA表达
使用TRIzol试剂(Invitrogen公司,美国)提取总RNA,按照TaKaRa公司(大连)的cDNA合成试剂盒合成cDNA。以cDNA为模板,进行Real-time PCR检测。以β-actin作为对照,采用2-△△CT法计算mRNA的相对表达量。
1.5 免疫细胞化学检测
不同处理组细胞在质量浓度为4%的多聚甲醛中固定10 min后用质量浓度1%的BSA封闭40 min。一抗为1∶100的SDC-1兔抗人单克隆抗体(Abcam公司,美国),二抗为1∶200的FITC标记的羊抗兔多克隆抗体(Santa Cruz公司,美国)。使用4',6-二脒基-2-苯基吲哚(DAPI)标记细胞核后,荧光显微镜下观察并拍照。
1.6 基质胶侵袭实验(Transwell)检测
每个transwell小室加入40 μL基质胶。含4×104个细胞的150 μL无血清培养基加入上室,500 μL体积分数为20%的胎牛血清的培养基加入下室,常规培养48 h后用质量浓度为4%的多聚甲醛固定15 min,用质量浓度为0.1%的结晶紫染色10 min后光学显微镜下观察并拍照,取侵袭细胞平均数。
1.7 统计学方法
2 结果
2.1 HPSE特异性小干扰RNA抑制HPSE的mRNA表达
为了验证SDC-1定位对人肝癌细胞侵袭能力的影响,利用HPSE特异性小干扰RNA和HPSE活性抑制剂低分子量肝素(LMWH)分别处理人肝癌细胞MHCC97-H,并用Real-time PCR法分析HPSE的mRNA表达变化。结果显示,与阴性对照(H/siNC)转染的细胞相比较,HPSE特异性小干扰RNA的转染(H/siHPSE)明显降低了细胞中HPSE的mRNA水平(P<0.05);与未处理(MHCC97-H)的细胞相比较,LMWH处理对HPSE的mRNA表达没有影响(图1)。

2.2 下调HPSE表达能够增加细胞表面SDC-1的定位
为了进一步验证HPSE表达及活性下调对SDC-1定位的调控作用,利用免疫细胞化学检测细胞表面SDC-1的表达情况,结果显示:与阴性对照转染(H/siNC)细胞相比,HPSE特异性小干扰RNA的转染(H/siHPSE)明显增加了细胞表面SDC-1的荧光染色强度;同样,与未处理的MHCC97-H细胞比较,LMWH处理后细胞表面SDC-1的荧光染色显著增强(图2)。
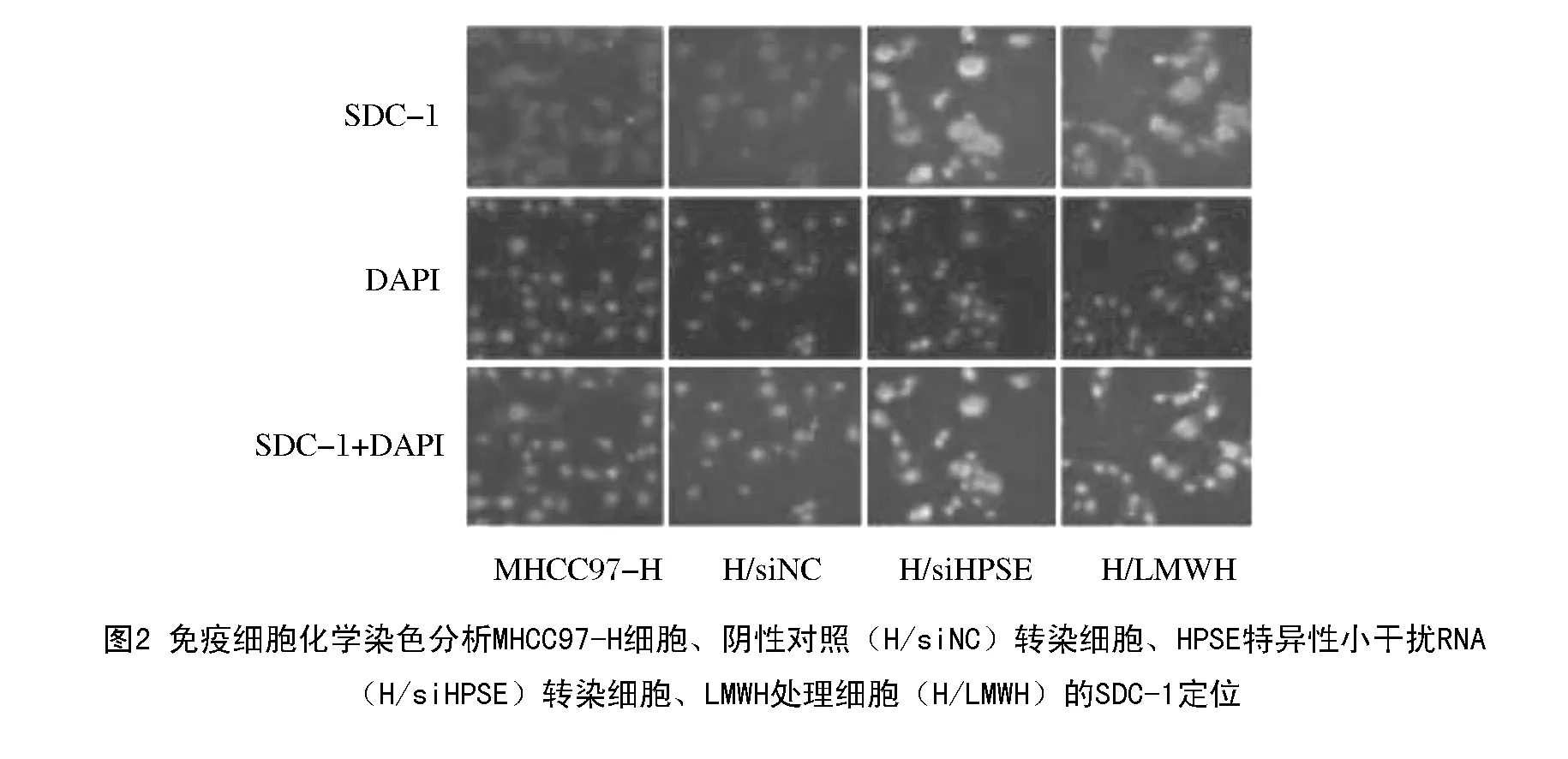
2.3 细胞表面SDC-1的定位增加能够抑制细胞侵袭
为了明确细胞表面SDC-1定位的增加对细胞转移行为的影响,应用基质胶侵袭实验分析了细胞侵袭能力的变化,结果显示:与阴性对照转染(H/siNC)相比,HPSE特异性小干扰RNA的转染(H/siHPSE)明显减少了细胞的侵袭数量;与未处理的MHCC97-H细胞比较,LMWH处理后细胞侵袭数量显著下降(图3)。
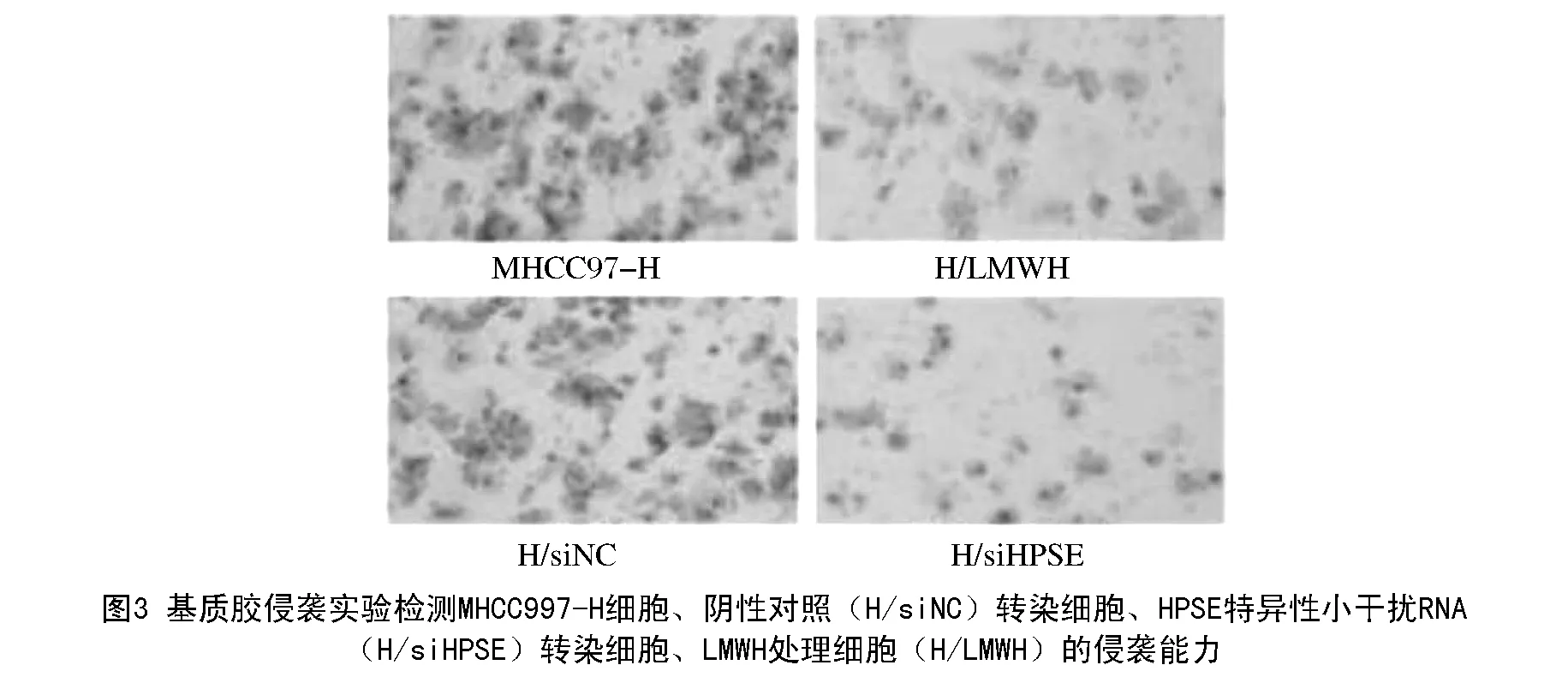
3 讨论
肿瘤转移的发生发展是一个恶性细胞扩散的多阶段有序过程,经典的从肿瘤起源到远处器官的定植转移过程主要由肿瘤在原发部位增殖失控、局部侵袭、肿瘤细胞渗入血管、在血管内生存、外渗和在远隔器官种植等基本步骤构成[6]。SDC-1是一种重要的跨膜蛋白聚糖,参与调节黏附、分化和增殖等细胞行为。研究表明,HPSE和SDC-1以协同作用方式共同介导包括癌症等在内的多种病理过程[7]。HPSE的上调通过作用于SDC-1促进单纯疱疹病毒的感染[8]。HPSE诱导的SDC-1脱落激活VEGFR依赖的骨髓瘤侵袭[9]。临床前和临床研究表明,以HPSE和SDC-1为靶点的治疗有望阻断癌症的恶性行为[10]。尽管HPSE和SDC-1分别在肝癌组织中呈现阳性表达,但它们之间的潜在关系、临床意义和对肝癌发生发展的影响机制还不明确。
研究发现,肝癌患者血清中检测到高水平的SDC-1能够判定的患者的预后较差[11]。有学者甚至预测,血清中的脱落型SDC-1有可能作为一种临床肝癌患者的诊断标志物[12]。但是SDC-1本身是一种表达于细胞膜表面的蛋白聚糖,为什么在转移性肝癌中会出现可溶性SDC-1?SDC-1这种定位的改变会如何影响肝癌的发生发展?这些问题需要进一步研究。本研究中,利用HPSE特异性小干扰RNA转染人肝癌细胞MHCC97-H后发现,HPSE的mRNA表达明显减少。重要的是,HPSE表达下调后SDC-1在细胞膜的定位显著增加,而且HPSE的抑制剂低分子量肝素处理细胞获得了同样的效果。因此,在肝癌患者中HPSE可能是导致SDC-1从肝癌细胞表面脱落进入血液的重要因素。
SDC-1参与Wnt信号体的形成,并活化多发性骨髓瘤中异常的Wnt/β-catenin信号和细胞增殖[13]。在血管内皮钙黏素依赖性内皮细胞侵袭过程中,SDC-1能够调控SDC-1、胰岛素样生长因子-1受体和整合素αVβ3复合体的形成[14]。本研究团队前期研究结果表明,在低转移小鼠肝癌细胞Hepa1-6中,SDC-1表达下调能促进细胞侵袭[15],而且高转移小鼠肝癌细胞Hca-F中SDC-1/VEGF-C复合物解离促进淋巴管内皮细胞增殖[16]。本研究发现,人肝癌细胞MHCC97-H表面SDC-1定位的增加,有效抑制了细胞的侵袭性。
综上所述,人肝癌细胞表面表达的SDC-1能够阻止细胞的转移行为,HPSE通过作用于SDC-1可以促进人肝癌细胞侵袭。因此,阻断HPSE与SDC-1之间的联系有可能为临床肝癌治疗提供新的思路。

