Merkel细胞癌合并原位鳞状细胞癌一例并文献复习
朱慧英 张朝霞 周桂芝 王建文 陈声利
山东第一医科大学附属皮肤病医院(山东省皮肤病医院),山东省皮肤病性病防治研究所,济南,250022
Merkel细胞癌(Merkel cell carcinoma,MCC)是一种罕见的、恶性皮肤神经内分泌肿瘤,通常表现为无症状、生长迅速的斑块或结节,主要发生在老年人的日光暴露部位,具有很高的转移率和死亡率。MCC可与鳞状细胞癌(squamous cell carcinoma,SCC)、鲍温病、基底细胞癌等皮肤肿瘤合并发生,其中SCC是MCC最常见的合并肿瘤,尤其在日光暴露部位,MCC合并SCC的发生率高达所有MCC的34%。我们在此报道一例发生在腰背部的MCC合并原位SCC,并对既往文献进行复习。
1 临床资料
患者,男,65岁。因“右腰背部红色斑块3年,破溃伴疼痛10个月”就诊。3年前,患者右腰背部无明显诱因出现一红色斑块,逐渐增大,无明显自觉症状,未予诊治。10个月前斑块出现破溃,有触痛。患者既往体健,否认系统疾病史。家族中无类似疾病患者。系统查体未见明显异常。皮肤科查体:右腰部见一5 cm×6 cm大红色斑块,边界清楚,斑块表面结痂,斑块中央可见一硬币大肿物,表面破溃(图1)。实验室检查:血常规、肝肾脂糖、凝血、血沉、C反应蛋白均未见异常。皮损组织病理示:(腰部)表皮大部分缺失、溃疡,切片一端少许表皮,细胞排列紊乱、细胞异型,溃疡下方见少许鳞状细胞团块,真皮浅深层嗜碱性小圆细胞呈条索状或片状致密浸润,核分裂象易见(图2)。免疫组化:真皮内浸润细胞CD56阳性(图3),CK20散在细胞胞质、核周点状阳性(图4),Syn散在细胞阳性,CgA散在细胞阳性,EMA部分细胞阳性,NSE、LCA、S100阴性,Ki67阳性细胞>90%,真皮浅层鳞状细胞CKpan、EMA阳性。诊断为皮肤Merkel细胞癌合并原位鳞状细胞癌。患者行肿瘤手术切除及植皮治疗,随访2个月未见复发。

图1 右腰部见一5 cm×6 cm大红色斑块,边界清楚,斑块表面结痂,斑块中央可见一硬币大肿物,表面破溃
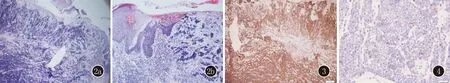
图2 表皮大部分缺失、溃疡,切片一端少许表皮,细胞排列紊乱、细胞异型,溃疡下方见少许鳞状细胞团块,真皮浅深层嗜碱性小圆细胞呈条索状或片状致密浸润,核分裂象易见(HE,2a×40;2b×200) 图3 浸润细胞CD56阳性(免疫组化,×40)
2 讨论
MCC是一种罕见的、具有高度侵袭性的原发性皮肤神经内分泌癌,好发于老年人的日光暴露部位,尤其是头颈部,具有很高的转移率和死亡率[1,2]。1972年由Toker首次描述,并将其称为“皮肤小梁癌”,由于肿瘤细胞类似Merkel细胞,后被命名为Merkel细胞癌[3]。据估计,MCC的发病率为0.6/105,是黑素瘤发病率的1/50[4,5]。患者的中位年龄为76岁,只有12%的患者年龄<60岁[3]。
其病因及发病机制尚未完全清楚,Merkel细胞多瘤病毒(Merkel cell polyomavirus,MCPyV)基因组的克隆整合和(或)慢性紫外线照射介导的高频率DNA突变在其发生发展中可能起重要作用,高达80%的单纯MCC病例中MCV阳性[3,6,7]。其他危险因素包括免疫抑制、老年人、白种人、非黑素瘤皮肤癌病史[1,4]。电离辐射[6,8]、人乳头瘤病毒感染[7,9]、风湿性关节炎[3]及慢性砷暴露[3,10]也可能与Merkel细胞癌的发生有关。根据是否合并MCV,MCC可分为MCV阳性的MCC和MCV阴性的MCC,前者与MCV感染相关,后者与紫外线相关的P53、RB1高频率突变有关[3,4,11]。
MCC可与鳞状细胞癌、鲍温病、基底细胞癌等皮肤肿瘤伴发,其中鳞状细胞癌是最常见的并发肿瘤,占所有Merkel细胞癌的5%~34%[2,4]。MCC合并SCC的发病机制有以下2种解释:(1)来源于共同的多能干细胞前体(如毛囊多能干细胞);(2)对同一危险因素如紫外线辐射的共同反应[2,9,12]。与单纯MCC与MCPyV的密切关系不同,在MCC/SCC病例中,MCPyV通常阴性,这意味着MCC合并肿瘤与单纯MCC可能有不同的潜在发病机制[2,4-6,11]。Pulitzer等提出MCC合并SCC的发病机制可能更类似于单纯SCC,显示与紫外线相关的TP-53和RB-1突变[2,4,7]。与单纯MCC相比,MCC合并SCC发病年龄更大,具有更强的侵袭性、更高的转移率(分别为40%和77%)和更差的预后(生存期分别为54和41个月)[4-6,13]。 有文献报道MCC/SCC可表现出与单纯MCC不同的免疫表型[2]。
临床上,通常表现为快速生长的、孤立的紫红色斑块、结节,一般无明显症状,表面也可发生溃疡,通常发生在日光暴露部位,尤其是头颈部(41%~50%),其次是四肢(32%~38%)、躯干(12%~14%)。皮肤镜下,MCC合并SCC皮损表现为上覆少量鳞屑的结节或斑块,周围见小的点状血管和短的线状不规则血管,位于中央的粉红区域可见大直径的树枝状血管[13]。皮肤镜下观察到的多形性血管病变可能是MCC合并SCC的一个提示[13]。
考虑到MCC的非特异性临床表现,组织病理学及免疫组化染色对正确诊断至关重要[3]。组织病理学表现为:真皮层蓝色的小圆形或卵圆形细胞,常呈片状、巢状或小梁样生长,胞浆少,有丝分裂活跃,常见单个细胞坏死和带状坏死。免疫组化染色常显示CK20和神经内分泌标志物(Syn、CgA、NSE、CD56)阳性,87%~95%的MCC患者CK20呈核旁点状阳性,TTF-1阴性,可与小细胞肺癌鉴别[2,9]。
治疗及预后:本病预后差,约40%的患者出现远处转移,病变局限者、局部淋巴结转移、远处转移患者的5 年生存率分别为 51% 、35%、14%[8,11,14]。MCC的死亡率为33%~46%,高于目前黑素瘤的病死率。MCC最常在诊断后2年内复发,但也有MCC合并SCC自发缓解的报道,其原因可能是活检手术激起了自身免疫反应[15]。肿瘤扩大切除仍为一线治疗,2 cm以上的肿瘤,手术切缘至少距肿瘤边缘2 cm,并做前哨淋巴结活检,以便对肿瘤进行分期。鉴于Merkel细胞癌对放疗敏感,放疗是术后辅助治疗手段,尤其是对高危患者,放疗也可用于姑息性及复发患者的治疗。对于晚期或难治性MCC,化疗可作为治疗选择,虽然应答率尚可,但应答时间短暂,中位无进展生存期仅为3个月。近年来,靶向PD1-PDL1途径的检查点免疫治疗显示了持久的高应答率,对MCV阳性或阴性患者均有反应,无进展生存期长达1年,被作为晚期MCC患者的一线治疗[3,14]。

