TRPC1在喉癌组织中的表达及临床意义研究*
王 全,王子澳,周 柯,陈 攀*
(1.湖北科技学院医学部基础医学院,湖北 咸宁 437100;2.桂林医学院附属医院)
头颈肿瘤是目前患者数较多的肿瘤之一,其中喉癌(LSCC)是头颈肿瘤中发病率较高的恶性肿瘤,也是呼吸道肿瘤中发病率较高的恶性肿瘤[1],它的病理类型主要以鳞状细胞癌为主。随着目前工业的迅速发展,人们生活环境的污染越来越严重,喉癌每年以25%的比例呈逐年增长[2]。患病因素主要是吸烟,其次是空气污染,其他的流行因素还包括职业因素、体内激素水平失调、病毒感染等。喉癌目前的治疗方法是手术为主,放化疗联合辅助治疗为辅。保守治疗对于早期患者的3年无病生存率到达80%以上,5年生存率可以达到60%[3]。但是对于复发或者局部转移的患者,中晚期喉癌的患者5年的存活率大约为25%~70%,发生淋巴结转移的患者死亡率约占无淋巴结转移患者的2.8倍[4]。因此,要想深入了解喉癌的病理特征与治疗,找寻新的肿瘤标志物成为解决问题的关键。
研究表明TRPC家族参与许多肿瘤的发生与发展,TRPC家族的分支中TRPC3促进了卵巢癌的形成,TRPC6参与了肝癌、前列腺癌等癌症的发生[5]。本项实验课题运用免疫组织化学法研究TRPC1在喉癌组织中的表达并进一步探讨该因子在喉癌的临床诊断及治疗中的潜在价值。
1 材料与方法
1.1 研究材料
收集桂林医学院附属医院2008年1月至2014年1月经耳鼻咽喉-头颈肿瘤外科及病理科诊断的喉癌患者石蜡组织标本78例,其中男70例,女8例;年龄37~81岁,平均(62.41±0.13)岁;通过国际抗癌协会(UICC)2002年(第6版)公布的TNM分类分期修改方案:其中Ⅰ期10例,Ⅱ期28例,Ⅲ期17例,Ⅳ期23例;有淋巴结转移25例,无淋巴结转移53例。分别取上述喉癌患者的喉癌组织和癌旁组织,再取23例正常成人喉部组织的石蜡标本作为对照组。对所有喉癌患者随访1~3年,确定死亡病例为19例,失访病例18例,复发病例19例。
1.2 免疫组织化学法
石蜡切片经过脱蜡、脱苯、EDTA抗原修复液高温高压抗原修复。3%双氧水阻断内源性过氧化物酶活性,3%BSA进行血清封闭后滴加TRPC1抗体(1∶100),室温孵育60min,PBS漂洗3次,每次5min,滴加与 Ⅰ 抗相应种属的 Ⅱ 抗(1∶1 000),室温孵育15min,PBS漂洗3次,每次5min。DAB显色、水洗,苏木素复染,中性树胶脱水封片。
1.3 统计学方法
采用SPSS 20.0软件进行统计分析,描述性技术资料通过卡方检验,相关性分析通过配方设计卡方检验和Kappa一致性检验,生存时间分析采用Kaplan-Meier法及COX回归分析法,以P<0.05为差异具有统计学意义。
2 结 果
2.1 免疫组化结果
TRPC1蛋白表多数达于细胞的内质网中,也可表达于胞质、包膜、胞内囊泡等部位,组织切片中,细胞为淡黄色至棕褐色者为阳性细胞。见图1。
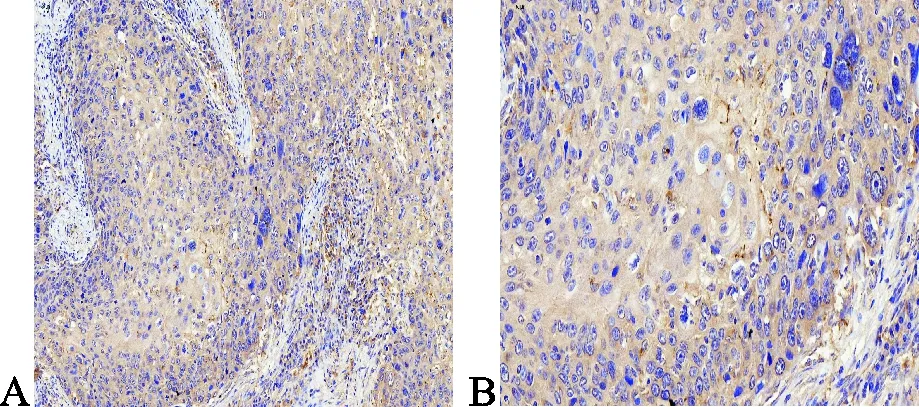
喉癌组织×200 喉癌组织×400

正常组织×200 正常组织×400
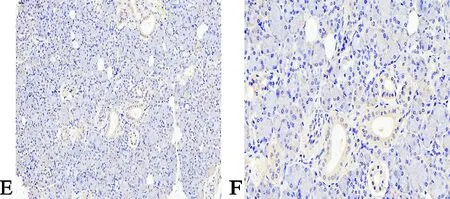
癌旁组织×200 癌旁组织×400
2.2 TRPC1在喉癌组织、癌旁组织、正常组织中的表达
经检测,TRPC1在喉癌组织的阳性表达率为71.8%(56/78),在癌旁组织中的阳性表达率为21.8%(17/78),在正常组织中的阳性率为8.7%(2/23),TRPC1在喉癌组织的表达要高于癌旁组织和正常组织,差异具有统计学意义(P<0.01)。
2.3 TRPC1在喉癌组织中的表达和临床病理特征相关性
TRPC1在喉癌组织中的表达与淋巴结转移、复发等特征有相关性(P<0.01);与年龄、性别、临床分期等无相关性。见表1。

表1 TRPC1在喉癌组织中的表达和临床病理特征相关性
2.4 生存时间分析
TRPC表达阳性及阴性组的患者生存情况Kaplan-Meier方法计算。TRPC阳性组及阴性组生存均值分别为(48.309±2.457)月和(56.818±2.145)月;阳性95% CI:43.494~53.125,阴性95% CI:52.614~61.023;log rank检验P=0.041。TRPC阳性和阴性对患者生存时间差异有意义。见图2。
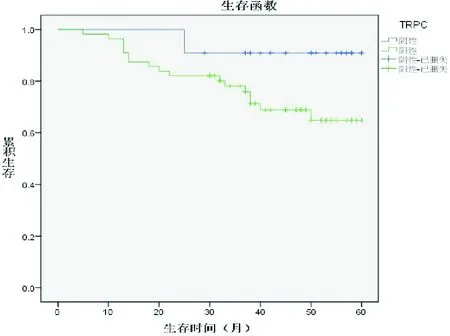
图2 TRPC1表达阳性和阴性的生存分析(删除失访的患者)
2.5 Cox回归分析
使用Cox回归分析,从是否复发、是否有淋巴结转移2个因素来分析影响生存率的因素。结果显示,复发情况95% CI相对危险度为69.781,P<0.001;淋巴结转移情况的95%CI相对危险度为5.889,P=0.008;说明是否复发和是否有淋巴结转移情况差异均具有统计学意义。见表2。
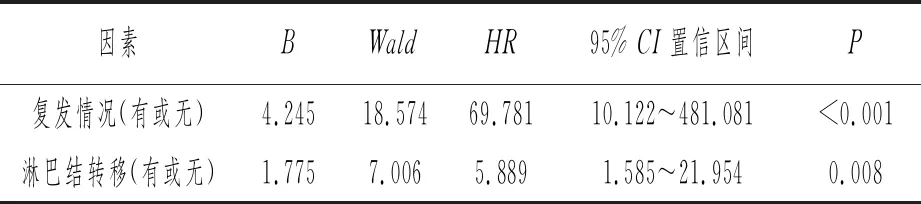
表2 Cox回归分析喉癌组织预后相关因素
3 讨 论
喉癌作为国内最常见的头颈部恶性肿瘤,它的发病呈线性增高趋势,目前国内的治疗手段是手术为主,综合治疗为辅[6],对于早期声门型喉癌,放化疗及探索中的生物治疗能够有效的保全患喉功能,已成为患者的首选[7]。但对于中晚期的患者,保守治疗难以达到预期效果,许多患者难以耐受药物的副作用且复发率较高。因此,很多中晚期的喉癌患者会选择部分喉切除术甚至全喉切除术,患者术后会出现长久性的声音嘶哑甚至丧失声音、吞咽功能紊乱、呼吸道感染等术后并发症[8-9]。因此,寻找合理治疗癌症的生物因子及确定治疗方案后需检测的重要指标是目前医学急需解决的关键问题。
TRPC1作为TRP的哺乳类同源物,在人类中,它定位于三号染色体上,该蛋白由六个跨膜段组成,N-末端和C-末端都位于细胞质内,连接跨膜段5和6的胞外环参与了离子孔区域的形成在细胞内[10],TRPC1存在于内质网、细胞膜、胞内囊泡和纤毛中,可以把它看做一种类似于天线的感觉器官。作为信号传导的一个平台,在许多组织中,它都表现了密不可分的作用[11]。TRPC1通过与多种蛋白相互结合与作用,借助ROCE及SOCE介导其对Ca2+通道的影响,从而调整细胞中Ca2+的平均水平。目前研究最多的就是借助SOCE(钙库操纵性钙内流)通道,有研究[12]表明SOCE发生在细胞内的等离子体膜域内,SOCE通道在分子组件间产生的激活和失活的等离子膜促进了直接的物理或功能的耦合,SOCE被激活后刺激与细胞内Ca2+的动员相关的等离子体膜受体。虽然有以上资料表明,激活SOCE的信号是在内质网中产生,但目前还不知道SOCE激活或失活的机制。在以往的研究中显示,Ca2+信号涉及的关键分子与窝泡的脂质皮具有关,从而暗示了Ca2+信号中的小凹的重要性,同时TRPC1与TRPC3和支架蛋白Cav1相关,并在一个含有关键Ca2+信号蛋白的复合物中进行组装,所以有学者提出SOCE通道的调控是通过TRPC1相关复合物或在复合物中补充相关蛋白质来完成[13]。目前有文献[14]表明,TRPC1中有两个Cav1结合位点,重要的是,在全长或C端截断的TRPC1中删除N-末端的Cav1结合域,就阻止了蛋白质的质膜定位,对SOCE产生了显性的负面影响,显著降低了Ca2+的流入,然而相反的是,如果删除的是C端自身,包括C-末端的Cav1结构域,并不会改变TRPC1的结构域。因此,TRPC1等离子体膜的定位依赖于N端的相互作用。总的来说,TRPC1与Cav1的相互作用在TRPC1的转运过程中扮演了关键的角色,它被组装成与其他关键Ca2+信号蛋白结合的信号复合物,除了作为信号复合物组装的平台外,Cav1蛋白还作为一种负调控因子参与小泡的转运,所以Cav1的作用是巨大的[15]。
综上所述,尽管SOCE在十多年前首次被描述,但其调控机制尚不清楚,根据相关研究,我们只能知道SOCE与一种关键的Ca2+信号蛋白的血浆膜信号复合物有关[16]。与此相一致的是,TRPC1、TRPC3和TRPC4等一些TRPC通道已被报告与这个信号通路的一个或多个成员有关,之前描述TRPC1的等离子体膜定位依赖于一个N-末端Cav1结合位点[17],当等离子体膜发生局部化时,就抑制了TRPC1的产生,继而抑制SOCE通道的生成。所以Cav1有助于在血浆膜窝脂质筏域中形成含有TRPC1的SOCE通道。接下来需要进一步研究确定如何刺激Ca2+信号级联结果激活这些SOCE通道。
SOCE的激活通常用来响应PIP2水解、IP3生成和IP3介导的Ca2+从内质网中释放的等离子体膜受体的刺激,它的主要触发器就是内质网内Ca2+的流失,因为Ca2+对许多与肿瘤组织的进展起重要作用的功能细胞有重大影响,如细胞的增殖、分化与血管的形成[18-19]。因此,TRPC1作为可调控Ca2+功能的非选择性阳离子通道。有研究表明,人肾癌A498细胞在TRPC1下调后,PI3K和AKT的表达水平均较之前降低;在肝癌细胞中,也有学者通过RNAsi技术有效的抑制基因和细胞的表达,从而发现TRPC1 siRNA转染HCCLM3后,HCCLM3细胞在缺氧条件下的恶化能力较之前下降[20]。
在本次实验研究中,TRPC1在喉癌组织中的阳性表达率达到71.8%,与癌旁组织21.8%及正常组织的阳性表达率8.7%相比较,说明TRPC1参与了喉癌的发生与发展。在淋巴结转移和复发的喉癌组织中,TRPC1的阳性表达率分别为96.0%和94.7%,与非淋巴结转移的喉癌组织60.4%和未复发的喉癌组织64.4%相比,说明TRPC1与肿瘤组织的侵袭性与恶性程度呈正相关性,提示我们可能是因为当细胞内的Ca2+被消耗过多时,激活了细胞质内的TRPC1通道,促使细胞质内的Ca2+浓度大量增加,使得细胞异常增殖和非正常分化,从而导致肿瘤的扩散和恶化,但其中具体的作用机制还有待于进一步研究和讨论。
通过本次实验运用免疫组织化学法研究TRPC1在喉癌组织中的表达得出TRPC1的高阳性率表达与肿瘤的淋巴结转移和复发有密切的关系,我们可以通过抑制TRPC1通道,起到阻断Ca2+向细胞内流动的作用,在一定程度上阻止喉癌组织的进一步扩散与恶化。在未来的某一天,TRPC1不仅可以作为喉癌患者的诊断及复查依据,也可以为喉癌的治疗提供了一个新的方向与思路。

