超高效液相色谱-四极杆/静电场轨道阱高分辨质谱快速测定乳及乳制品中21种真菌毒素
何卓霖,穆 蕾 ,王 涛,王 亮, ,谢云峰
(1.新疆大学生命科学与技术学院,新疆乌鲁木齐 830046;2.中粮营养健康研究院,营养健康与食品安全北京市重点实验室,北京 102209)
真菌毒素是由产毒真菌在一定条件产生的次级代谢产物,大多数有致癌、致畸、致突变的作用,对人体及动物的健康产生极大影响[1-4]。乳及乳制品中的真菌毒素来源于动物食用被真菌毒素污染的饲料,这些毒素通过食物链直接或间接地危害人和动物的健康,如奶牛食用被黄曲霉毒素、伏马毒素和呕吐毒素等真菌毒素污染的饲料后,在挤出的鲜奶中可检测到相应的真菌毒素及其代谢物[5-8]。此外,以乳类和乳蛋白为原料的各种添加制品也有真菌毒素污染的风险,如谷物或水果添加乳制品。Yang等[9]利用稳定同位素结合液相色谱串联质谱技术建立了测定液态奶中17种真菌毒素的检测方法,并在谷物和红枣添加液态奶中检测到黄曲霉毒素M1、脱氧雪腐镰烯醇、伏马菌素B1和B2、玉米赤霉烯酮等毒素。Mao等[10]利用超高效液相色谱-四极杆静电场轨道阱质谱联用技术测定生牛乳中的真菌毒素,研究表明生牛乳中除了含有国家限量的黄曲霉毒素M1外,还有玉米赤霉烯酮及其衍生物以及赭曲霉毒素等。目前我国、美国和欧盟等国家和组织都对乳及乳制品中黄曲霉毒素M1设定了较为严格的限量标准[11-13],但均未对其它种类毒素作明确规定,存在目标物种类覆盖不全面和忽视了毒素衍生物的潜在危害等问题。为更好的监测乳及乳制品中的真菌毒素,开发简单、快速、准确的多真菌毒素前处理和检测方法非常有必要。
乳及乳制品基质复杂并且各真菌毒素结构差异较大,因此对样品前处理以及检测技术要求较高。目前常用的前处理方法有固相萃取、免疫亲和柱净化和QuEChERS法等,其中免疫亲和柱净化具有高效性、专一性和基质干扰小等优点而应用广泛,但成本较高且无法对多种真菌毒素同时净化[14-17]。仪器方法主要有高效液相色谱法、高效液相色谱-串联质谱法、气相色谱-串联质谱法等[18-21],高效液相色谱-串联质谱法检测灵敏度高,抗干扰能力强,可对食品中的真菌毒素进行准确定量因此应用较广泛。近年来,由于静电场轨道阱高分辨质谱具有高通量、高选择性和高分辨率等优势,能够在超高分辨率下测定化合物及其碎片离子的精确分子质量并且能够有效降低基质干扰,适用于多种目标化合物的筛查和定量研究[22-24],在此基础上建立的超高效液相色谱-高分辨质谱联用分析技术在痕量多组分分析检测方面得到越来越多的应用[25-26],然而应用于乳制品中多真菌毒素检测方法的报道较少,因此,开发适用于乳及乳制品中多真菌毒素的筛查技术具有非常重要的现实意义和应用价值。
乳及乳制品中含有大量蛋白质、脂质以及水分会对真菌毒素检测造成干扰,快速、高效的前处理方法是检测乳及乳制品中真菌毒素的关键,利用多功能净化柱的前处理方法能够有效去除蛋白质和脂质干扰,减少样品处理时间。本研究围绕液态和粉状乳及乳制品,针对其中蛋白质、脂质、乳糖、水分等的含量特点,通过优化萃取溶液和筛选多功能净化柱结合超高效液相色谱-四极杆/静电场轨道阱高分辨质谱,建立乳及乳制品中21种真菌毒素快速测定的方法,该方法具有前处理简单、分析时间短和灵敏度高等优点,可实现乳及乳制品中多真菌毒素的快速测定,为真菌毒素的有效监测提供有力的技术支持。
1 材料与方法
1.1 材料与仪器
黄曲霉毒素混合标准液:黄曲霉毒素B1(AFTB1)2 μg/mL、黄曲霉毒素 B2(AFTB2) 0.5 μg/mL、黄曲霉毒素 G1(AFTG1) 2 μg/mL、黄曲霉毒素 G2(AFTG2)0.5 μg/mL、黄曲霉毒素 M1(AFTM1) 0.5 μg/mL、黄曲霉毒素 M2(AFTM2) 10 μg/mL;呕吐毒素混合标准液:呕吐毒素(DON) 100 μg/mL、3-乙酰脱氧雪腐镰刀菌烯醇(3-AC-DON) 100 μg/mL、15-乙酰脱氧雪腐镰刀菌烯醇(15-AC-DON) 100 μg/mL、T-2毒素(T-2) 100 μg/mL、HT-2 毒素(HT-2) 100 μg/mL、伏马毒素 B1(FB1) 50 μg/mL、伏马毒素 B2(FB2) 50 μg/mL、伏马毒素 B3(FB3) 50 μg/mL、赭曲霉毒素A(OTA) 10 μg/mL、赭曲霉毒素 B(OTB) 10 μg/mL美国Romer公司;玉米赤霉烯酮混合标准溶液:玉米赤霉酮(ZAN) 100 μg/mL、赤霉烯酮(ZEN)100 μg/mL、α-赤霉醇(α-ZAL) 100 μg/mL、β-玉米赤霉醇(β-ZAL) 100 μg/mL、α-玉米赤霉烯醇(α-ZEL)100 μg/mL、β-玉米赤霉烯醇(β-ZEL) 100 μg/mL上海安谱科技实验股份有限公司;实验用液态乳制品(如纯牛奶、酸奶、水果和谷物添加奶等)和粉状乳制品(如婴幼儿配方乳粉、脱脂乳粉等) 均购自市场超市;甲醇、乙腈 色谱纯,美国sigma公司;甲酸色谱纯,霍尼韦尔贸易(上海)有限公司;甲酸 98%,国药集团化学试剂有限公司;超纯水 Mili Q纯水机制得。
Captiva-EMR Lipid 净化柱(600 mg,6 cc) 安捷伦科技有限公司;Oasis PRIME-HLB 净化柱(200 mg,6 cc)、CORTECS-UPLC-C18柱(2.1 mm×100 mm,1.6 μm) 上海安谱实验科技股份有限公司;Accucore C18柱(2.1 mm×100 mm,2.6 μm) 美国Thermo Fisher Scientific 公司;Q-Exactive 四极杆/静电场轨道阱高分辨率质谱仪配备Transcend Ⅰ 液相色谱仪 美国Thermo Fisher Scientific公司;4-20R台式高速冷冻离心机 湖南可成仪器设备有限公司;ZX-DC型氮吹仪 北京众信佳仪科技有限公司;Milli-Q Advantage超纯水系统 美国Millipore公司;Dragon Lab QL902涡旋振荡器、SB-120DTN超声波清洗机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 混合标准中间溶液的配制 分别移取一定体积的21种真菌毒素储备液于5 mL容量瓶中,加入适量80%乙腈水溶液稀释并定容至刻度线,得到21种真菌毒素混合标准中间溶液,各真菌毒素的浓度见表1,充分混匀后于-20 ℃冰箱内避光保存。

表1 真菌毒素混合标准中间液浓度Table 1 Concentration of mycotoxins mixed standard intermediate solution
1.2.2 样品前处理 准确称取(2.00±0.05)g 液态或粉状乳及乳制品,置于50 mL聚丙烯离心管中,粉状样品先加入2 mL水后涡旋振荡使其充分混匀,所有样品再加入 8 mL乙腈-甲酸(98:2,v:v)溶液,涡旋1 min,30 ℃、50 赫兹超声提取 20 min,8000 r/min离心10 min,取上清液于10 mL聚丙烯离心管中,涡旋30 s,取5 mL上清液过Captiva-EMR Lipid净化柱净化,加正压,控制流速在每秒3滴,使提取液流出净化柱,加入 1 mL 乙腈-水(80:20,v:v)淋洗液洗脱,加正压吹干,合并淋洗液,置于40 ℃水浴中氮气吹至近干,加入 250 μL 乙腈-水-甲酸(30:70:0.1,v:v:v)复溶,涡旋振荡1 min,超声5 min,将复溶液转移至2 mL离心管中,12000 r/min离心10 min,取上清液于带有内插管的进样瓶中。
加标阴性样品前处理:准确称取(2.00±0.05)g液态或粉状乳及乳制品,置于50 mL聚丙烯离心管中,粉状样品先加入2 mL水后涡旋振荡使其充分混匀,根据需要加入一定体积的混合标准中间溶液,其余步骤均与上述步骤相同,利用加标阴性样品进行方法学验证。
1.2.3 色谱条件 21种真菌毒素依据其化学性质分别在正、负离子模式下进行数据采集,色谱条件如下:色谱柱:CORTECS-UPLC-C18柱(2.1 mm×100 mm,1.6 μm);流速:0.2 mL/min;进样量:10 μL;流动相A:含0.1%甲酸水溶液;流动相B:甲醇。梯度洗脱条件如表2。

表2 梯度洗脱程序Table 2 Gradient elution program
1.2.4 质谱条件 离子源:加热电喷雾离子(HESI)源;扫描方式:正/负离子模式扫描;采集模式:全扫描/数据依赖二级扫描(Full MS/ddMS2);离子源温度:350 ℃;毛细管加热温度:320 ℃;鞘气(N2)流速:40 unit;辅助气(N2)流速 15 unit;喷雾电压:(±)3.00 kV;Full MS扫描分辨率(R):70000;自动增益控制进入轨道阱中的离子数(AGC target):3×106;最大驻留时间:100 ms;扫描范围:100~1000 m/z;ddMS2 扫描分辨率(R):17500;自动增益控制进入轨道阱中的离子数(AGC target):1×105;最大驻留时间:50 ms;Top N:5;碰撞池能量(NCE):20、30、40;实验室所用气体均为高纯氮气。
1.2.5 定性定量方法 结合高分辨质谱的精确质量数,采用保留时间和两个碎片离子进行定性,一级母离子进行定量,21种真菌毒素的保留时间、分子离子准确质量以及碎片离子准确质量等见表3。

表3 21种真菌毒素的保留时间和选择离子的准确分子量Table 3 Retention time of 21 mycotoxins and accurate molecular weight of selected ions
1.3 数据库的建立
精确吸取“1.2.1”标准中间溶液 200 μL,置于带内插管的进样瓶中,按质谱色谱条件进样,通过一级全扫描获得目标物的精确质量数和保留时间,同时结合数据依赖性二级扫描模式获得目标物的二级特征质谱图和二级碎片离子,将信息输入软件TraceFinder中,建立质谱数据库,利用目标物的精确质量数和保留时间进行定量和定性,同时结合二级扫描质谱图为准确定性提供保障。
2 结果与分析
2.1 提取条件的优化
针对液态和粉状的乳及乳制品中蛋白质、脂质、乳糖、水分等的含量特点,分别优化萃取液配比以实现21种真菌毒素同时提取。对于粉状乳制品,分别使用 10 mL 乙腈:水:甲酸=80:18:2(v:v:v)的提取液提取和先加入2 mL水溶解样品再加入8 mL乙腈:甲酸=98:2(v:v)提取,21种真菌毒素的回收率如图1所示。相比粉状乳制品,液态样品水分含量较高,分别考察使用 8 mL乙腈:水:甲酸=80:18:2(v:v:v)的提取液和 8 mL 乙腈:甲酸=98:2(v:v)提取,21种真菌毒素的回收率如图2。实验结果表明,对于粉状乳制品应先加2 mL水溶解再加8 mL乙腈:甲酸=98:2(v:v)提取,液态样品直接加入8 mL乙腈:甲酸=98:2(v:v)提取即可,以上两种针对不同类型乳制品的提取方法均可实现21种真菌毒素的统一前处理并保证各毒素目标物回收率均满足要求。

图1 提取液对粉状乳制品中各真菌毒素回收率的影响Fig.1 Effects of extract on the recovery rate of mycotoxins in powdered dairy products

图2 提取液对液态乳制品中各真菌毒素回收率的影响Fig.2 Effects of extract on the recovery rate of mycotoxins in liquid dairy products
2.2 净化柱的筛选
乳及乳制品经提取液提取后仍含有大量的蛋白质、脂质、矿物质等,会对真菌毒素的检测造成干扰,且不同真菌毒素的理化性质相差较大,因此选择合适的净化方式非常重要。目前针对多种真菌毒素同时净化的方法主要有QuEChER法[5,27]和多功能净化柱法[5,28],QuEChER法需要几种净化剂单一或组合对样品进行净化,存在对部分真菌毒素的吸附作用容易造成毒素损失[22,27];而常用的MycoSpin 400多功能净化柱填料对于赭曲霉毒素A、伏马毒素FB1、伏马毒素FB2及3-乙酰基脱氧雪腐镰刀菌烯醇等毒素具有吸附作用,使得毒素的回收率降低,影响定量结果[28-29]。本研究选取两种多功能净化柱并考察其对于21种真菌毒素的净化效率,Captiva-EMR Lipid净化柱具有较高选择性,能够高效去除蛋白质和脂质,且Captiva-EMR Lipid净化柱不需活化,减少样品处理时间[29-30];Oasis PRIME-HLB一种新型的反相固相萃取(SPE)小柱,不需要平衡活化可直接上样,属于过滤型去除杂质的固相小柱,极大简化SPE流程[31-32]。比较使用Captiva-EMR Lipid柱和Oasis PRIME-HLB柱的净化后响应信号,发现使用Captiva-EMR Lipid柱净化21种真菌毒素的回收率均可满足要求,两种净化柱对真菌毒素回收率影响结果如图3所示。

图3 不同净化柱对各真菌毒素回收率的影响Fig.3 Effects of different purification columns on the recovery rate of each mycotoxin
2.3 色谱条件的优化
2.3.1 色谱柱的选择 对比CORTECS-UPLC-C18柱(2.1 mm×100 mm,1.6 μm)与Accucore C18柱(2.1 mm×100 mm,2.6 μm)的分离效果。结果表明, CORTECS-UPLC-C18柱峰型更加对称,且色谱柱填料粒径较小,能达到较好的分离效果。
2.3.2 流动相的优化 分别考察在水相中添加0.1%甲酸和5 mmol/L甲酸铵的分离效果。结果表明,目标化合物在0.1%甲酸水-甲醇流动相中分离度较好。在流动相中加入适量的甲酸可以提高分析物的离子响应强度和分离度。以0.1%甲酸水-甲醇流动相时,各目标化合物的质谱响应强度高、保留时间稳定,峰型较好。21种真菌毒素提取离子流色谱图见图4。

图4 21种真菌毒素提取离子流色谱图Fig.4 Extracted ion current chromatogram of the 21 mycotoxins
2.4 质谱条件的优化
2.4.1 喷雾电压的优化 离子源采用HESI源,对比了2.8、3.0、3.5 kV的喷雾电压对目标化合物电离程度的影响。结果表明,喷雾电压为3.0 kV时,目标化合物较易电离,在此喷雾电压条件下有很好的离子化效率。
2.4.2 碰撞能量的优化 能量直接影响目标化合物二级谱图信息的丰富程度。碰撞能量低,目标化合物分子离子的响应强度高,但得到的二级碎片信息少。增大碰撞能量,会导致目标化合物分子离子的响应逐渐减弱,碎片离子增多。对于不同正、负离子,本实验考察了10~50和-10~-50 eV碰撞电压的影响。为得到信息更为全面的MS/MS谱图,选取三种不同碰撞能采集的谱图进行叠加,作为最终的MS/MS谱图,最终选取的正离子模式的碰撞能为20、30、40 eV,负离子模式的碰撞能为-20、-30、-40 eV。
2.4.3 采集模式的优化 在优化质谱采集参数时,同时考察21种毒素在正、负离子模式下的响应值,发现6种黄曲霉毒素、3种伏马毒素、2种脱氧雪腐镰刀菌烯醇类以及T-2与HT-2毒素在正离子模式响应较强,其余毒素则在负离子模式下响应较强,并且T-2与HT-2毒素的母离子[M+NH4]+峰响应较[M+H]+峰更强。
2.5 基质效应的影响
通过空白基质配标校准曲线的斜率与溶剂配标校准曲线的斜率百分比值定义方法的基质效应(信号增强或抑制),该比值代表了干扰物对目标分析物离子化效率的影响。21种真菌毒素基质效应结果见图5,从图5可以看出,黄曲霉毒素G1、G2,伏马毒素类在乳及乳制品中基质增强效应明显,玉米赤霉烯酮、T-2毒素、HT-2毒素在乳及乳制品中基质抑制效应明显,其它毒素的基质效应尚在可接受范围(80%~120%)。为补偿基质效应的影响,选用基质配标法进行目标物的定量分析,外标法定量。

图5 21种真菌毒素的基质效应Fig.5 Matrix effects of 21 mycotoxins
2.6 方法学考察
2.6.1 标准曲线、检出限和定量限 取空白样品基质溶液准确配制不同质量浓度的真菌毒素混合标准溶液,采用逐级稀释方法获得21种真菌毒素的定量限,以3倍信噪比(S/N)确定化合物检出限(LOD)、10倍信噪比确定不同化合物的定量限(LOQ)。经高分辨质谱检测,以峰面积(Y)为纵坐标,质量浓度(X,μg/L)为横坐标绘制标准曲线,结果如表4所示,在质量浓度范围内21种真菌毒素色谱峰面积与质量浓度呈良好线性关系,相关系数r均大于0.99,检出限(LOD)为 0.3~31.2 μg/kg,定量限为(LOQ)为 1.0~93.8 μg/kg。
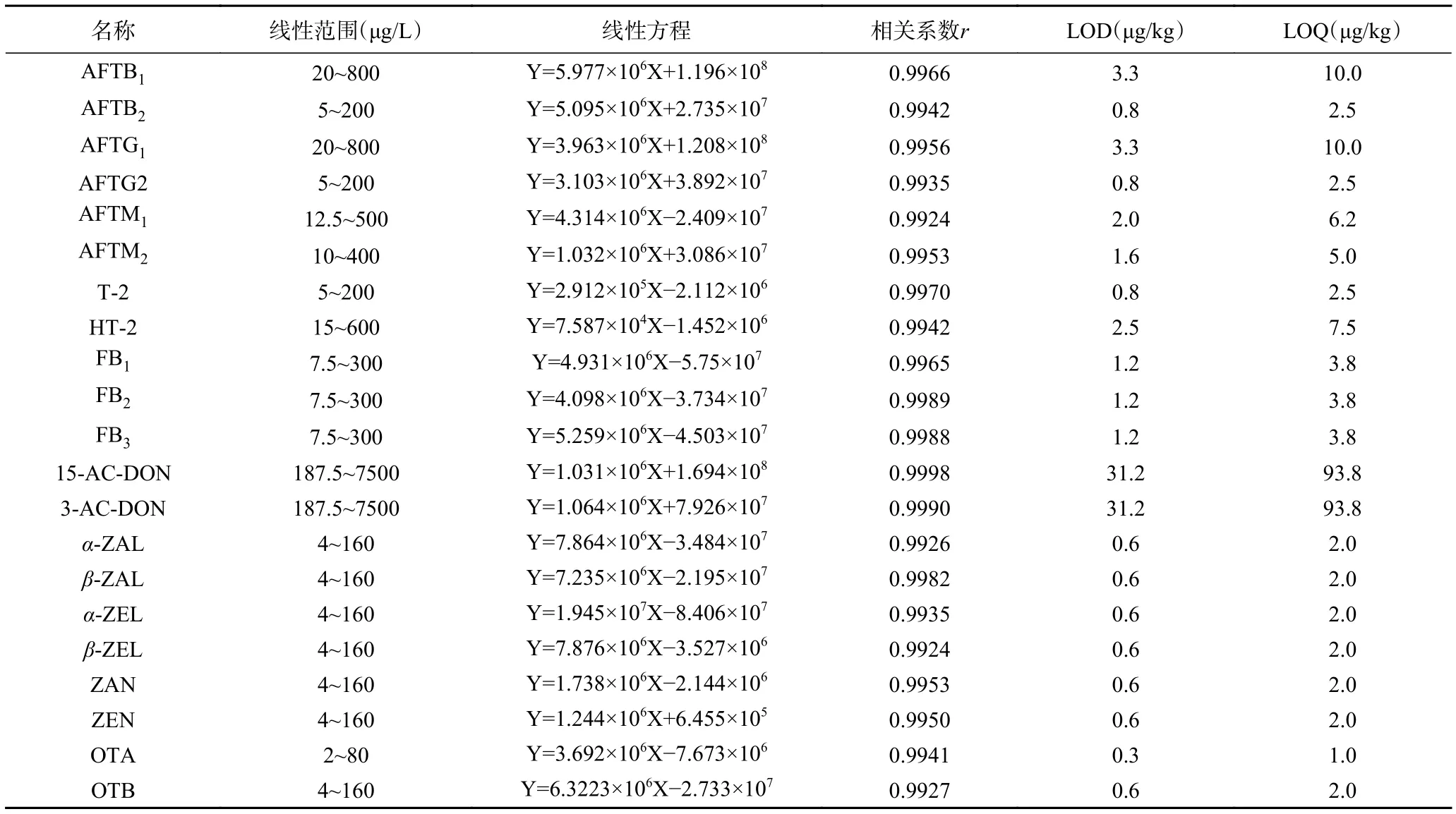
表4 21种真菌毒素的线性范围、检出限和定量限Table 4 Linear range, detection limit and quantification limit of 21 mycotoxins
2.6.2 回收率与精密度 取乳粉、液态乳及乳制品空白样品基质,分别添加低、中、高3个浓度水平的混合标准溶液,按“1.2.2”进行样品前处理,每个水平测定6次,计算回收率和相对标准偏差(RSD),21种真菌毒素的回收率为60.3%~107.0%,RSD<15%,结果见表5。符合GB/T 27404-2008《实验室质量控制规范食品理化检测》的技术要求[33],方法具有良好的准确度和精密度,适用于乳及乳制品中21种真菌毒素的日常监测。

表5 21种真菌毒素的加标回收率和相对标准偏差(n=6)Table 5 Standard addition recovery rates and relative standard deviations of 21 mycotoxins (n=6)
2.6.3 方法对比 目前乳及乳制品中真菌毒素的检测方法对比如表6所示,本研究前处理采用Captiva-EMR Lipid柱净化,四极杆/静电场轨道阱高分辨质谱测定,样品前处理能够高效去除蛋白质和脂质,减少样品处理时间,与表6所列方法对比,目标物种类覆盖更全面,首次对乳及乳制品中的呕吐毒素衍生物进行定量分析,该方法具有较高的适用性和推广性。

表6 乳及乳制品中多真菌毒素检测方法对比Table 6 Test results of multiple mycotoxins in milk and dairy products

续表 5
2.7 实际样品测定
应用建立的方法对从超市购买的36份乳及乳制品进行检测,包括乳粉样品18份,液态乳样品18份,其中一份水果添加液态酸奶样品检出黄曲霉毒素B2,含量为18.29 μg/kg,其余样品均未检出真菌毒素,阳性样品中黄曲霉毒素B2的提取离子流色谱图如图6,二级质谱图如图7所示。阳性样品表明该酸奶在原料采集以及生产加工过程中存在真菌毒素污染风险,可能是由乳制品中的添加原料引入,从而危害人体健康。为确保乳及乳制品的质量,除了其中乳类原料,关注其他成分的质量安全以及良好的生产规范都是十分必要的。
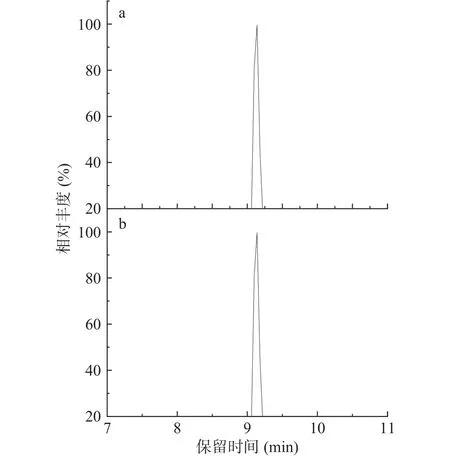
图6 标准溶液(a)、阳性样品(b)中黄曲霉毒素 B2的提取离子流色谱图Fig.6 Extracted ion chromatogram of aflatoxin B2 in(a) standard solution and (b) positive sample

图7 标准溶液(a)、阳性样品(b)中黄曲霉毒素B2二级质谱图Fig.7 MS2 spectra of aflatoxin B2 in (a) the standard solution and (b) the positive sample
3 结论
Q-Exactive高分辨质谱技术有较高分辨率和高质量精度,可实现目标物的准确定性,在检测复杂基质时能够在较高分辨率下测定化合物及其碎片离子的精确分子量,具有较强的抗干扰能力。本文基于高分辨质谱技术的优势,针对粉状和液态乳及乳制品中不同成分的含量特点,通过优化萃取溶液和筛选净化柱,建立了乳及乳制品中21种真菌毒素快速筛查方法。样品中的真菌毒素经酸化乙腈提取后,通过Captiva-EMR Lipid净化柱净化,超高效液相色谱-四极杆/静电场轨道阱高分辨质谱联用法进行测定。加标回收实验验证了方法准确度和精密度,且具有良好的回收率,能够快速、准确、高效的实现乳制品中21种真菌毒素的筛查,具有较高的实用性和推广性,为乳及乳制品中多真菌毒素的快速筛查分析提供可靠技术支持,为食品安全管理机构制定有效的风险管理政策提供科学依据,保障乳及乳制品质量安全。

