微生物细胞工厂合成五环三萜皂苷类化合物
任师超,孙秋艳,冯旭东,李春,2,3
(1 北京理工大学化学与化工学院化学工程系,生物化工研究所,医药分子科学与制剂工程工业和信息化部重点实验室,北京100081;2 清华大学化学工程系,工业生物催化教育部重点实验室,北京 100084;3 清华大学,合成与系统生物学研究中心,北京 100084)
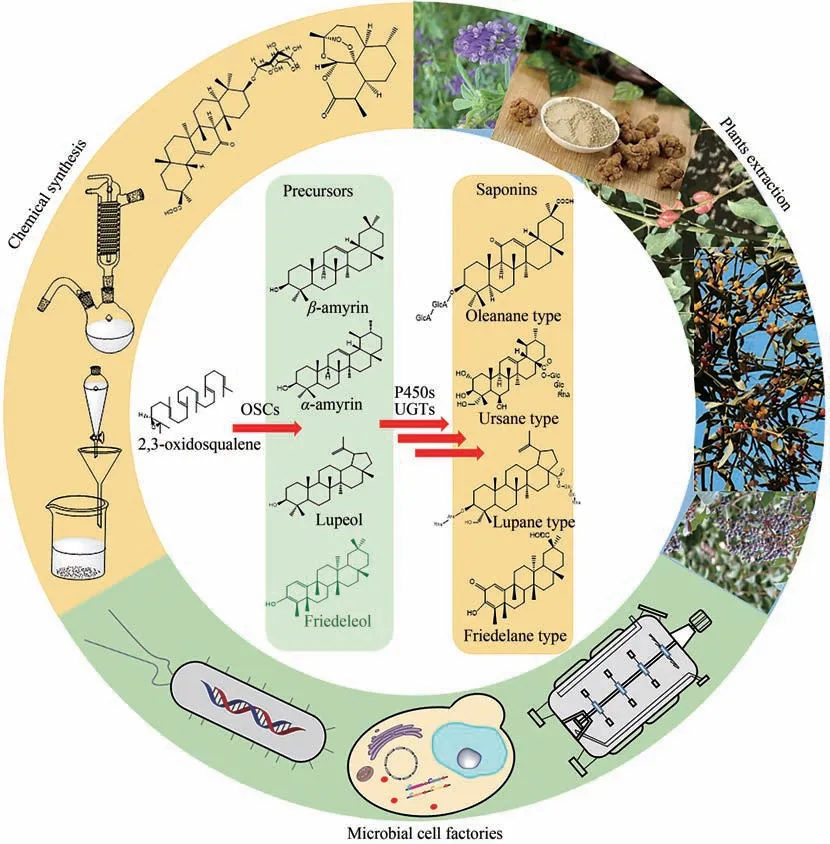
三萜类化合物是一类由六个异戊二烯单元构成的含有30 个碳原子的烃类含氧衍生物[1],其中五环三萜是指具有五环结构骨架的三萜类化合物。代表化合物包括甘草中的主要活性物质甘草酸(glycyrrhizic acid,GL)、白桦树皮中的桦木酸(betulinic acid,BA),以及存在于多种植物中的山楂酸(maslinic acid,MA)、熊果酸(ursolic acid,UA)、齐墩果酸(oleanolic acid,OA)等。三萜皂苷是由疏水性三萜苷元和一个或多个亲水性糖基组成的糖苷化合物[2],根据其皂苷元结构的不同,分为齐墩果烷型(oleanane type)、乌索烷型(ursane type)、羽扇烷型(lupane type)、木栓烷型(friedelane type)等。从天然合成途径来看,五环三萜皂苷类化合物,先是由氧化鲨烯经过氧化鲨烯环化酶(squalene oxide cyclase,OSC)催化形成不同的五环三萜化合物骨架(包括β-香树脂醇、α-香树脂醇、羽扇醇、日耳曼醇等),这些五环三萜化合物骨架经过P450 氧化酶及其还原酶在不同的位点进行多种形式的氧化,再经过糖基转移酶的修饰,最终可得到结构及功能各异的五环三萜皂苷类化合物。由于大多五环三萜骨架具有较强疏水性,不利于其在植物当中储存、运输,所以植物中五环三萜化合物多以皂苷的形式存在。多样化的糖基化修饰对五环三萜类化合物的理化性质具有较大的影响。例如,糖基化会提高化合物的水溶性,有利于五环三萜类化合物在植物当中的合成、储存、运输等,同时,糖基化可以调整化合物的脂水分配系数,进而提高生物利用度;另外,多种糖基化修饰配合体内不同的糖苷水解酶也使得五环三萜类化合物的生理、药理活性更加丰富。
五环三萜皂苷类化合物因其结构多样且具有多种药理、生理活性而被广泛应用于食品、化妆品、医药、保健品等领域。例如,甘草酸因其在保肝护肝方面的显著作用,用于多种肝病药物的研发;大豆皂苷具有抗肿瘤、降低胆固醇等保健作用,应用也很广泛[3-4]。一些三萜皂苷还是重要的天然甜味剂和乳化剂,具有重要的应用价值,如单葡萄糖醛酸基甘草次酸(glycyrrhetinic acid monoglucuronide,GAMG),其甜度是蔗糖的941 倍[5],在食品添加剂行业的应用前景广阔。目前五环三萜皂苷类化合物的主要获取方式为植物提取。该方法具有很多局限性,包括:①化合物在植物当中的含量非常低,而野生资源有限,盲目对野生资源进行采挖会造成生态环境的破坏,不符合可持续发展的战略要求;②所以对相应植物进行人工种植成为化合物提取来源的重要补充,而许多植物具有很强的道地性,且需要多年的生长,不适合人工种植,且人工种植会大量占用耕地,同时并不能保证化合物的含量达到相关要求;③植物提取过程中需要复杂的分离纯化工艺,要用到大量的酸碱试剂或者有机试剂以保证提取率和纯度,而随着我国环保政策的推行,这些工业废液的排放难以符合环境友好可持续发展的要求,成了目前工业生产的一大难题;④很多糖基化修饰丰富的化合物稳定性较差,提取过程中pH 的大范围改变、性质活泼的有机试剂的使用可能会造成糖基的破坏,很难提取到目标化合物。对于有些植物含量低的化合物还可能通过化学全合成或者半合成的方式来获取,但由于五环三萜皂苷类化合物的修饰类型较为复杂,包括羟基、羧基、羰基以及糖基化修饰等,很难从头合成,存在难度大、收率低、环境不友好等问题,目前只有半合成的报道,且都停留在实验室水平,不具备产业化的能力。相比于植物提取和化学合成,生物合成可以在一定程度上减少有机试剂、酸碱试剂的使用量,且发酵周期短,无需考虑季节、环境气候等因素,能够实现可持续性生产,更有利于推动绿色生物制造,达到国家环保要求,在推动社会经济发展的同时,对于我国的环境、资源保护都具有重要意义。而通过微生物异源合成天然产物具有周期短、环境友好、可持续发展等优势。近几年随着合成生物学的发展,天然产物的微生物合成取得了重大突破。2013 年,Keasling 课题组[6]利用工程化酿酒酵母成功合成了倍半萜化合物青蒿素的前体青蒿酸,并结合化学法实现了抗疟疾有效成分青蒿素的半合成。Smolke 课题组[7-8]于2019 年、2020 年分别报道了在酿酒酵母中从头合成生物碱类化合物托品碱和莨菪碱、东莨菪碱,此工作的亮点为在工程化酵母中整合了来源于酵母、细菌、植物、动物的26个基因,横跨6个亚细胞定位,最终成功从头合成了广泛应用于神经肌肉疾病治疗的生物碱类化合物,该工作具有里程碑式意义。五环三萜皂苷类化合物的微生物合成近几年也取得了重大的突破,本综述主要总结了重要五环三萜皂苷类化合物的结构特点及其在微生物中的合成进展,对部分合成途径未知的化合物,结合已报道的P450氧化酶、尿苷二磷酸(uridine diphosphate,UDP)-糖基转移酶,以及微生物底盘宿主的代谢通路,对其合成途径进行了推测。
1 齐墩果烷型五环三萜皂苷化合物
齐墩果烷型五环三萜皂苷化合物,从结构上来看,是以齐墩果烷(oleanane)[又称β-香树脂烷(βamyrane)]为结构基础,进行多种类型结构衍生之后的一类化合物。从天然代谢途径来看,大多数齐墩果烷型五环三萜皂苷化合物,是通过2,3-氧化鲨烯经氧化鲨烯环化酶催化生成β-香树脂醇后,再进行后续修饰而生成,其中具有代表性的化合物有齐墩果酸、山楂酸、甘草次酸及其糖苷类衍生物等。
1.1 齐墩果酸类五环三萜皂苷化合物
以β-香树脂醇为底物,经过CYP716A 家族P450酶的氧化,可在其28位C原子上进行连续氧化修饰,依次生成高根二醇、齐墩果醛、齐墩果酸等化合物[9]。以齐墩果酸为基础继续催化,可得到山楂酸、栎焦油酸(queretaroic acid)、金盏花苷E(calenduloside E)、常春藤皂苷元(hederagenin)等多种齐墩果烷型三萜化合物(图1)。其中,山楂酸具有抗癌、抗氧化、抗艾滋病、抗菌、抗糖尿病等多种生物活性,其存在于山楂、红枣、枇杷叶和油橄榄等多种植物中;栎焦油酸存在于三台红花等植物中,具有一定的抗癌活性;常春藤皂苷元主要提取于五加科常春藤属植物中华常春藤,主要具有抗癌和抗抑郁功效,而在常春藤皂苷元基础上可进行多种糖基化修饰,生成生理活性丰富多样的多种常春藤皂苷;金盏花苷E具有抗心律失常、降血压、降血糖等功效,对治疗糖尿病和病态肥胖有潜在的作用。近年来,利用微生物细胞工厂从头合成齐墩果酸及其糖苷衍生物取得了较大进展。2013 年,张学礼课题组[10]通过在酿酒酵母中过表达甲羟戊酸(mevalonic acid,MVA)途径中的鲨烯氧化酶ERG1、角鲨烯合成酶ERG9、甲羟戊酸激酶ERG8,抑制竞争途径的羊毛甾醇合酶ERG7,同时整合来源于苜蓿的P450酶,来自拟南芥的P450酶还原伴侣(cytochrome P450 reductase,CPR),以及来自于光果甘草的β-香树脂醇合酶,发酵7 天最终得到的齐墩果酸产量达到71.0 mg/L。2018 年,卢文玉课题组[11]在酿酒酵母中过表达限速酶羟甲基戊二酸单酰辅酶A tHMG1、法尼基焦磷酸合酶ERG20、外源的白念珠菌的鲨烯环氧酶ERG1,以增强前体鲨烯的供应,整合来自长春花的香树脂醇合酶,并进行不同强度启动子的筛选优化,将来自于苜蓿和长春花的P450 酶与来自拟南芥和百脉根的CPR 进行组合搭配筛选,确定苜蓿的P450 酶和拟南芥的CPR 为最优搭配,分批补料发酵所得齐墩果酸的产量为155.58 mg/L,此外该课题组[12]还利用解脂耶氏酵母为宿主,结合P450酶与CPR融合表达的策略,将齐墩果酸的产量提高到540.7 mg/L。2018年,李春课题组[9]在酿酒酵母中过表达MVA 途径限速酶tHMG1、鲨烯氧化酶ERG1、角鲨烯合成酶ERG9等,偶联半乳糖代谢调控网络,使齐墩果酸的产量达到186.1 mg/L,经过发酵调控优化,产量达到了606.9 mg/L,是目前已报道的最高水平。

图1 齐墩果酸类五环三萜皂苷化合物(绿色标注为推测途径)Glc-葡萄糖基;GlcA-葡萄糖醛酸基;Csl-类纤维素合酶Fig.1 Pentacyclic triterpenoid saponins with oleanolic acid(the predicted pathways are highlighted in green)Glc-glucosyl;GlcA-glucuronyl;Csl-cellulose synthase-like enzyme
在齐墩果酸的基础上,可继续经过多种P450酶的修饰生成多种五环三萜类化合物,其中包括但不限于:
(1)通过CYP716C 家族的P450 酶在其2 号位上进行氧化,实现羟基化修饰,可以得到山楂酸。2018 年,张学礼课题组[13]在山楂中挖掘到一个新的P450 酶CYP716C49,在齐墩果酸的酿酒酵母生产菌株中异源表达该酶,实现了从头合成山楂酸,最终产量为384 mg/L。
(2)通过CYP72A68 及CYP93E 家族的P450酶可分别对齐墩果酸的23 号位和24 号位进行羧基化和羟基化修饰,生成丝石竹酸及4-epi-常春藤皂苷元。2018 年,张学礼课题组[14]在蔷薇科植物苹果中挖掘到P450 酶MdMA02,在齐墩果酸的酿酒酵母生产菌株中对其进行异源表达,实现了常春藤皂苷元的从头合成,产量达到了101 mg/L。
(3)通过CYP72A63对齐墩果酸的30号位进行羟基化修饰,得到化合物栎焦油酸。早在2006年,日本的莫西亚(Mercian)公司的生物资源实验室就利用来源于直肠小四孢菌的P450 酶P450moxA及其还原酶,通过体外无细胞催化系统,催化齐墩果酸得到了栎焦油酸,转化率为17%[15]。
关于齐墩果酸的糖基化修饰方面,通过欧洲山芥的糖基转移酶UGT73C11 可对其3 号位的羟基以及28 号位的羧基进行葡萄糖基化修饰,可以分别生成3-O-葡萄糖-齐墩果酸和28-O-葡萄糖-齐墩果酸,该类化合物具有抗虫抗菌的生理活性[16]。2018 年,杨生超课题组[17]利用姜状三七转录组数据,成功鉴定催化齐墩果酸C-3位羟基的葡萄糖醛酸基转移酶OAGT,利用大肠杆菌对其进行重组表达,可以催化齐墩果酸得到金盏花苷E。
1.2 甘草次酸类五环三萜皂苷化合物
甘草次酸(glycyrrhetinic acid,GA)是甘草酸的苷元化合物,具有突出的抗肝炎病毒B及保肝护肝等活性,是目前市场上肝病治疗药物的主要功能成分。甘草酸是甘草中最主要的活性成分,对肉瘤、癌细胞生长有抑制作用,具有抗炎、抗肿瘤、抗病毒、提高免疫力等药理活性,与此同时,其甜度是蔗糖的170 倍且具有特殊的回甘口感,也是重要的食品添加剂和香料基料。近年来,在医药、化工、食品、日用化工等行业也得到了广泛的应用。单葡萄糖醛酸基甘草次酸由于少一个葡萄糖醛酸基,使其极性适中,在保留其生理、药理活性的同时增加了生物利用度,在医药、食品等领域具有更大的竞争优势,且其甜度达到了蔗糖的941倍,具有巨大的开发应用前景[18]。
以β-香树脂醇为结构基础,通过P450 酶CYP88D6 及其还原酶的催化,可对β-香树脂醇的11位进行氧化修饰,生成化合物11-O-β-香树脂醇,具有抗增殖和抗炎活性,可作为合成多种三萜类化合物 的 骨架。 再由P450 酶CYP72A63 或CYP72A154 及还原酶催化,可对其30 位的甲基继续进行多步氧化修饰,最终生成甘草次酸(图2)。近年,日本研究人员通过对乌拉尔甘草转录组数据库进行挖掘,结合EST 序列与RNA-Seq 技术解析了甘草次酸的生物合成途径,并在酿酒酵母体内实现了甘草次酸的从头合成,但是其生产水平停留在概念验证阶段,产量仅为20 μg/L,并伴随有多种副产物的生成[19]。2018 年,李春课题组[20]从苜蓿和甘草中成功获得特异性更强、活性更高的P450 酶(Uni25647)及其还原酶,并优化了甘草次酸的合成途径,在5 L 发酵罐中的产量达到18.9 mg/L。在此基础上,该课题组[21]对P450 酶进行理性设计,对关键位点氨基酸进行突变,最终实现甘草次酸及其中间体化合物甘草次醇、甘草次醛的选择性合成,甘草次酸及甘草次醛的产量分别达到了36.4 mg/L 和31.4 mg/L,并成功合成了稀有萜类化合物29-羟基-11-O-β-香树脂醇,产量为10.2 mg/L,均是目前已报道的最高水平。
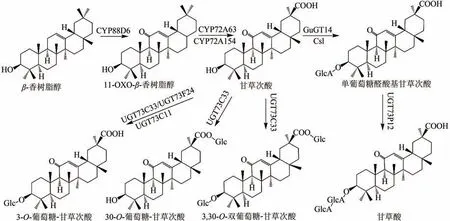
图2 甘草次酸类五环三萜皂苷类化合物Glc-葡萄糖基;GlcA-葡萄糖醛酸基Fig.2 Pentacyclic triterpenoid saponins with glycyrrhetinic acidGlc-glucosyl;GlcA-glucuronyl
以甘草次酸为底物,通过一系列的糖基转移酶可对其3 位羟基或/及30 位羧基进行葡萄糖基化修饰,生成3-O-葡萄糖-甘草次酸、30-O-葡萄糖-甘草次酸及双葡萄糖基化修饰的甘草次酸。2017年,李春课题组[22]通过大肠杆菌异源表达糖基转移酶UGT73C11,并在体外对甘草次酸进行催化,成功得到3-O-葡萄糖-甘草次酸,转化率达到98%。在此基础上,该课题组[23]从甘草数据库中鉴定到两个新的糖基转移酶UGT73C33 和UGT73F24,成功在体外合成多种甘草次酸糖苷衍生物,包括3-O-葡萄糖-甘草次酸、30-O-葡萄糖-甘草次酸、3,30-O-双葡萄糖-甘草次酸,并在工程化酿酒酵母中首次合成了3-O-葡萄糖-甘草次酸,产量达到26.31 mg/L。甘草次酸经过糖基转移酶GuGT14 及UGT73P12 的催化,可先后生成化合物单葡萄糖醛酸基甘草次酸(GAMG)以及甘草酸(GL)。2019 年,叶敏课题组[24]从甘草中鉴定到糖基转移酶GuGT14,并对其进行体外验证,成功得到了化合物GAMG。同年,Muranaka 课题组[25]从甘草中鉴定到糖基转移酶UGT73P12,该酶可催化GAMG 生成GL,并推测其可能是甘草中甘草酸天然合成途径中的糖基转移酶。2020 年,有研究者从紫花苜蓿、乌拉尔甘草、百脉根、大豆等植物中发现了一种类纤维素合酶(cellulose synthase-like enzymes,Csls)具有葡萄糖醛酸基转移酶活性,并利用瞬时转染的烟草和工程化酿酒酵母合成了3-O-葡萄糖醛酸-苜蓿酸、GAMG 和金盏花苷E 等化合物[26-27],并在此基础上利用酿酒酵母从头合成GL,产量达到了791 μg/L[27]。
1.3 大豆皂苷类五环三萜皂苷化合物
大豆皂苷(soybean saponins)也是一类重要的五环三萜皂苷类化合物,主要存在于豆科植物当中。近年来,国内外大量研究表明:大豆皂苷不仅毒副作用很小,而且还具有许多对人体健康有益的生理功能,例如在保健作用方面,具有增强免疫调节功能、保护记忆力、作为免疫原性物质、预防骨质疏松、改善肥胖、改善胆固醇和脂肪代谢、改善心肌供氧、提高机体的耐缺氧功能、加强中枢交感神经的活动、抗衰老、防止动脉粥样硬化、调节心脑血管系统等作用;在药理活性方面,具有抗肿瘤、抗氧化、抗炎、抗病毒、抗石棉尘毒性、抗自由基、抗凝血、抗血栓、抗糖尿病等功能[28-33]。
依据皂苷元可将大豆皂苷分为大豆皂苷A 类、B 类、E 类、DDMP(2,3-二氢-2,5-二羟基-6-甲基-4H-吡喃-4-酮)等四类(图3)。以β-香树脂醇为底物,对其22 位进行羟基化修饰,可生成槐花二醇,此为大豆皂苷的合成前体化合物,且具备一定生理及药理活性。2010 年有研究报道了齐墩果烯三萜化合物的22 位羟化酶,也是目前报道的唯一具有该功能的酶[34]。而通过另外一个途径,以β-香树脂醇为底物,经过CYP93E 家族的P450酶催化,可对β-香树脂醇的24位进行羟基化修饰,生成化合物24-羟基-β-香树脂醇,在此基础上通过P450 酶CYP72A61 的催化,可继续在其C-22 上进行羟基化修饰,生成大豆皂醇B,后经糖基转移酶催化可在C-3羟基上加糖,形成大豆皂苷B 类化合物[35]。2010年,Ebizuka课题组[36]将从大豆转录组克隆得到的糖基转移酶UGT74M1与UGT71G1基因在大肠杆菌中重组表达,与大豆皂苷B单葡萄糖醛酸反应,得到大豆皂苷Ⅲ与Ⅰ。大豆皂醇B可在糖基转移酶Sg-9(UGT73B4)的催化下在C-22上连接一个DDMP基团,C-3羟基经葡萄糖醛酸基修饰,形成大豆皂苷DDMP类[37]。P450酶Sg-5(CYP72A69)可将大豆皂醇B的C-21氧化形成羟基,生成大豆皂醇A,经糖基转移酶催化可在C-3羟基、C-22加不同的糖基,生成大豆皂苷A类化合物[38]。DDMP类皂苷不稳定,容易脱去DDMP基团在C-22位形成羰基,生成大豆皂苷E类化合物[35,38-39]。

图3 大豆皂苷类五环三萜皂苷化合物(绿色标注为推测途径)GlcA-葡萄糖醛酸基;Rx-糖基化修饰;Csl-类纤维素合酶Fig.3 Pentacyclic triterpenoid saponins with soybean saponin(the Predicted pathways are highlighted in green)GlcA-glucuronyl;Rx-glycosylation;Csl-Cellulose synthase-like enzyme
大豆皂苷糖基化的主要基因是Sg-1,Chigen Tsukamoto课题组[40]对中国8株野生大豆进行测序分析,发现不同Sg-1 突变体可对C-22 羟基添加不同的糖基,如Sg-1b(UGT73F2)可在大豆皂苷A类化合物的C-22位乙酰葡萄糖上加葡萄糖生成A0-αg 皂苷,Sg-1a(UGT73F4)可在C-22 位乙酰葡萄糖上加木糖生成Ab类皂苷。Sg-10-b可阻止C-22结合阿拉伯糖,生成大豆皂苷A0 类[40-43]。Sg-4(UGT73P10)可在大豆皂苷B类的C-3位糖基上加一个阿拉伯糖,生成大豆皂苷Bc′,Sg-4(UGT73P10)同源酶GMSG 2(UGT73P2)可催化大豆皂苷B类的C-3 羟基结合一个半乳糖,生成大豆皂苷Bb′[44]。UGT73P2 和UGT73P10 可催化大豆皂苷C-3 位糖基上分别修饰半乳糖和阿拉伯糖,生成大豆皂苷B类和DDMP类[42]。UGT73P2和UGT73P10与UGT73F2来 源 于 同 一 祖 先[43]。 Sg-3 (UGT91H9) 和UGT91H4 可分别在大豆皂苷C-3 位的糖链上添加第3个葡萄糖和鼠李糖生成大豆皂苷Ab等[42,44]。
1.4 多位点修饰的齐墩果烷型五环三萜皂苷类化合物
1.4.1 柴胡皂苷类
柴胡皂苷(saikosaponin)是一类广泛存在于柴胡根中的五环三萜皂苷类化合物,在治疗感冒、癌症等方面有重要作用。目前柴胡皂苷的生物合成途径尚不清晰,有研究者推测柴胡皂苷以β-香树脂醇为前体,经过细胞色素P450 酶与糖基转移酶修饰形成柴胡皂苷类化合物[45-46]。
以3,16-二羟基-齐墩果烷为结构基础,使其C-11 与C-12 之间呈双键,C-13 与C-28 之间呈环氧键,就形成了柴胡皂苷的基本结构单元柴胡皂苷元E,继续对其C-23 位进行羟基化修饰,可得到柴胡皂苷元G、F。对各个柴胡皂苷元C-3 位的羟基进行岩藻糖、葡萄糖、鼠李糖等糖基化修饰,可得到柴胡皂苷a、柴胡皂苷d、柴胡皂苷c等多种柴胡皂苷。在C-3、C-16、C-23、C-28 位点多羟基修饰的齐墩果烷基础上,其母核上C-9 与C-11 之间、C-11与C-12之间、C-12与C-13之间、C-13与C-18 之间,形成一个或两个双键,结合C-13 位与C-28位的环氧键,再对其C-3位的羟基进行糖基化修饰,可形成柴胡皂苷元A、B、C、D,柴胡皂苷b1、b2、b3、b4,柴胡皂苷f等多种柴胡皂苷。
1.4.2 商陆酸类五环三萜皂苷化合物
商陆酸(esculentic acid)类化合物是一类广泛存在于商陆根中的五环三萜类化合物,在治疗各种炎症中具有重要作用,目前主要从商陆根中提取[47-48]。商陆酸是在齐墩果酸的结构基础上,对C-23、C-16 分别进行羟基化修饰,对C-30 位进行羧基化修饰而成的五环三萜化合物。对商陆酸的C-2、C-3 羟基、C-30 羧基分别选择性羟基化、糖基化、甲基化修饰,可得到多种商陆皂苷元及商陆皂苷类化合物。
远志皂苷是远志的主要活性成分,其功效主要是有益智力、安定神志、缩短酒精体内代谢时间、化痰止咳、延缓衰老及抑菌等[49]。近年来,有学者对远志皂苷类化合物的天然合成途径进行了研究,推测了其理论合成路线,为远志皂苷类五环三萜化合物的微生物合成奠定了基础[50]。以2,27-二羟基-3-O-葡萄糖-商陆酸为基础,对其C-23 进行羧基化衍生之后,继续对其C-28 进行多种类型的糖基化修饰,结合母核上的多种羟基、双键等修饰,可形成结构各异的远志皂苷,包括远志皂苷A、B、C、D、E、F。由于修饰较为复杂且氧化程度较高,多数远志皂苷的稳定性较差,经常以远志皂苷元的形式存在。
目前利用微生物细胞工厂合成齐墩果烷型五环三萜皂苷化合物的报道大多集中于苷元的合成,如齐墩果酸、甘草次酸、山楂酸等。虽然催化相关母核的C-2、C-23、C-24、C-28、C-30 等位点形成相应苷元的P450 酶已经报道,但大多存在活性低、特异性差等问题,导致副产物多、产量低,在相关糖苷化合物生物合成方面的报道相对较少,且产量普遍较低,目前只有齐墩果酸、甘草次酸等少数几个化合物糖苷衍生物的生物合成报道。柴胡皂苷、商陆皂苷、远志皂苷等化合物的结构更为复杂、多样,而催化C-16、C-27 等位点的P450 酶尚未报道,且部分反应过程未知,导致异源合成困难。在糖基转移酶方面,除了异源表达糖基转移酶活性低、特异性差的问题外,还涉及糖基供体选择性问题,底盘宿主一般很难提供充足且多样化的糖基供体,需要对底盘宿主进行优化改造,且在合成途径当中很多P450酶未解析,这也为途径当中糖基转移酶的鉴定增加了难度。
2 乌索烷型五环三萜皂苷化合物
乌索烷型又称α-香树脂烷型,在天然代谢途径中,2,3-氧化鲨烯经氧化鲨烯环化酶催化生成α-香树脂醇(α-amyrin),以α-香树脂醇为基础进行后续修饰形成的一类五环三萜化合物,代表化合物有熊果酸、地榆皂苷等(图4)。
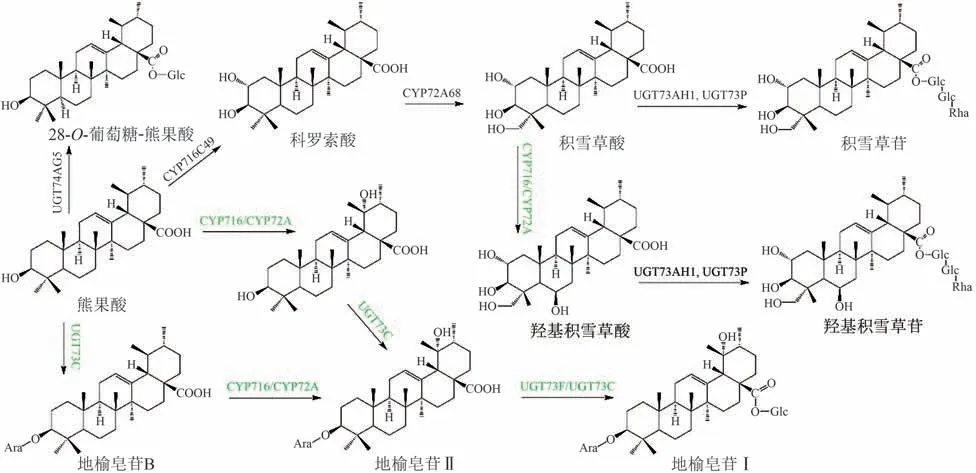
图4 熊果酸类五环三萜皂苷化合物(绿色标注为推测途径)Glc-葡萄糖基;Ara-阿拉伯糖基;Rha-鼠李糖基Fig.4 Pentacyclic triterpenoid saponins with ursolic acid (the predicted pathways were marked in green)Glc-glucosyl;Ara-arabinosyl;Rha-rhamnosyl
2.1 熊果酸类五环三萜皂苷化合物
熊果酸广泛存在于多种植物当中,包括木犀科植物女贞、蔷薇科植物枇杷、唇形科植物夏枯草等。熊果酸具有镇静、保肝抗炎、抗菌、抗肿瘤、抗溃疡、抗病毒、抗氧化、抗动脉粥样硬化、降低血糖等多种功能,被广泛地用作医药和化妆品原料。
α-齐香树脂醇在CYP716A 家族的P450 酶及其还原酶催化下,可氧化其C-28生成熊果酸,再经过CYP716C49对其C-2进行羟基化修饰,可生成科罗索酸(corosolic acid)。2019 年,张学礼课题组[13]从植物山楂中鉴定到P450 酶CYP716C49,利用工程化酿酒酵母对其异源表达,合成了熊果酸和科罗索酸,科罗索酸的产量达到了141 mg/L。许辉课题组[51]将具有催化28-O-葡萄糖基化功能的糖基转移酶UGT74AG5,连同来自冬青的α-香树脂醇合酶在酿酒酵母中共表达,产生了一种罕见的熊果酸28-O-β-D-吡喃葡萄糖苷。
2.2 地榆皂苷
地榆为我国常用中药,始载于《神农本草经》,列为中品,具有凉血止血、解毒敛疮之功效,在临床上经常应用于止血、烧烫伤、直肠炎、结肠炎、肾炎的治疗[52]。地榆皂苷类化合物是地榆中的主要活性物质,具有抗肿瘤以及美容护肤的作用,其中地榆皂苷Ⅰ不仅可以有效防止胶原纤维降解,也可以有效促进Ⅰ型胶原蛋白的产生,可用于美容护肤产品的开发[53-54]。对熊果酸C-3 位羟基进行阿拉伯糖修饰(UGT73C家族)可得到地榆皂苷B,继续对地榆皂苷B的C-19位进行α-羟基化衍生可生成地榆皂苷Ⅱ(ziyuglycoside Ⅱ),继续催化地榆皂苷Ⅱ的C-28 位羧基加上葡萄糖得到地榆皂苷Ⅰ(ziyuglycoside Ⅰ)。
2.3 积雪草酸
《神农本草经》同样记载了积雪草的相关信息。积雪草为我国常用中药,在印度等一些亚洲国家和地区也应用广泛,在临床上可用于跌打损伤、传染性肝炎、流行性脑炎等疾病的治疗。积雪草苷(asiaticoside)等五环三萜皂苷化合物是积雪草中的主要活性物质,可用于皮肤病、部分肾功能疾病的治疗。积雪草的有效成分提取物可以有效抑制癌细胞的增殖、抗抑郁、加速伤口愈合,而且具有改善肝、肾功能的作用。南非、印度、东南亚等许多国家和地区也将其作为传统药物加以应用[55]。
理论上CYP72A68 对科罗索酸23 号位进行羟基化衍生可生成积雪草酸。通过多种糖基转移酶在积雪草酸的C-28 羧基上进行一系列的糖基化修饰,加上葡萄糖-葡萄糖-鼠李糖,可得到积雪草苷。对积雪草酸和积雪草苷的C-6 进行羟基化衍生,可分别得到羟基积雪草酸和羟基积雪草苷[55]。2017 年,Kim 等[56]发掘UGT73AH1 可以在积雪草酸C-28 的羧基上添加一个葡萄糖,形成单葡萄糖-积雪草酸,再由其他糖基转移酶在C-28 位的葡萄糖上添加葡萄糖-鼠李糖,形成积雪草苷。积雪草酸的生物利用度低,作为几种疾病的潜在治疗剂,需要对积雪草酸的结构进行修饰。研究表明,多种内生真菌以积雪草酸作为底物生成生物活性更高的积雪草酸衍生物[57-59]。例如,内生真菌深黄伞形霉可将积雪草酸转化生成2α,3β,7β,23-四羟基-12-烯-28-酸和2α,3β,7β,23-四羟基-11-烯-28,13-内酯[58]。高兆辉等[59]利用小孢拟盘多毛孢可将积雪草酸转化生成多种不同的衍生物。
与地榆皂苷、积雪草苷等化合物C-6、C-19 位氧化相关的P450 酶尚未解析,且多种糖基的修饰过程也尚未完全清晰,导致利用微生物细胞工厂合成乌索烷型五环三萜皂苷具有一定难度,除了熊果酸28-O-β-D-吡喃葡萄糖苷的生物合成之外,关于乌索烷型三萜皂苷生物合成的报道相对较少。由于乌索烷型与齐墩果烷型三萜皂苷结构类似,合成途径的部分酶可以通用,在多种化合物的天然合成途径方面可以相互参考,所以利用微生物细胞工厂合成乌索烷型五环三萜皂苷化合物具有很大发展潜力。
3 羽扇烷型五环三萜皂苷化合物
羽扇烷型五环三萜化合物是由羽扇豆醇合酶(lupeol synthase,LUS)催化2,3-氧化鲨烯合成羽扇醇,以羽扇醇为结构基础进行后续修饰形成的一类五环三萜化合物。代表化合物有桦木酸、麦珠子酸等(图5)。

图5 桦木酸类五环三萜皂苷化合物(绿色标注为推测途径)Glc-葡萄糖基;Ara-阿拉伯糖基;Rha-鼠李糖基Fig.5 Pentacyclic triterpenoid saponins with betulinic acid(the predicted pathways are highlighted in green)Glc-glucosyl;Ara-arabinosyl;Rha-rhamnosyl
3.1 桦木酸类五环三萜皂苷化合物
桦木酸具有抗肿瘤、抗艾滋病毒、抗炎和体外抗疟等多种生物活性,尤其对于恶性皮肤黑色素瘤有很好的效果,而且毒性很小,是最有前途的抗癌药物前体[60]。桦木酸天然存在于植物白桦树的树皮当中,在很大程度上限制了桦木酸的植物提取,因此,利用微生物细胞工厂对桦木酸进行生物合成具有巨大的应用前景。
CYP716A 家族的P450 酶同样可以催化羽扇醇的C-28位生成桦木酸,再经CYP716C49催化其C-2位加羟基生成麦珠子酸。目前已成功利用酿酒酵母微生物细胞工厂从头合成了桦木酸和麦珠子酸(alphitolic acid),麦珠子酸的产量达到23 mg/L[13]。李静、张彦生[61]通过调节酿酒酵母中桦木酸和脂肪酸途径关键基因的表达,表达拟南芥羽扇豆醇合酶LUS1、长春花P450 单加氧酶CrAO,使桦木酸产量达到1.92 mg/L(以OD 计)。卢文玉课题组[62]在解脂酵母中共表达来自拟南芥的羽扇豆醇合酶(AtLUP1)、P450 酶(CYP716A12)及其还原酶(AtCPR1),合成桦木酸的产量为0.32 mg/L,在P450 酶与其截短的还原酶融合表达、上游甲羟戊酸(MVA)径的关键基因过表达后,产量增加到9.41 mg/L,最后通过甘油发酵,使桦木酸的产量达到16.98 mg/L。曹英秀等[63]将来自蓖麻的羽扇醇合酶(RcLUS),来自白桦的P450酶(CYP716A180)来自日本莲花的还原酶(LiCPR)整合到解脂酵母中,合成桦木酸的产量达到25.62 mg/L,再通过将LiCPR 更换为来源于苜蓿的还原酶(MtCPR),桦木酸的产量达到32.33 mg/L。
3.2 白头翁皂苷
白头翁是一味用于治疗热毒血痢、温疟寒热、鼻衄、血痔的中药。白头翁皂苷(pulchinenoside)是白头翁中的主要成分,具有抗肿瘤、抗炎、抗氧化、抗病毒、抗血吸虫、增强免疫等多种药理活性[64-67]。
对桦木酸的C-23 位进行羟基化衍生可得到化合物23-羟基桦木酸,以其为结构基础,在C-3 位的羟基依次进行阿拉伯糖基和鼠李糖基化修饰可得到化合物白头翁皂苷A,继续在其C-28 位的羧基上进行葡萄糖-葡萄糖-鼠李糖的糖基链修饰,可得到白头翁皂苷C[67]。
目前利用微生物细胞工厂合成羽扇烷型五环三萜化合物的报道很少,基于齐墩果烷型和乌索烷型五环三萜皂苷化合物合成途径的分析和推测,为利用微生物合成羽扇烷型五环皂苷类化合物提供了参考和理论依据。
4 木栓烷型五环三萜化合物
木栓烷型五环三萜是木栓烷经过多种修饰、结构衍生形成的一类五环三萜化合物,其中包括雷公藤酮(tripterygone)等,其合成途径尚不完全清晰。雷公藤酮主要存在于雷公藤中,在治疗癌症方面具有广阔前景,目前主要通过化学合成法合成[68-70]。木栓烷是经过齐墩果烷C-4、C-10、C-14的甲基位移到C-5、C-9、C-13 上演变而来的。雷公藤酮是木栓烷C-3与C-4、C-1与C-10均呈双键,C-2 呈酮,C-3 位羟基化、C-30 位经羧基化修饰后所形成。推测该类化合物可能是由2,3-氧化鲨烯经一种未知的氧化鲨烯环化酶,催化生成了木栓二烯醇,并在此基础上再进行C-2位、C-30位的氧化等多种修饰的一类化合物(图6)。

图6 木栓烷类五环三萜化合物(绿色标注为推测途径)Fig.6 Pentacyclic triterpenoid saponins with friedelanes(The predicted pathways are highlighted in green)
5 结论与展望
长久以来,对于具有丰富生理、药理活性的五环三萜皂苷类化合物的研究从未间断,从活性物质的提取到单一化合物的分离、纯化,越来越多的五环三萜皂苷类化合物被分离鉴定出来,而随着研究的深入,这些化合物的应用价值逐渐被开发,市场需求量也在不断加大。为了满足市场需要,工业上大量获取相关化合物最直接的方法就是植物提取,根据化合物的不同性质、相应植物的不同特性,在工业发展过程中逐渐形成了特定的生产工艺。利用微生物细胞工厂高效合成五环三萜皂苷类天然产物,可以在一定程度上精简工艺步骤。近年来,利用微生物合成五环三萜皂苷类化合物的研究取得了很大进展,已经实现了部分化合物的从头合成,例如GAMG、GL、3-O-葡萄糖-甘草次酸、熊果酸28-O-β-D-吡喃葡萄糖苷等(表1),但策略大多集中在转录组、基因组数据分析且产量普遍较低。对于现阶段应用广泛的五环三萜皂苷类化合物,实现其微生物合成的工业化是一项巨大挑战,主要有以下几方面的困难和挑战:①实验室菌株通常具有遗传不稳定性,且实际生产过程中的培养条件限制势必也会带来新的挑战,从实验室菌株到稳定的工业生产菌株,需要大量的尝试和验证;②需要有较高的产量,其生产成本才能和现有的植物提取法相当;③需要对现有的生产工艺进行较大改进,在生产成本有优势的情况下,还需要考虑新工艺开发以及盈利周期,同时需要一定的科技人才储备及科研和实际生产相结合,对于一般中小企业难以实现;④基于现有的生产工艺,衍生出了多种产品,在现有产品工艺基础上,需要考虑利用微生物生产单一的化合物是否满足整体经济性,且现有产品已经形成了较为成熟的产业链,生产单一的化合物,在一定程度上会影响现有产业链。解决上述问题的核心基础则是微生物细胞工厂的实际产量,只有产量达到产业化要求才有可能实现工业化生产。
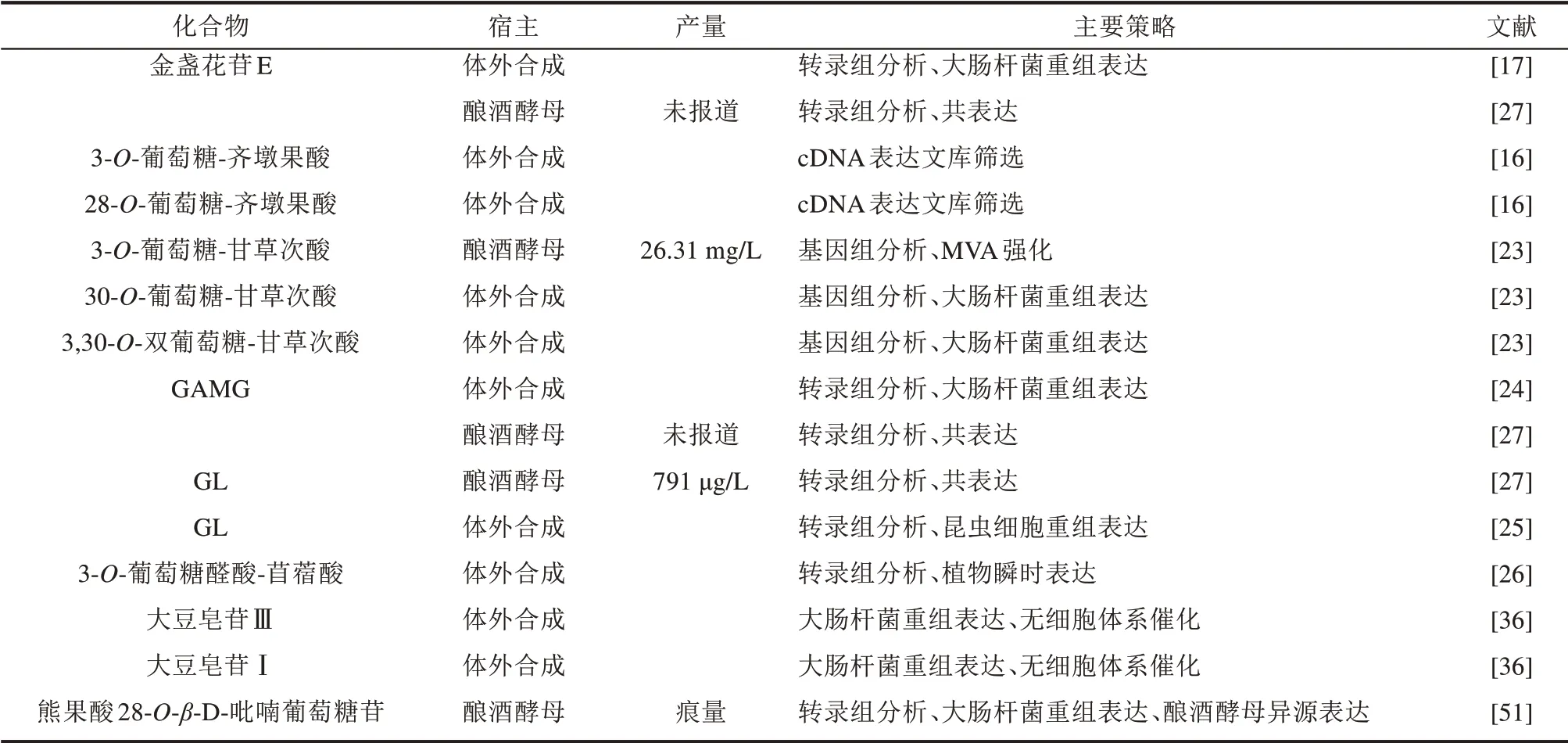
表1 五环三萜皂苷类化合物的微生物合成
五环三萜皂苷类化合物的微生物合成主要瓶颈在于:①合成途径未解析,部分P450 氧化酶、糖基转移酶未知,对未知途径关键酶的挖掘是建立微生物细胞工厂首要解决的问题,部分关键酶在微生物中异源表达能力差、活力低,且天然合成途径当中有许多功能类似的同工酶,如何筛选到特异性强、催化活性高的关键酶也是现阶段的关键问题;②微生物细胞内UDP 糖基供体的种类较单一、供应量不足也限制了五环三萜皂苷类化合物的产量;③大部分五环三萜皂苷类化合物对微生物宿主具有一定的毒性,要实现微生物生长和产物生产的平衡具有一定难度。
针对上述问题,可以考虑从以下几个方面进行解决:①对相应植物进行转录组、基因组、代谢组等组学分析,结合生物信息学分析,挖掘新的关键酶。对挖掘到的关键酶进行体外酶活验证,对不同性质的蛋白建立高效的体外可溶表达体系(包括通过不同的标签、不同表达宿主增加目标蛋白的可溶性表达,通过微粒体对膜蛋白进行功能验证等),结合晶体学、分子动力学模拟等手段,对关键酶的催化机理、关键催化位点进行研究;②通过①中的手段,挖掘不同植物、微生物中的脱氢酶、脱羧酶、差向异构酶等,结合不同微生物的代谢特点,选用适合的微生物作为底盘宿主对上述酶进行异源表达,实现多种类型糖基供体的供应,同时采用诱导表达、混菌培养等手段实现五环三萜化合物的时序性糖基化;③结合现有的五环三萜皂苷类化合物的药理活性数据,通过分子对接、分子动力学模拟等手段,进行对宿主的理性改造。通过适应性驯化、常温常压等离子体(atmospheric and room temperature plasma,ARTP)诱变等技术,对宿主进行非理性改造,再结合高通量筛选平台,筛选对目标化合物具有高耐受性的菌株作为底盘宿主进行目标化合物的生产。解决以上问题则有望大幅度提高微生物合成五环三萜皂苷类化合物的水平,为推进工业化应用奠定基础。

