联合检测在丙型肝炎患者早期诊断中的应用
李珍 李科 王六林
丙型肝炎是由丙型肝炎病毒(HCV)主要经通过血液和血制品传播引起的严重威胁人类健康一类传染性疾病。丙型肝炎呈现全球性流行,在不同年龄、性别、种族人群中均易感[1-3]。据世界卫生组织统计,全球HCV的感染率为2.8%,中国现有感染者有4千万左右,属于高流行区域。HCV感染的最大特征是慢性化[4,5],感染后约40%~50%发展为慢性丙肝,10%~15%发展为肝硬化,约5%最终发展为肝癌[5],因此对丙型肝炎的早期筛查显得尤为重要。本文对我院临床确诊的313例丙型肝炎患者血清标本进行HCV-Ab、HCV-cAg和HCV-RNA等三种方法联合检测,对其相关性进行分析,以探讨在丙型肝炎临床早期诊断中的意义,报道如下。
1 资料与方法
1.1 一般资料 选取我院2017年10月至2019年3月门诊及住院的临床确诊丙型肝炎患者313例,均符合中华医学会肝病学分会制定的《丙型肝炎防治指南》(2015年更新版)中的诊断标准。其中男198例,女115例;年龄16~73岁,平均(47.21±8.39)岁。所有病例排除其他类型肝炎感染及其他疾病引起的肝脏损坏。检测标本均为当天早晨空腹抽取的静脉血液,2 h 内上机检测,不能及时上机检测的标本,提取血清置于-20℃冰冻保存。
1.2 检测方法 HCV-Ab与HCV-cAg检测均采用酶联免疫吸附试验(ELISA)方法检测,按照试剂盒说明书进行操作,所得到的结果为吸光度值与临界示,阳性结果均进行再次复查。HCV-RNA检测采用荧光定量聚合酶链反应(PCR)方法检测,核酸提取及反应体系的配制按照说明书操作,所得结果单位值之比,用S/CO表用U/ml表示。采取贝克曼库尔AU58000系统检测血清生化检验指标,包括总胆红素(TBIL)、丙氨酸氨基转氨酶(ALT)、门冬氨酸氨基转移酶(AST)。
1.3 仪器与试剂 HCV-Ab与HCV-cAg在郑州安图有限公司所产ELISA ADC-400全自动酶免分析仪进行检测,荧光定量PCR检测在达安基因DA7600荧光扩增仪上进行检测。HCV-Ab试剂盒为郑州安图生物工程股份有限公司生产,HCV-cAg试剂盒为山东莱博生物科技有限公司生产,HCV-RNA试剂盒为中山大学达安基因股份有限公司生产,所用质控品和校准品为配套使用。
1.4 结果判定 HCV-Ab和HCV-cAg的样本吸光度值比临界值(S/CO)>1视为阳性,S/CO<1为阴性。HCV-RNA检测结果<1×103U/ml为低于检测下限,判定检测阴性;>1×103U/ml的样本判定为阳性。
1.5 统计学分析 应用SPSS 19.0统计软件,计数资料以百分率表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 血清HCV-Ab、HCV-cAg和HCV-RNA单独检测阳性率比较 血清HCV-Ab、HCV-cAg和HCV-RNA单独检测阳性率分别为91.7%、60.7%和54.6%。单项检测HCV-Ab的阳性率明显高于HCV-cAg检测阳性率(P<0.05)和HCV-RNA检测阳性率(P<0.05),而HCV-cAg检测阳性率和HCV-RNA检测阳性率无显著性差别(P>0.05)。见表1。

表1 血清HCV-Ab、HCV-cAg和 HCV-RNA单独检测阳性率比较
2.2 血清HCV-Ab和HCV-cAg及HCV-Ab和HCV-RNA联合检测结果比较 若将HCV-Ab和HCV-cAg以及HCV-Ab和HCV-RNA两种方法进行联合检测,则得到的阳性率分别为99.0%(310/313)和98.4%(308/313)。144例HCV-cAg阳性检测结果中HCV-RNA的阳性符合率为88.9%(128/144),26例HCV-Ab检测为阴性标本中HCV-RNA的阳性率为80.8%(21/26)。见表2。
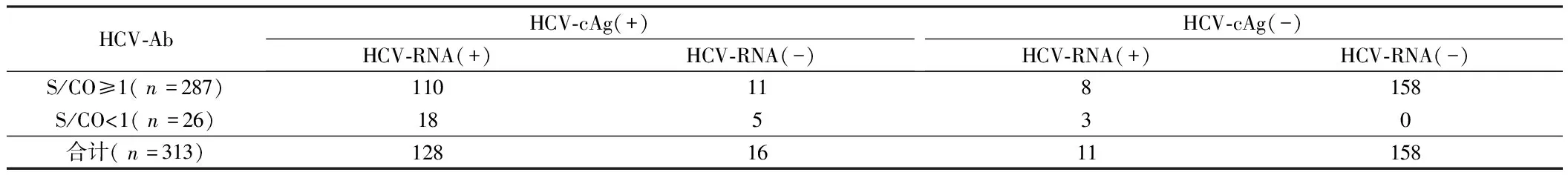
表2 血清HCV-Ab和HCV-cAg及HCV-Ab和HCV-RNA联合检测结果比较 例
2.3 血清HCV-RNA与血清生化指标检测结果比较 若将HCV-RNA与肝功能比较则得到HCV-RNA阳性率TBIL、ALT及AST水平,其中HCV-RNA阳性患者的TBIL水平与HCV-RNA阴性者水平差异无统计学意义(P>0.05),而ALT、AST水平则高于HCV-RNA阴性者(P<0.05)。见表3。
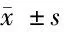
表3 血清HCV-RNA与血清生化指标检测结果比较
3 讨论
丙型肝炎在全球均有着较高的发生率,研究报告调查表明北方丙型肝炎发生率显著高于南方,虽然早期临床症状无明显恶劣影响,但是后期可明显导致诸多恶性事件[6]。丙型肝炎患者早期症状不明显,由于隐蔽性很强最初并不知晓,不通过检测手段很难发现,从而耽误早期诊断、早期治疗的最佳时机,因此,早期明确诊断显得极其重要[6,7]。
目前实验室诊断丙肝的主要方法是检测HCV-Ab和HCV-RNA[8-10],近些年来HCV-cAg的检测越来越引起人们的关注[11,12]。ELISA方法仍是目前临床上作为HCV-Ab最常用、最基础的筛查方法,由于该方法先后已经历了三代技术发展,近年来随着基因工程技术不断成熟,试剂盒质量也在不断完善,全自动酶免处理系统在临床逐渐普及,因此测定结果的稳定性、准确性和精密度上有很大程度的提高。但由于“窗口期”的问题,仍然存在一定的漏检率[13,14]。ELSA试剂法对免疫功能正常的患者有着较好的诊断率,对于无症状的丙型肝炎病毒携带者却仍无法有效检出,本文表1结果显示单独检测HCV-Ab阳性率达91.7%,但由于HCV感染早期患者的临床症状不典型,病毒本身具有变异性,HCV感染后6~12周左右的时间产生HCV-Ab,窗口期时间较长,还有少数免疫功能低下者和异常者不产生抗体或产生的抗体量很少,仅通过检测HCV-Ab而作早期诊断容易造成漏检。
HCV-RNA阳性是诊断HCV感染的金标准,也是判定病毒复制和感染的标志,患者感染HCV后1-2周内检测出[15,16]。HCV-cAg是HCV感染者的早期筛查指标,与HCV-RNA同时出现,HCV-cAg的检测可将HCV窗口期缩短至15 d,明显降低HCV感染的漏检率。本文表2结果显示当以HCV-RNA检测为标准时,HCV-cAg检测的灵敏性为92.1%,特异性为90.8%。HCV-cAg阳性样本中HCV-RNA阳性率为88.9%。若将HCV-Ab分别与HCV-cAg和HCV-RNA两种方法进行联合检测,则得到的阳性率分别为99.0%和98.4%,与单独检测HCV-Ab的阳性率性比较差异具有统计学意义(P<0.05),与HCV-cAg单独检测阳性率60.7%或者HCV-RNA单独检测阳性率54.6%比较均具有显著性差异(P<0.01)。
另外本文发现HCV-Ab和HCV-cAg结果为阳性而HCV-RNA结果为阴性的标本有11例,HCV-Ab和HCV-cAg结果为阴性而HCV-RNA结果为阳性的有8例,可能是由于HCV-RNA病毒容易被血细胞的RNA酶降解,容易与血中脂蛋白及脂质结合造成假阴性结果有关,也可能因为患者体内免疫状态的变化、药物因素、试剂和操作等原因造成的误诊或漏诊,所以三种方法均有各自局限性[7]。不仅如此,HCV-RNA阳性患者的TBIL水平与HCV-RNA阴性者水平差异无统计学意义(P>0.05),而ALT、AST水平则高于HCV-RNA阴性者(P<0.05)。TBIL、ALT、AST均可从一定程度上反映肝脏功能,提示丙肝者体内处于活动性炎症状态,而HCV-RNA阳性者肝脏炎症严重程度相对于HCV-RNA阴性者更高。HCV-RNA病毒。有临床研究表明丙肝抗体联合丙肝核心抗原检测可有效减少抗检窗口期漏诊率,其实验结果显示动态监测可有效观察丙肝病毒的清除情况,两者在共同阳性的情况会有效提示当前丙肝抗原存活,未被中和,而且抗体可有效被检测,同时存在传染性[17,18]。有临床研究表明感染HCV出现HCV抗体期间有着较长的潜伏期,为了避免后期肝硬化及肝癌的发生,应提高HCV抗体即将出现的60 d内检测效能,除了高精密检测仪器后还需要检测人员拥有丰厚的操作技术,血清中检测到HCV-RNA之前通过联合检测,采取HCV-Ab和HCV-cAg联合检测可有效在早期诊断HCV,核心抗原联合检测对检验人员的技术水平无较高要求,同时对仪器设备的要求不严格,可有效提高丙肝窗口期的检出率[19]。此外临床还应考虑标本污染导致的HCV-RNA降解,导致HCV-cAg检测试剂盒检测结果出现假阳性[20]。有临床研究表明标本中HCV-cAg检测的阳性率较低,单克隆抗体竞争结合也可导致。
综上所述,HCV-cAg和HCV-RNA作为补充指标,与HCV-Ab联合检测,可有效缩短窗口期,降低漏检率,达到HCV患者早期诊断、早期治疗的临床目的,而联合检测生化指标,具有一定的辅助诊断价值,在临床应用和推广具有一定意义。

