碱性离子液体TBAH预处理对桉木结构和酶解性能的影响
王淑捷, 侯贤锋, 黄颖诗, 陈小凤, 孙 瑾, 高振忠
(华南农业大学 材料与能源学院,广东 广州 510642)
木质纤维生物质是一种重要的生物炼制原料,但碳水化合物和木质素之间的紧凑结构是其利用的关键障碍。目前,国内外开发了许多预处理技术来打破这种缠绕结构[1-2]。其中,被视为绿色溶剂的离子液体(IL)因不挥发、化学稳定性好和热稳定性高等特性而备受关注[3]。IL是由有机阳离子与有机或无机阴离子组成,可以破坏天然纤维素晶体结构中的氢键[4]。IL预处理木质纤维素通常会降低纤维素的结晶度,部分去除木质素和半纤维素从而提高木质纤维素在室温下的酶解能力。四丁基氢氧化铵(TBAH)是一种具有经济性和低生物毒性的离子液体,可被用于预处理木质纤维生物质。诸多研究者对TBAH阴离子与阳离子溶解纤维素的能力进行了深入研究[5],但鲜有提及TBAH中阳离子[TBA]+和阴离子OH-在预处理中的作用机理。四丁基氟化铵(TBAF)作为一种中性离子液体,与TBAH具有相同的阳离子,可用于探究阳离子[TBA]+在预处理桉木中的作用机理。本研究采用响应面分析法,通过仿真模型获得TBAH最佳预处理条件,对比未处理、NaOH、TBAF和TBAH预处理的桉木粉的组成成分的变化,并结合FT-IR、XRD和SEM的分析,探究了TBAH预处理桉木中阳离子[TBA]+和阴离子OH-的作用机理。
1 材料和方法
1.1 原料、试剂及仪器
桉木粉末,取自华南农业大学的木工厂。空气干燥两周后,用筛机筛分样品,以获得尺寸为0.18~0.25 mm的桉木粉末。离子液体四丁基氢氧化铵(TBAH)水溶液(质量分数25%)、四丁基氟化铵(TBAF)和3,5-二硝基水杨酸(DNS),均购自上海的Aladdin公司。纤维素酶(酶活50 000 U/g)和β-葡萄糖苷酶(酶活110 U/g),购自江苏省锐阳生物技术有限公司。
NICOLET6700傅里叶变换红外吸收光谱(FT-IR)仪,美国Thermo公司;Ultima IV型X射线粉末衍射(XRD)仪,日本Rigaku公司; S-570扫描电子显微镜(SEM),德国Zeiss公司。
1.2 桉木预处理
1.2.1TBAH预处理 将5 g桉木粉末与TBAH溶液按料液比1 ∶20(g ∶mL,下同)混合,在磁力搅拌器中以TBAH的质量分数、预处理时间和预处理温度为自变量,还原糖产率为响应值根据Box-Behnken试验设计原理,采用三因素五水平响应面分析法设计了该试验的所有组和相应的实验条件进行预处理[6]。预处理后的样品经过砂芯漏斗过滤,并用大量去离子水洗涤至中性,固体样品置于(103±2) ℃烘箱中烘至绝干,取出放置干燥器中备用。
1.2.2TBHF预处理 将5 g桉木粉末与TBAF溶液按料液比1 ∶20混合,在1.2.1节模拟出的TBAH预处理的最优条件下进行预处理。预处理后的样品经过砂芯漏斗过滤,并用大量去离子水洗涤至中性,固体样品置于(103±2) ℃烘箱中烘至绝干,取出放置干燥器中备用。
1.2.3NaOH预处理 将5 g桉木粉末与NaOH溶液按料液比1 ∶20混合,在1.2.1节模拟出的TBAH预处理最优条件下进行预处理。预处理后的样品经过砂芯漏斗过滤,并用大量去离子水洗涤至中性,固体样品置于(103±2) ℃烘箱中烘至绝干,取出放置干燥器中备用。
1.3 纤维素酶解
将0.1 g桉木粉加入50 mL锥形瓶中,并补充30 mL柠檬酸钠缓冲液(pH 值4.8),之后加入35 FPU/g 的纤维素酶,30 FPU/g的β-葡萄糖苷酶,用橡胶塞密封瓶子,将混合物在温度50 ℃和转速150 r/min 的培养箱中酶解72 h。每间隔12 h取出水解产物通过3,5-二硝基水杨酸(DNS)测定法测量还原糖的浓度,所有实验均重复3次。还原糖产率和纤维素转化率按式(1)~(2)计算:
(1)
(2)
式中:N1—还原糖产率,mg/g;V—锥形瓶中缓冲液的体积,mL;C—DNS法测定还原糖质量浓度,g/L;W—加入桉木粉质量,mg;N2—纤维素转化率,%;Q—样品中纤维素的质量分数,mg/g。
1.4 表征分析
1.4.1组成成分 采用范氏(van Soest)法对预处理前后桉树粉末进行成分分析。以中性洗涤试剂、酸性洗涤试剂和72%H2SO4为原料,制得中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、酸性洗涤木质素(ADL)。ADF与NDF的差值,ADF与ADL的差值,ADL与灰分的差值分别作为半纤维素、纤维素和Klason木质素含量[7]。为了获得可重复的结果,将相对百分比差异设置为小于5%。
1.4.2FT-IR 将1 mg桉木粉末与100 mg KBr混合均匀通过压片机进行压片,将制备好的压片放入傅里叶变换红外吸收光谱仪进行扫描。扫描波数范围 4000~400 cm-1,分辨率为4 cm-1。
1.4.3XRD 将各个样品粉末倒入载玻片的凹槽中,用另一个载玻片或其他东西将粉末均匀覆盖在凹槽中(覆盖度80%~100%),之后用酒精擦拭干净洒出在载玻片凹槽外的粉末。然后将样品放在X射线粉末衍射仪中,样品的XRD分析在2θ=5~50°的范围内进行,扫描步长为0.02°。根据式(3)计算结晶度指数(ICr):
ICr=(I002-Iam)/I002×100%
(3)
式中:I002—2θ值为22.5°时的峰值强度;Iam—2θ值为19°时的峰值强度。
1.4.4SEM 在扫描电镜上观察桉木粉末的表面形态。操作电压为10 kV,在观察之前将样品用导电胶黏在样品底座上,在样品上喷涂一层薄薄的金,以防止电荷沉积在表面上。然后对样品表面进行500倍放大观察。
2 结果与讨论
2.1 响应面试验结果


表1 响应面试验设计与结果
利用Design-expert 12软件对实验结果进行多元回归和方差分析,并对回归模型进行显著性检验。该模型的方差结果在表2中。

表2 TBAH回归方程方差分析(ANOVA)

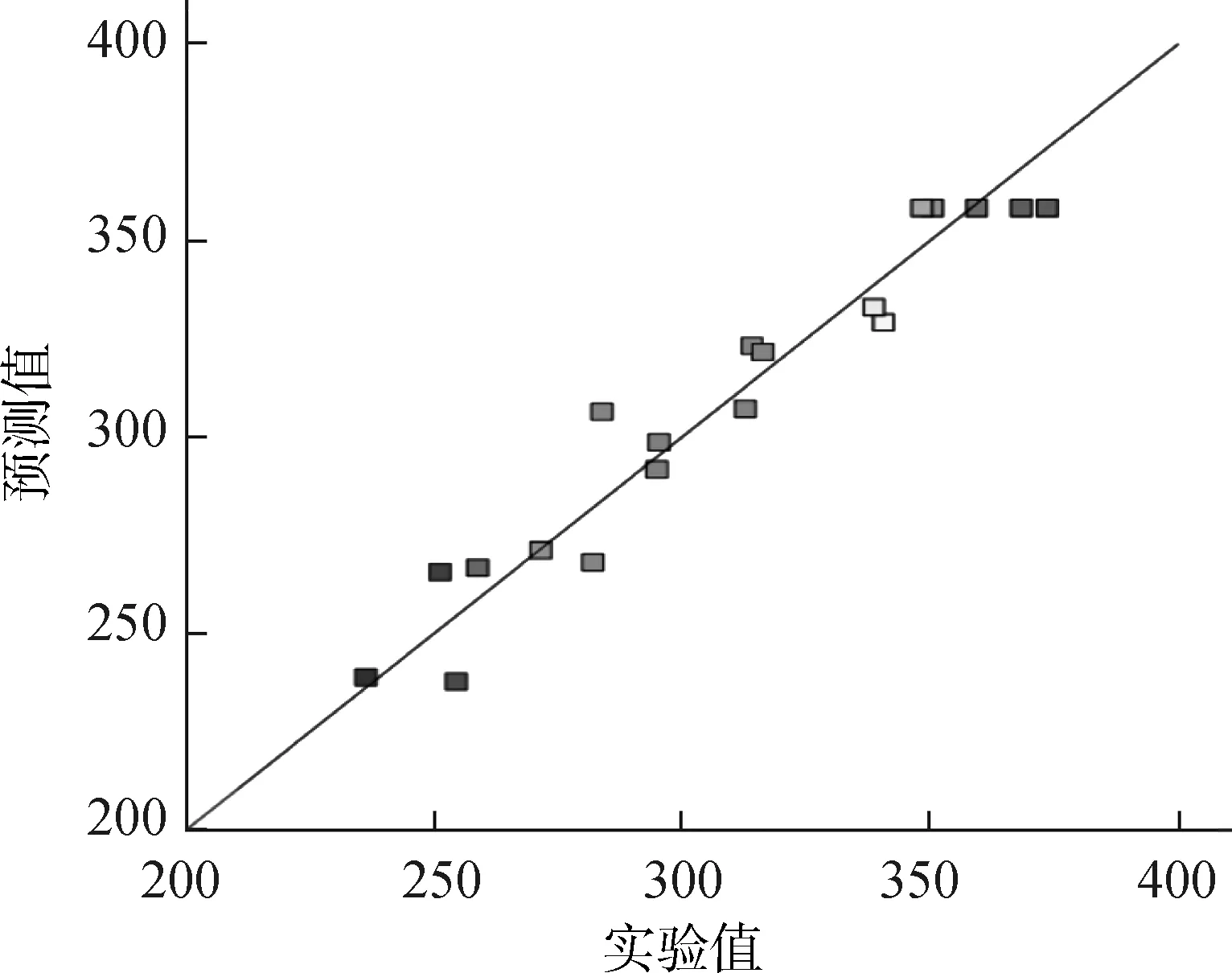
图1 TBAH模型预测值与实验值比较Fig.1 Comparison of TBAH model prediction value with experimental value
此外,通过回归模型预测,TBAH预处理桉木获得还原糖的最佳条件为:预处理时间57.19 min,预处理温度71.98 ℃,TBAH质量分数11.78%。在此预处理条件下进行3次验证实验,还原糖的平均产率为365.62 mg/g(纤维素转化率69.24%),与理论预测值367.91 mg/g相比,误差仅有0.62%,证实了模型的有效性[14]。
2.2 预处理对桉木酶解的影响
2.2.1成分分析 如表3所示,与未处理的桉木粉相比,NaOH、TBAF和TBAH的预处理后木质素和半纤维素的含量较低,表明3种预处理均会降解木质素和半纤维素。[TBA]+阳离子与木质素的分子间结合作用能比[TBA]+阳离子与纤维二糖的分子间结合能低,这表明[TBA]+阳离子更倾向于与木质素的结合,所以与NaOH相比,TBAF、TBAH可以降解更多的木质素[15]。NaOH预处理比TBAF和TBAH预处理降解更多的半纤维素,降解机理是碱性溶液中OH-使得半纤维素糖基之间的苷键断裂,以及破坏半纤维素和其他成分之间的酯键,造成半纤维素水解[16]。与TBAF预处理相比,TBAH预处理可去除更多的半纤维素,表明TBAH中的OH-与NaOH预处理中OH-作用效果类似,表明碱性离子液体TBAH同时具有阳离子[TBA]+和碱性溶液OH-的特性。
2.2.2还原糖产率 使用TBAF、TBAH和NaOH在TBAH预处理的最佳条件下对桉木粉进行预处理,还原糖产率分别为301.43、 365.62和356.91 mg/g(见表3)。TBAF、NaOH和TBAH 3种溶液进行预处理后明显提高了纤维素水解的作用。对比TBAF与TBAH预处理后样品的还原糖产率,相同的阳离子[TBA]+条件下,OH-的预处理效果优于F-预处理。对比NaOH与TBAH还原糖产率,Na+与[TBA]+的预处理效果也不同。

表3 预处理对桉木化学成分及酶解的影响
2.3 预处理对桉木理化性质的影响
2.3.1FT-IR分析 预处理前后桉木样品的FT-IR光谱如图2所示。897 cm-1处吸收峰显示的是纤维素的β-(1- 4)-糖苷键的伸缩振动[17-18],预处理后的桉木样品在此处的吸收峰的强度均强于未处理桉木,这表明预处理后样品纤维素含量增加。1750和1240 cm-1处分别与半纤维素中的乙酰基的C—O和酯的拉伸振动相关。与未处理桉木相比,预处理后桉木样品这两个吸收峰均减弱或消失,表明在预处理过程中去除了部分半纤维素成分。与TBAF预处理相比,TBAH和NaOH预处理桉木此处的吸收峰强度更低[19],结合成分分析说明了TBAH预处理中碱性阴离子OH-与NaOH中OH-的作用机理相同,可以去除更多的半纤维素。1512、 1600和1652 cm-1处的吸收峰分别归因于木质素中的芳香族骨架振动和C—H振动[20]。与未处理的桉木样品相比,预处理后的样品在这些吸收峰处显示较弱的信号,表明预处理均可降解部分木质素。与NaOH预处理相比,TBAH和TBAF预处理桉木的吸收峰显著降低,这是预处理中[TBA]+作用的结果。
2.3.2XRD分析 由XRD数据(图3)得出的ICr适用于评估预处理对木质纤维生物质结晶度的影响。

与未处理桉木(42.39%)相比,预处理后的样品具有更高的ICr,其中TBAF、NaOH和TBAH预处理后ICr值分别为53.82%、 61.29%以及54.11%。这是因为预处理破坏了相对较少的晶体结构和相对较多的非晶结构域(木质素和半纤维素),从而使得ICr增加[21]。其中,TBAF和TBAH预处理的ICr低于NaOH预处理。其原因是IL预处理中[TBA]+可以破坏纤维素的晶体区域,使纤维素晶体区域中的ICr值降低[22]。TBAH与TBAF预处理相比,可以去除更多的非结晶区域;TBAH与NaOH预处理相比能破坏纤维素的结晶区域,所以TBAH预处理后桉木样品的ICr值在TBAF与NaOH预处理样品之间。
2.3.3SEM分析 为了获得桉木样品的直观形态信息,使用SEM记录了未处理桉木、NaOH、TBAF和TBAH预处理的桉木粉的显微照片(图4)。

a.未处理feedstock; b.TBAF; c.TBAH; d.NaOH
未处理的桉木的表面是连续而光滑的,其中木质素为胞间层连接纤维与纤维之间的结壳物质,半纤维素则为细胞壁中分布在微纤维中的填充物质[23]。TBAF和TBAH预处理后的桉木表面相比于未处理的桉木样品均变得宽松且不平整。预处理的桉木样品表面很多地方呈现蜂窝状,这可能是由于部分半纤维素和木质素被破坏的原因。NaOH预处理出现大量褶皱,沿径向细胞壁破坏呈规则排列,也使得纤维表面暴露出大量活性界面,加速纤维素的酶解。
3 结 论
3.1建立响应面分析法设计模型,确定TBAH预处理最佳条件:预处理时间为57.19 min,预处理温度为71.98 ℃,TBAH质量分数为11.78%。在这条件下,还原糖的产率为365.62 mg/g,预处理后样品中纤维素、半纤维素和木质素质量分数分别为52.8%、 18%和15%,纤维素转化率达到69.24%。
3.2主要成分分析和FT-IR图谱表明碱性离子液体TBAH中的OH-在对桉木预处理中的作用与NaOH中OH-的作用机理相同,可以去除较多的半纤维素;阳离子[TBA]+可以降解较多的木质素。XRD分析表明预处理会降解非结晶区,并且[TBA]+会破坏纤维素晶体区域。SEM分析表明OH-和[TBA]+二者共同作用会导致桉木表面破损的、有孔的和不规则的微观形态,提高纤维素酶对纤维素的可及性,促进酶水解以获得高糖产率。

