ESM⁃1在复发性垂体腺瘤中的表达及意义
赵昭,阎晓玲
[关键字] 垂体腺瘤;免疫组化;ESM⁃1
垂体腺瘤是一种好发于垂体前叶的良性肿瘤,常因压迫症状就诊时已十分巨大,手术全切除非常困难,残留的肿瘤组织则成为复发的潜在风险[1],约为 9.4%~17%[2,3],再次手术的难度大幅提高。内皮细胞特异性分子⁃1(endothelial cell⁃specific molecule⁃1,ESM⁃1)或ESM⁃1 是近年来人们在人类血管内皮细胞中发现的一种蛋白多糖,ESM⁃1 通过HGF/SF 信号通路导致肿瘤发生并促进肿瘤细胞增殖,通过NF⁃κB 信号通路抑制肿瘤细胞凋亡,通过VEGF 和HIF 通路促进肿瘤内血管生成[4]。多种癌症中发现了高水平的ESM⁃1 表达,包括肺癌[5]、肾癌[6]、结直肠癌[7]、急性髓系白血病[8]、乳腺癌[9]、胶质细胞瘤[10]、垂体瘤[11]。关于ESM⁃1 与垂体瘤发生发展的研究很少,现有研究认为垂体瘤进展可能通过ESM⁃1 相关机制发生[12]。本研究通过免疫组化方式对患者肿瘤中ESM⁃1 的表达进行检测并分析ESM⁃1 表达与肿瘤复发、ki⁃67 蛋白阳性表达指数以及年龄、性别等相关因素的关联情况,试图发现ESM⁃1 等标志物对于肿瘤复发、指导治疗以及预后中的作用。
1 对象及方法
1.1 一般资料
选取 2018 年 2 月至 2021 年 4 月于天津市环湖医院行垂体腺瘤切除术的33 例患者,其中复发性垂体腺瘤16 例,首发性垂体腺瘤17 例。男女比为12∶21,平均年龄为(48.3±13.5)岁,术后经免疫组化染色确定激素类型如下:生长激素腺瘤2 例,泌乳激素腺瘤2 例,促性腺激素10 例,零细胞腺瘤17例,多激素腺瘤2例。收集全部33例垂体腺瘤及16例复发垂体腺瘤患者的首发肿瘤标本制成蜡块。
1.2 肿瘤缓解及复发的标准
垂体腺瘤缓解:生长激素腺瘤:血GH 浓度<2.5 ng/mL;泌乳激素腺瘤:血清PRL浓度<20 ng/mL;促肾上腺素腺瘤:24 小时尿游离皮质醇正常;无功能腺瘤:压迫症状(如头痛、头晕、视力视野改变)较前改善及术后影像学检查显示肿瘤全切除或近全切除。肿瘤复发标准:影像学复查发现新生肿瘤或残余肿瘤的再次生长(无功能性腺瘤)[7]以及术后检测已降低的激素水平再次升高(功能性腺瘤)。
1.3 实验方法
所有标本均进行常规HE 染色(肿瘤标本经固定、脱水后包埋、切片,经苏木精、伊红染色后封片观察)及免疫组化染色(组织切片滴加兔抗人ESM⁃1、ki⁃67、P53 多克隆抗体,PBS 代替一抗作为阴性对照组,添加聚合生物素标记抗兔抗体,加显色剂后封片观察)(染色结果见图1)。
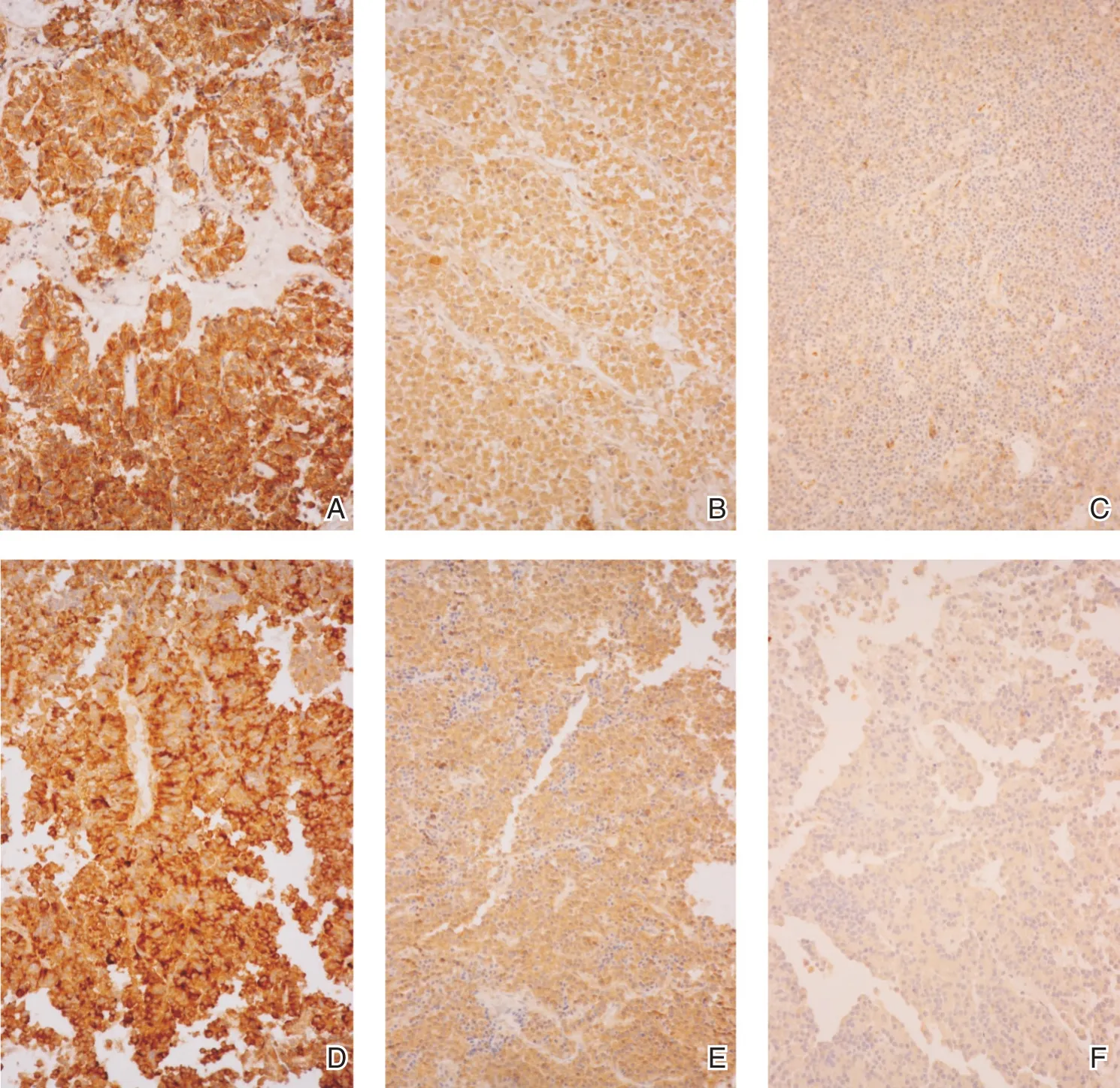
图1 垂体瘤ESM⁃1 表达
ESM⁃1 蛋白染色评定:采用 Mattcrn 积分法以染色深度及阳性细胞所占百分比来评价。染色强度积分:0 分:阴性,1 分:弱阳性,2 分:中度阳性,3 分:强阳性;阳性细胞百分比:在每例标本中随机选择5 个含有阳性细胞的高倍视野(×200)分别计数100 个肿瘤细胞,计算阳性细胞数百分比(%),取其平均值。阳性细胞百分比积分:0 分=0%阳性细胞,1 分=≤25%阳性细胞,2 分=≤50%阳性细胞,3 分=>50%阳性细胞。染色强度和阳性细胞百分比积分乘积作为阳性表达指数;0 分为(-),1~3 分为(+),4⁃5 分为(++),≥6 分为(+++);<4 分为阴性,≥4 分为阳性。
1.4 Ki⁃67 抗原染色评定标准
ki⁃67 主要表达于垂体腺瘤细胞的胞核中,阳性表现为胞核染成棕黄色或棕褐色,背景不着色。连续观察5 个高倍镜视野,计数100 个肿瘤细胞,取阳性细胞数均值,以百分数表示,得出ki⁃67增殖细胞指数(ki⁃67LI)。
1.5 统计学方法
所有数据处理采用SPSS 19.0 数据统计分析软件系统进行。计量资料以均数±标准差()表示,比较采用t检验以及方差分析;计数资料采用百分数表示,比较采用卡方检验;两组数据相关程度采用相关分析,以P<0.05 为差异有统计学意义。
2 结 果
2.1 一般结果
本组研究中33 例患者中有6 例出现内分泌症状(表现为闭经泌乳6 例、肢端肥大1 例),几乎所有患者均出现压迫症状(头痛或头晕11 例、视力视野改变25 例)。2 例患者没有临床症状,由体检发现。随访时间为6~11 年,共有复发病人16 例。
2.2 肿瘤复发与ESM⁃1 表达
复发组垂体腺瘤较未复发组垂体腺瘤具有更高的ESM⁃1 表达,复发组ESM⁃1 分值为1.84±0.77,未复发组垂体腺瘤ESM⁃1 表达分值为1.53±0.41,两组垂体腺瘤ESM⁃1 蛋白表达分值差异有统计学意义(t=2.75,P<0.01)。复发组垂体腺瘤患者首次发病与复发时垂体瘤ESM⁃1 的表达相当(1.59±0.66vs.1.84±0.77,P=0.54)。
2.3 复发垂体瘤ESM⁃1表达与疾病发生发展的关系
ESM⁃1 表达与 KI⁃67 表达明显相关(P=0.02)。ESM⁃1 表达与患者年龄、肿瘤直径、P53 没有发现明显相关。本组共有男性患者12 例,ESM⁃1 表达分值为1.75±0.50,女性患者19 例,ESM⁃1 表达分值为1.56±0.57,两者之间差异无统计学意义(P=0.34)。患者肿瘤最大直径为(34.33±9.24)cm,肿瘤最大直径与ESM⁃1 表达分值之间差异无统计学意义(P=0.22)。33 例患者肿瘤P53 表达阳性比与ESM⁃1 表达之间无明显相关性(P=0.78)。见表1。
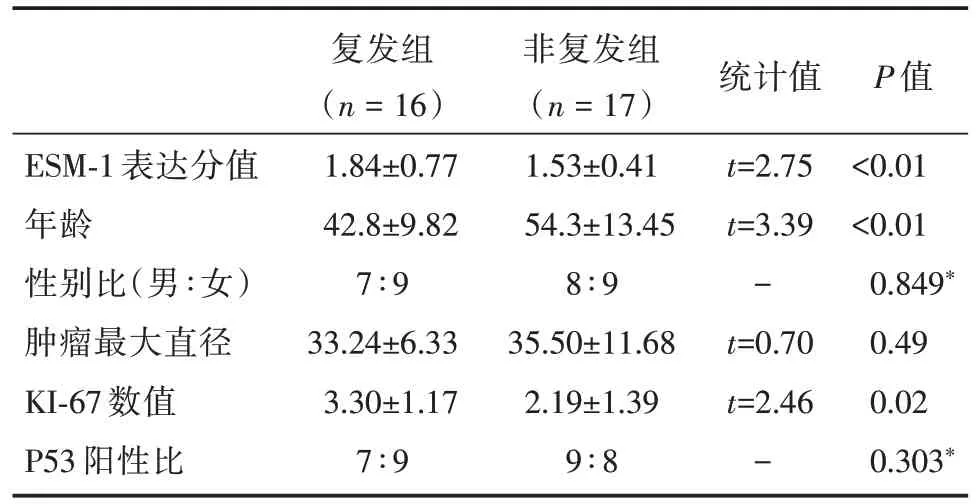
表1 垂体腺瘤复发ESM⁃1 表达的相关因素分析
3 讨 论
虽然垂体腺瘤组织学上为良性肿瘤,但有一部分肿瘤可表现出侵袭性,向鞍上、海绵窦内及蝶窦内等结构生长,手术治疗的难度较大,无论是经颅还是经鼻蝶切除均有可能残留部分肿瘤,从而导致首次外科治疗后的复发。大部分垂体腺瘤复发时间在3~5 年[13],但也有部分垂体腺瘤在术后甚至30 年才复发[14]。
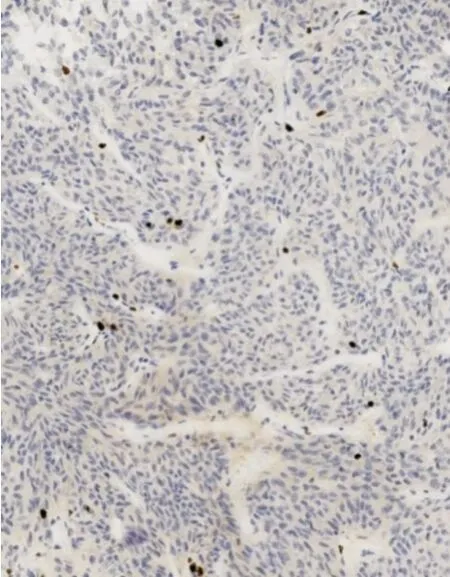
图2 复发患者垂体瘤ki⁃67 阳性表达 ×100

图3 复发患者垂体瘤p53 阳性表达 ×100
研究证明,血管内皮在包括炎症、凝血、血管生成、肿瘤侵袭、感受器与受体相互影响以及多种介质的分泌等过程中均扮演着重要的角色。ESM⁃1,是一种由内皮细胞分泌的内皮细胞特异性分子。它的本质是一种由165 个氨基酸及一条单皮肤素磷酸链组成的皮肤素磷酸根蛋白多糖。因在正常情况下,ESM⁃1 的表达主要局限于人体的肺、肾及胃肠道组织中,而在其它组织中表达量很低,而在败血症及多种肿瘤患者的血液中,ESM⁃1 的表达量呈现明显的增高。Bechard 等[15]人研究发现ESM⁃1 具有调节干细胞生长因子的促进有丝分裂行为的作用。而在具体肿瘤中ESM⁃1 表达与肿瘤恶性程度及患者预后的关系方面,人们做了很多研究。Grigoriu 等发现在肺癌患者中,血清中ESM⁃1水平与患者整体生存期及发生远处转移的概率有明确联系,并且ESM⁃1低水平组的患者比ESM⁃1高水平组的患者有着更长的生存时间[5]。van't Veer等人发现在乳腺癌中RNDOCAN 与另一个70 基因标签共同作为早期远处转移的标记物[16]。同时,ESM⁃1 可能通过诱导乳腺癌细胞的增殖和侵袭在乳腺癌细胞的肿瘤发生中起关键作用[17]。在同属中枢神经系统的胶质母细胞瘤中,免疫组化染色阴性的肿瘤患者平均生存期为16.8个月,而免疫组化染色阳性的肿瘤患者平均生存期为10.8 个月,两者之间存在明显差异,这或许可以解释ESM⁃1的表达是否反映胶质母细胞瘤血管重建的问题以及ESM⁃1 表达水平是否可以作为肿瘤复发的标志[10]。通过以上研究可以看出,ESM⁃1 的表达不仅在肿瘤发生等病理过程中至关重要,在肿瘤的预后及复发过程中也扮演着重要的角色。
ESM⁃1 基因不仅可以作为肿瘤血管内皮的标志物,更可以作为治疗的靶点[4,18]。例如,位于肿瘤血管的ESM⁃1 的催化因子的定位就为基因治疗提供了框架,另外调节肿瘤血管内皮上ESM⁃1 表达的细胞外因子及细胞内信号旁路也可能在治疗过程中起到关键性作用。

