巨大乳腺交界性叶状肿瘤一例
朱晨,张萌,王泽,贾建东
乳腺叶状肿瘤(phyllodes tumors,PTs)是一种罕见的乳腺肿瘤,由乳腺纤维腺瘤组织中纤维组织恶变而来,是上皮成分和结缔组织混合的恶性肿瘤[1]。1938 年由 Muller 首次报告,1982WHO 将其命名为乳腺叶状肿瘤,根据病理组织学特征可分为良性、临界性和恶性三类,良性起病多无明显症状,交界性及恶性多生长迅速。目前叶状肿瘤的发病机制尚不明确,叶状肿瘤(PTs)是一种占乳腺肿瘤<1%的纤维头状病变,50%~80%是良性的,其复发率较高少数可见远处转移[2]。现结合我院收治的1 例交界性叶状肿瘤病例,结合文献对本病例的发病机制、临床诊断以及治疗进行探讨。
1 病例资料
患者女,34 岁,半年前无明显诱因发现右乳肿块,质硬,如核桃大小,无红肿疼痛,近半年自觉肿物迅速增大,既往无其他病史。入院时查体:双乳下垂,不对称,右乳明显增大,右乳浅表静脉显露明显,双乳皮肤无溃破,无红肿,无橘皮样及酒窝征,右乳可及肿块,占据整个乳房,边界不清,表面欠光滑,质硬,于右乳3 点、9 点及6 点近乳晕处可触及质软、膨胀感,右乳肿块无压痛,左乳未及明显肿物,双腋下未及明显肿物。
实验室检查:术前常规查女性激素、肿瘤五项、血常规以及肝肾功能,结果如下:女性激素:雌二醇(E2)167.00 pg/mL,促黄体生成素(LH)14.89 mIU/mL,泌乳素(PRL)46.39 ng/mL↑,其中泌乳素稍高,其余结果均正常。肿瘤五项:甲胎蛋白(AFP)4.96 ng/mL,癌胚抗原(CEA)2.62 ng/mL,铁蛋白(FER)103.99 ng/mL,糖类抗原153(CA153)9.4 U/mL,细胞角质素19 段(CYFRA21⁃1)1.39 ng/mL,结果均提示正常。血常规结果均提示正常。肝肾功能正常。
影像学检查:彩超提示右乳实性肿物伴少量液化(BI⁃RADS 4 类),右侧腋下淋巴结肿大。(见图1)MRI 提示右乳中前部巨大分叶状肿物(乳腺叶状瘤?),BI⁃RADS 4 类,大小约10.5 cm×15.0 cm×15.5 cm。(见图2、3)
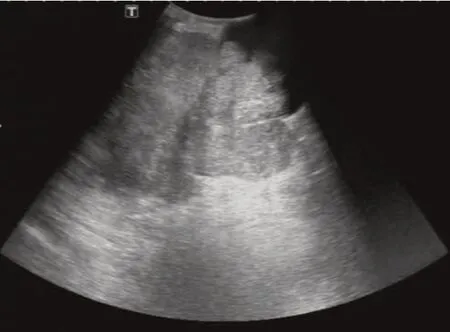
图1 超声示右乳不规则肿物,边缘可见分叶状

图2 MRI 矢状面右乳肿物
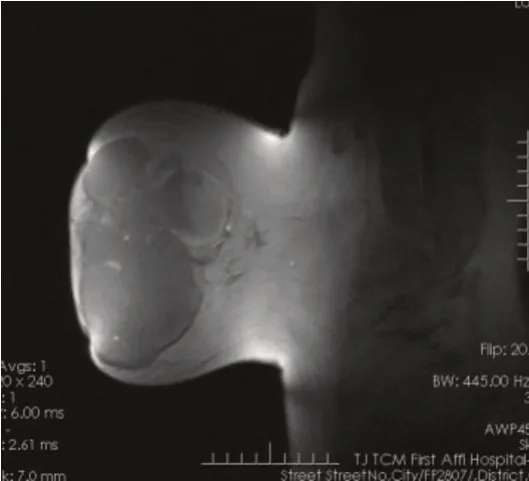
图3 MRI 冠状面右乳肿物
入院诊断:中医诊断乳岩;西医诊断乳房叶状肿瘤。完善检查排除禁忌,于2020 年8 月行手术治疗,术中可见肿物呈膨胀式生长,占据整个乳房,表面不光滑,散在囊性肿物,内可见淡黄色液体,沿肿物边缘扩大切除后送病理。于腺体深及上下皮缘负压引流。(见图4)病理回报:①右乳:考虑为交界性叶状肿瘤。②免疫组化:CD117(-),P53(-),CK7 腺上皮(+),P63 肌上皮(+),SMMHC肌上皮(+),Ki⁃67 核抗原细胞阳性率<5%。③肿物周边组织:多发性分叶状腺纤维瘤,局灶性导管上皮增生。④右乳肿物与正常组织交界:未见肿瘤成分。(见图5、6)病理诊断:右乳交界性叶状肿瘤,肿物周边组织多发分叶状腺纤维瘤,右乳肿物与正常组织交界未见肿瘤成分。
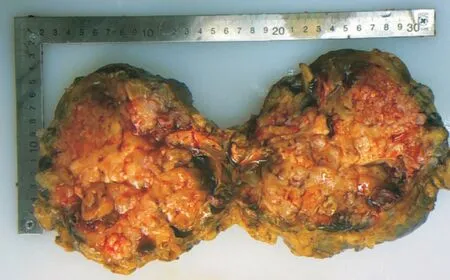
图4 术中肿物切开
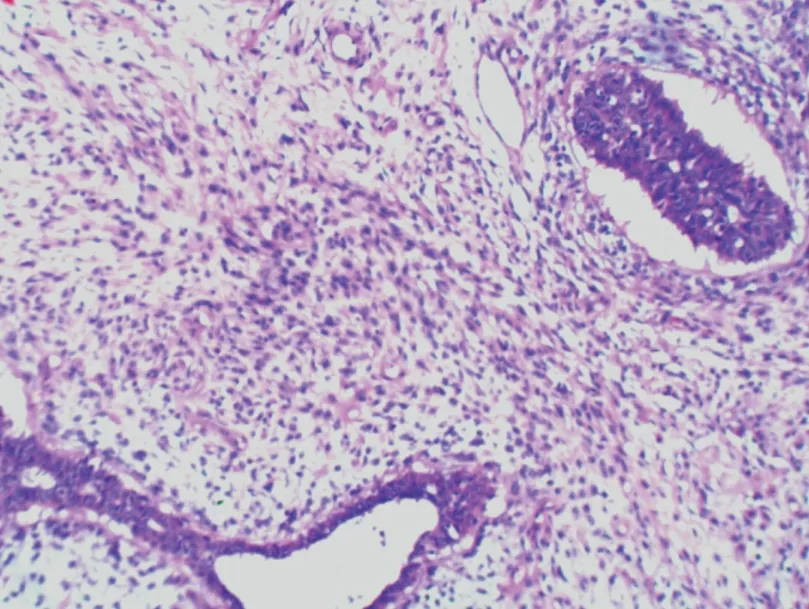
图5 右乳交界性叶状肿瘤病理结果(1∶10 HE)
术后随访:术后6 个月复查乳腺彩超:双腺体不厚,结构清晰,导管未见扩张,腺体回声不均匀,可见散在小片状低回声区,边界不清,右乳下方皮下可见4.9 cm×0.85 cm 条状低回声区,边界欠清,未见明显血流信号。提示右乳下方条状低回声区,考虑术后改变。术后12 个月复查乳腺彩超:双侧腺体饱满,结构欠清晰,内以脂肪回声为主,导管未见扩张,提示切口周围不规则低回声,考虑术后改变。
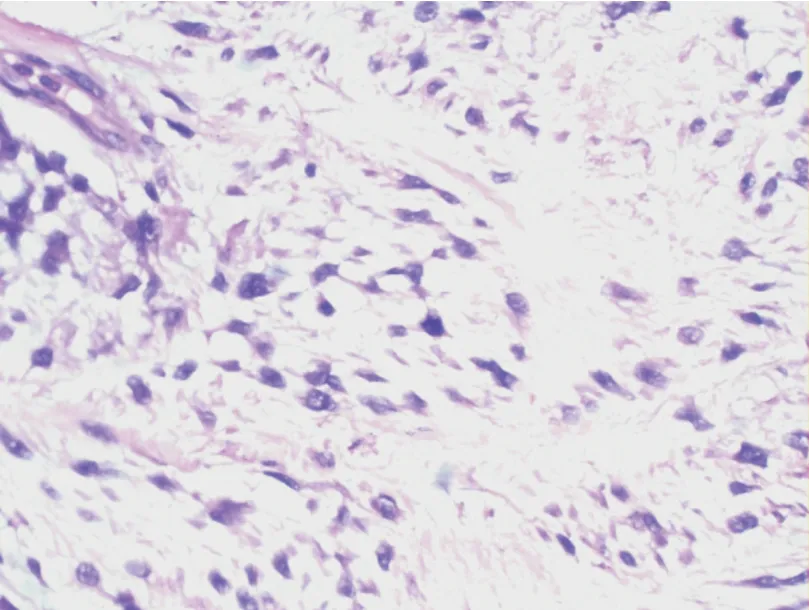
图6 右乳交界性叶状肿瘤病理结果(1∶40 HE)

图7 左侧为术后6 个月乳腺彩超;右侧为术后12 个月乳腺彩超
2 讨 论
乳房叶状肿瘤是一种少见的上皮性肿瘤,占所有乳腺肿瘤的0.3%~0.9%。女性患者多见,可发生于任意年龄段但平均年龄在45 岁,最常见的发病年龄范围为35~49 岁,比纤维腺瘤的最高风险组高20 岁,本病例发生年龄为34 岁,相对而言低于平均年龄[3]。临床上往往表现为单侧坚硬、无痛性增长的乳房肿块,大小可能在1~45 cm 之间,并且可能占据整个乳房,尽管腋窝淋巴结肿大很常见,但淋巴结转移少见[4]。
乳腺叶状肿瘤(PTs)的发生原因目前尚不明确,除种族、年龄、地域等因素外,可能还与卫生习惯、生育哺乳、体内雌孕激素水平变化等因素有关,大多数学者认为与雌激素分泌紊乱、代谢异常有关,目前还有上皮-间质相互干扰作用学说认为与乳腺叶状肿瘤的发病有关。Puay、Ângelo Bezerra de Souza Fede 等认为乳腺叶状肿瘤是种双相肿瘤,由上皮和间质成分组成,典型特征是管内生长模式或突出的间质叶,由上皮细胞和肌上皮细胞排列的裂缝样间隙以及超细胞间质形成[5,6]。
随着诊断技术的不断更新发展,乳房x 线、超声检查、磁共振成像(MRI)、细针抽吸细胞学(FNAC)和针芯活检(CNB)等都可以为我们提供更详细的信息[7]。乳腺钼靶以及乳腺超声是乳腺疾病诊断的常用手段,在叶状肿瘤诊断中具有重要作用。MRI 对机体软组织分辨率较高,对叶状肿瘤以及纤维腺瘤的鉴别诊断有明显有效性,具有较高的灵敏性和特异性,可清晰显现患者乳腺病灶情况,有利于临床两种疾病的鉴别,尤其对于初期瘤体还没有迅速增长时期,减少临床误诊或错诊概率,本例病例MRI 可明显发现肿瘤病灶,对本次诊断提供了参考依据[8]。
乳腺叶状肿瘤属于纤维上皮性肿瘤,主要由上皮细胞和基质细胞组成,临床上主要与乳腺纤维瘤相鉴别,病理表现与纤维腺瘤十分相似,通常表现为椭圆形、圆形或分叶状的局限性肿块,大多数影像学特征难以区分纤维腺瘤和叶状肿瘤[9]。首先,应考虑肿瘤的大小;纤维腺瘤的平均大小为2 cm,通常在直径达到2~3 cm 后停止生长,并自发退化5 cm,而叶状肿瘤的平均大小为4~7 cm,良性肿瘤进展缓慢,但交界性及恶性生长迅速,如果肿瘤大于5 cm 且有分叶就应该考虑为Pts。其次,纤维腺瘤是一个完全良性的病变,但良性叶状肿瘤往往扩大,交界性和恶性叶状肿瘤可能复发[10]。
术后病理诊断是诊断pts 的金标准,通过对组织学检查、镜下上皮细胞和间质细胞的分析,明确诊断以及肿瘤性质从而降低误诊率,良性叶状肿瘤可表现为轻度间质增生,恶性较多可见弥漫性间质增生且间质异型性明显,可与乳腺纤维瘤相鉴别。
手术治疗仍是乳房叶状肿瘤患者的首选治疗方式,临床多采用肿块切除术、扩大切除术、单纯乳房切除术等。手术切缘的选择是目前手术治疗的关注点[11],年龄、肿瘤大小、手术范围、和手术切缘是与局部复发的相关因素,良性叶状肿瘤的阳性边缘与局部复发无关,但在交界性和恶性叶状肿瘤的情况下,应进行再次切除或乳房切除术以获得足够的边缘。良性乳腺叶状肿瘤主要以切除肿瘤以及距肿瘤边缘大于1 cm 的健康腺体组织,交界性及恶性肿瘤主要以广泛局部切除,保证2 cm~3 cm 的阴性切缘认为是安全的,聂云凤[12]等通过对74 例乳腺叶状肿瘤行三种术式后局部复发率统计发现,肿瘤局部切除、肿瘤扩大切除、乳房切除术局部复发率分别为11.6%、9.1%、5.0%。若肿瘤直径大于10 cm,年龄较大,有局部复发及转移的高危因素则选择乳房切除术[13,14]。恶性叶状肿瘤患者的复发风险比其他类型患者更高,因此在这种类型中应始终考虑较大的范围,腋窝淋巴结转移并不常见,而在确诊为恶性PTs 的患者中,一般只有2%的患者发生远处转移。一些作者建议在接受保乳手术治疗的交界性和恶性叶状肿瘤患者中使用辅助放疗来降低局部复发的可能性。
乳房疾病多为女性患者,对于手术治疗的接受度较高,但对于术后瘢痕影响乳房外形美观的问题也需要关注,随着乳腺疾病的微创诊治的发展,一些学者提出用微创的手术方式治疗PTs,马婧靖[15]等通过超声引导下的真空辅助旋切术切除乳房叶状肿瘤,避免了传统手术治疗后大切口、术后瘢痕的问题,选取合适的进针方式及角度可减少对正常腺体的损伤。张少玲等[16]通过对比真空辅助旋切与传统开放手术术后的复发与远处转移,对比发现手术方式并不会影响患者的局部复发率,但真空辅助旋切术是将肿物分段切除,对于巨大型肿物的切除效果有待观察,适合于良性肿瘤以及较小叶状肿瘤。
关于辅助放疗的作用的争议一直被关注[17],是由于恶性叶状肿瘤的低发病率以及患者数量较少,对于保乳手术的交界性和恶性叶状肿瘤患者术后辅助放疗能够有效地降低局部复发率,对于总体生存率和无病生存率没有明显差异,但由于大多数为回顾性研究病例较少所以对后续的研究还需要长期随访观察,Abdulmohens 等[18]通过回顾性研究46 例病例中有6 名接受了术后放疗,术后随访未发生转移及复发,证实了辅助放疗在恶性和侵袭性肿瘤中的有益作用。但目前对于辅助放疗没有达成共识,对于交界性及恶性叶状肿瘤术后辅助放疗还需要继续观察研究[19]。
3 小 结
乳腺叶状肿瘤相对乳腺纤维瘤而言临床较罕见,其发病机制目前尚不明确,除年龄、孕产、生活作息关系影响以外,大多认为与雌孕激素波动、内分泌水平紊乱及上皮⁃间质相互干扰有关,临床应结合病史以及影像学进行鉴诊,除常规乳腺彩超外,乳腺核磁对本病的辨别性更敏感,准确的术前诊断对叶状肿瘤进行适当的手术计划并避免局部复发至关重要。2012 年WHO 发布的叶状肿瘤局部复发率分别为:良性10%~17%,交界性14%~25%,恶性 23%~30%[20],年龄、肿瘤类型、肿瘤大小等是术后影响肿瘤复发的主要因素,复发的肿瘤较原发的恶性程度更高、更具有侵袭性,恶性肿瘤可见肺、骨、脑等远处转移。临床上经病理确诊为PT,术后的定期随访以观察局部复发率和远处转移是很有必要的。本例患者虽进行了病灶完整切除,术后6、12 个月复查未见异常,术后每半年定期复查乳腺排除局部复发的概率,加强对本病例的回访,同时通过本病例使得之后的病例得到更有效的诊治。

