恶性脑胶质瘤单放和放化疗临床疗效5 年随诊分析
刘伟
脑胶质瘤(又称脑神经胶质瘤)最主要的临床治疗方法包括手术治疗、外放射治疗和以替莫唑胺和亚硝基脲类为主的化疗[1]。此外,目前还开展的治疗方法包括基因靶向治疗等[2]。年龄低于45 岁,Karnofsky 功能状态评分(KPS)高于70 分、肿瘤全切且能保持良好的神经功能状态等是评价预后的关键因素[2,3]。近年来,外放疗已经成为一种治疗恶性脑胶质瘤的标准化治疗手段,小剂量分割外放疗能够提高疗效,其局限性在于放射量的限制、肿瘤不敏感及副作用等[5]。替莫唑胺等新型化疗药也可以在放化疗联合治疗后继续单独使用,可抑制肿瘤复发,改善患者症状,提高生存质量,而化疗药的不良反应及毒性反应较小。本次研究我们回顾性分析了南开大学附属环湖医院神经外科自 2015 年 10 月至 2016 年 9 月共 99 例恶性脑胶质瘤患者资料,统计所有病例的1、3、5 年生存率及治疗后的急性不良反应和远期损伤,分析恶性脑胶质瘤术后单纯放射治疗、同步放射治疗加化学治疗的临床疗效,现报告如下。
1 资料与方法
1.1 临床资料
回顾性分析了南开大学附属环湖医院神经外科自 2015 年 10 月至 2016 年 9 月共 99 例接受手术治疗的恶性脑胶质瘤患者资料。所有患者入选的标准为经过显微神经外科手术全切除或者大部分切除的并且术后病理组织学证实的Ⅲ级或Ⅳ级脑胶质瘤,其中男性患者69 例,女性患者30 例,年龄为15~68 岁,平均年龄为42.0 岁。患者术前都经过CT 或者MRI 等影像学检查诊断为恶性脑胶质瘤,肿瘤位于幕上的占71 例,位于幕下的占28 例,术后病理证实为Ⅲ级的占80 例,Ⅳ级的占19 例。患者都具有完整的病史及相关的入院常规检查并证实重要脏器如心、肺、骨髓、肝、双肾等无明显异常,而且依照卫生部《中国常见恶性肿瘤诊治规范》中的karnofsky 功能状态评分标准均高于等于50 分,其中 50~70 分的患者占 34 例,高于 70 分的患者占65 例。将所有病例分为两组,两组病例在年龄、性别、肿瘤病理级别、手术切除方式、肿瘤的解剖部位、kps 评分等方面都没有显著的差异,具备可比性。临床资料详见表1。
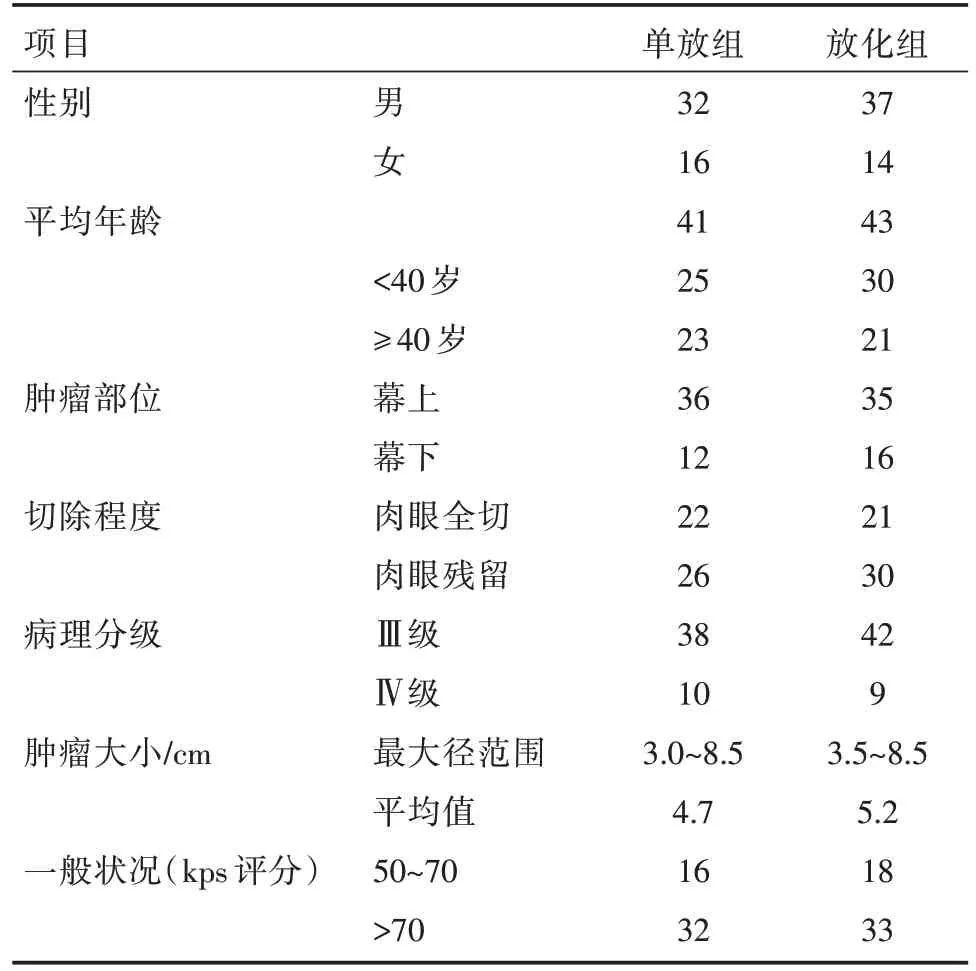
表1 临床资料
1.2 治疗方法
1.2.1 手术治疗 所有的病例均完善相关术前检查,排除手术禁忌,99 例患者均行开颅颅内肿瘤切除术,麻醉方式均为气管插管全身麻醉,手术体位的选择依据影像学检查结果提示的肿瘤部位而定,常规进行碘伏无菌消毒,手术区的皮肤消毒范围为手术切口周围15 cm 区域,如手术中有延长切口的可能,会适当扩大消毒范围,铺无菌巾、铺中单大单,术中的操作为用手术刀依层切开皮肤、皮下组织、帽状腱膜,使用电刀及头皮止血夹进行止血,运用骨膜剥离器将皮瓣剥离,湿水纱布保护好皮瓣,并用头皮拉钩固定,使用线锯锯开颅骨,或使用磨钻钻开颅骨,小心将骨瓣游离,并妥善保存,观察硬膜张力,张力不高可剪开硬膜,并引入神经外科显微镜,将肿瘤与周围正常脑组织仔细分离,并将肿瘤进行分块切除,切除的肿瘤组织送病理科进行检验,然后要完全止血,并且留置一根引流管,对硬脑膜进行严密缝合,使用钛钉钛板或颅骨锁将保存的游离颅骨骨瓣进行复位,然后依次缝合肌肉,皮下及头皮,并保证止血彻底。
1.2.2 放射治疗 所有99 例患者均接受放射治疗,两组患者均在术后20 d 左右开始进行常规放射治疗,每次的放射剂量为2 Gy/天,分30 次,共计60 Gy 的放疗剂量,持续42 天(周六、周日不放疗),采用直线加速器6MV⁃X 线或60 Coγ 射线,靶组织为原肿瘤区域及其周围一般2 cm 左右的区域。放疗过程中,每周进行血常规的检查,并且定期进行颅脑CT 或MRI 检查和肝肾功能的检查。
1.2.3 化学治疗 单纯放射治疗(单放)组不进行化学治疗,同步放射治疗加化疗(放化)组在持续42 天的放疗中同时加用化疗,方案为口服替莫唑胺胶囊75 mg/m2·d,共计42 天,治疗期间,每周进行血常规化验,若绝对白细胞计数大于等于1.5×109/L,血小板计数大于等于100×109/L,普通毒性标准⁃非血液学毒性小于等于1 级(恶心、呕吐、脱发除外),替莫唑胺胶囊可连续口服42 天;若绝对白细胞计数小于1.5×109/L,大于等于0.5×109/L,血小板计数大于等于10×109/L,小于100×109/L,普通毒性标准⁃非血液学毒性为2 级,应该暂停口服替莫唑胺胶囊;若绝对白细胞计数小于0.5×109/L,血小板计数小于10×109/L,普通毒性标准⁃非血液学毒性为3 级或4 级,则应该停止口服替莫唑胺胶囊。随后同步放射治疗加化学治疗期结束后的4 周,接受共计6 个周期的替莫唑胺的辅助治疗,每个周期为28 天,具体为第一个周期口服替莫唑胺胶囊的剂量为 150 mg/m2,每日 1 次,共计 5 天,然后停药23 天。第一个周期结束后第二个周期开始时,进行血常规化验,如若第一个周期的绝对白细胞计数大于等于1.5×109/L,血小板计数大于等于100×109/L,普通毒性标准⁃非血液学毒性小于等于2 级,则剂量可增至每天200 mg/m2。除非发生毒性反应外,之后的各周期的口服剂量均应该维持在每天200 mg/m2。治疗可一直持续到肿瘤病变出现进展,最长治疗时间为2 年。
1.3 随访指标
通过电话随访或门诊就诊等形式获得随访所需指标,包含患者术后至死亡所存活的时间即患者的生存时间,患者经过单纯放射治疗或同步放射治疗加化疗后所产生的恶心、呕吐及骨髓抑制等急性不良反应和听力水平下降、记忆力减退等远期损伤的发生情况以及是否能够通过对症治疗得到缓解。
1.4 统计学处理方法
采用SPSS 19.0 统计软件分析统计数据,生存时间资料通过电话随访或门诊就诊获得,因观察时间较长并且难以控制混杂因素,故其常呈偏态分布,生存率的估计用Kaplan⁃Meier 法即乘积极限法,运用插值法估计两组患者的半数生存期,差异的显著性用Log⁃rank 检验,两组病例的骨髓抑制、恶心、呕吐等急性反应和听力下降、记忆力减退等远期损伤的差异性比较使用卡方检验。
2 结 果
2.1 随访情况
手术治疗后两组全部患者随访满60 个月,死亡的患者绝大多数死于肿瘤的复发,另有5 名患者死于其他系统疾病,如心脏疾病、肺部感染等。
2.2 生存率
1、3、5 年生存率单纯放射治疗(单放)组分别为54.2%、29.2%、10.4%,半数生存期为16.0 个月;同步放射治疗加化疗(放化组)分别为74.5%、51.0%、31.4%,半数生存期为37.2 个月,同步放射治疗加化疗(放化组)的生存率显著高于单纯放射治疗(单放)组(χ2=4.45,P<0.05)(见图1)。
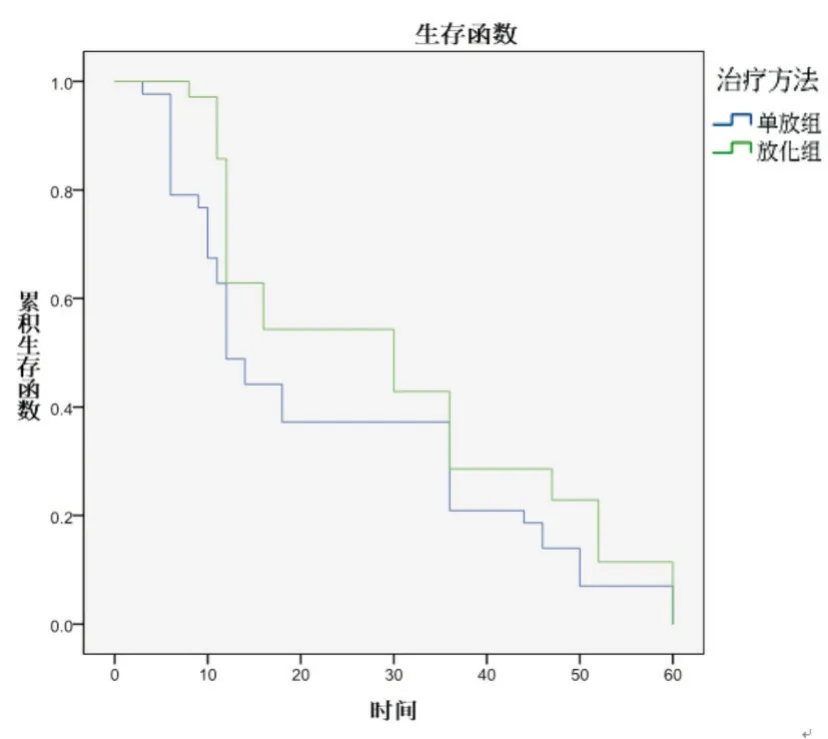
图1 两组患者生存函数比较
2.3 急性不良反应与远期损伤
两组病例的急性不良反应包括骨髓抑制、恶心、呕吐,远期损伤包括听力下降、记忆力减退,通过对症处理症状均得到了缓解,两组患者未出现因为急性不良反应或者远期损伤不能耐受而中止放射治疗或化疗。比较两组病例,急性不良反应中的骨髓抑制的χ2=1.43,P>0.05,恶心呕吐等胃肠道反应的χ2=37.46,P<0.05,放化组的恶心、呕吐等急性不良反应明显加重;骨髓抑制的急性反应两组病例无显著差异性。而远期放射损伤中,两组病例听力水平下降的χ2=1.26,P>0.05,两组病例记忆减退的χ2=0.78,P>0.05,听力水平下降、记忆力减退等远期损伤两组相近。急性不良反应与远期损伤详见表2。
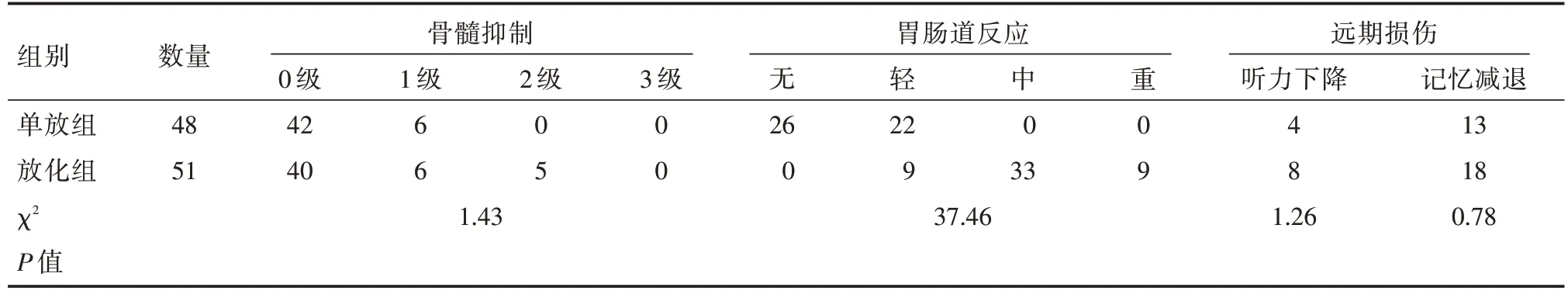
表2 不良反应对比
3 讨 论
恶性脑胶质瘤存在的诸多特性,使其成为当前最难治愈的肿瘤。尽管付出了很多努力,但自2005 年引入辅助替莫唑胺以来,金标准治疗并没有改变;虽然手术技术已经有了显著的改进,从而提高了最大切除肿瘤的安全比率,但预后仍然比较差[7-9]。本组纳入的 99 例病例中,1、3、5 年生存率单放组分别为54.2%、29.2%、10.4%,放化组分别为74.5%、51.0%、31.4%,放化组高于单放组(P<0.05)。随着对恶性胶质瘤的生物学知识的增加,特别是在免疫治疗领域,更多潜在的治疗靶点的发现可能改善恶性脑胶质瘤的治疗效果。
手术切除肿瘤仍是治疗恶性脑胶质瘤的首选治疗方法,但是肿瘤的切除范围没有固定的标准,争议比较大,且是否会对患者预后产生影响仍然没有确切的结论[10],Lacroix 等[11]做的研究显示,肉眼全切的患者(切除程度超过98%)比肉眼残留的患者的中位生存期高出了8.8~13 个月,然而Kreth 等[12]的研究结果则得出了相反的结论,手术切除患者的中位生存期为37 周,而单纯手术活检的患者中位生存期为33 周,两者的差异没有统计学意义。恶性脑胶质瘤的肿瘤边缘往往与正常的脑组织分界模糊不清,手术过程手术者通常凭借自己的个人经验如肿块的色泽、脑沟的深浅、脑回的形状及软硬度、脑血流的供应情况等为重要信息来帮助自己判断肿瘤与正常脑组织的分界线,因而这种人为的判断往往会引起较大的误差,最终导致肿瘤组织细胞仍然存在大量残余而复发,尤其是原发于大脑运动功能区的恶性脑胶质瘤,要想做到手术彻底切除是极其具有挑战性的,而手术切除肿瘤的程度的大小将会直接影响到恶性脑胶质瘤复发的概率,局部残存的大量恶性脑胶质瘤细胞是恶性脑胶质瘤复发最重要的原因。虽然说术后的放化疗能够帮助患者一定程度上消灭残存的肿瘤组织细胞,但肿瘤切除程度将会直接关系患者的生存期的长、生活质量的高低等[11,13,14]。
荧光手术显微系统的诞生为手术全切肿瘤带来希望,能弥补肉眼和磁共振、CT、B 超等影像学手段的不足,使手术者在术中能够清晰地区分出恶性脑胶质瘤组织和其周围正常的脑组织[15,16]。荧光手术显微系统的临床应用,不仅节约了手术的时间,同时使患者的术中感染风险大大降低,而且给患者的预后带来了极大的帮助,降低了患者术后出现神经功能障碍的发生率,延长了患者的生存时间,提高了患者的生活质量,也为患者将要进行的术后放射治疗和化学药物治疗打下了坚实的基础。
恶性脑胶质瘤患者术后采取放疗是有效的辅助治疗措施。目前最主要的放射治疗方法为6~10 MXV 线外照射,它是通过常规分割的方式进行的,即总剂量约为54~60 Gy,分割剂量为1.8~2.0 Gy/次[17]。当今世界领先的放射治疗技术是螺旋断层放射治疗系统,它突出的优势在于可大大增强患者肿瘤区域的放射剂量,并可保护好颅内的脑干、海马等重要的功能神经结构。但是放射治疗仍旧有其局限性,例如它的治疗总剂量是有限的,因为如果治疗剂量超过人体能够承受的放射剂量,将会引起严重的并发症,而人体的易感性使治疗剂量难以把握,本次研究正是将60 Gy 定为患者放射治疗的总剂量。
化疗在治疗恶性脑胶质瘤的疗效上不能够令人满意。治疗恶性脑胶质瘤的化疗药主要包括以卡莫斯汀、尼莫斯汀、洛莫斯汀为代表的亚硝基脲类和以替莫唑胺为代表的烷化剂。近年来抗血管生成类药物成为治疗恶性胶质瘤的重要治疗靶点,其与多疗法联合治疗尚处于临床阶段[22]。本次研究使用的替莫唑胺,它是一种咪唑四嗪类的衍生物,正是恶性脑胶质瘤中间变性星形细胞瘤和多形性胶质母细胞瘤的克星[18]。替莫唑胺可作用于肿瘤细胞细胞周期的各个时相,与放射治疗联合进行可产生互相增强疗效的效果[19-21]。替莫唑胺的毒副作用较少,患者易耐受,但是替莫唑胺也会产生骨髓抑制和恶心呕吐等胃肠道反应,本次研究的患者急性不良反应可耐受,且通过对症治疗能够完全得到缓解。
综上所述,恶性脑胶质瘤的治疗主要包括了手术治疗、放射治疗和化学治疗,每种治疗方法都各有利弊,但是每种治疗方法都对恶性脑胶质瘤患者生存率的提升产生不同程度的作用,本次研究正是以各种治疗方式的优缺点为理论基础,通过对我院99 例接受手术治疗的恶性脑胶质瘤患者的临床随访资料的统计学分析,替莫唑胺作为一种新型烷化剂化疗药物,具有很好的应用前景。

