基于信号肽的β-葡萄糖苷酶的分泌表达
李晓楠 王云 王喆 刘小莉 吴寒 周剑忠 夏秀东




摘要: 为提高大肠杆菌异源表达β-葡萄糖苷酶的底物可及性,本研究以大肠杆菌BL21(DE3)为宿主细胞,使用信号肽OprI、OsmY、PelB、OmpA将纳豆芽孢杆菌的β-葡萄糖苷酶基因bglH锚定到大肠杆菌BL21(DE3)外膜和周质上。然后使用启动子T7、Trc、LacUV5诱导表达Ⅱ型分泌途径的SecB伴侣蛋白,进而实现全细胞催化糖苷型底物水解。本研究通过表征不同细胞定位的β-葡萄糖苷酶活性,发现信号肽PelB分泌效果明显高于其他信号肽,LacUV5启动子与SecB伴侣蛋白组合表达bglH的重组菌株全细胞催化酶活性最高。此外,添加甘氨酸至质量分数为1.0%时,全细胞催化β-葡萄糖苷酶活性最高。并且通过优化诱导条件确定了β-葡萄糖苷酶的最优发酵条件:初始细胞密度(OD600)为1.0,发酵温度为25 ℃,发酵时间为24 h,发酵pH为6.5,最终全细胞催化β-葡萄糖苷酶活性可达2.55 U/ml。
关键词: β-葡萄糖苷酶;分泌表达;信号肽;伴侣蛋白SecB
中图分类号: Q78 文献标识码: A 文章编号: 1000-4440(2022)01-0223-09
Abstract: To enhance the substrate accessibility of heterologous expression of β-glucosidase in Escherichia coli, E. coli BL21 (DE3) was used as the host cell in this study. β-glucosidase related gene (bglH) of Bacillus natto was anchored to the outer membrane and periplasm of E. coli BL21 (DE3) by using different signal peptides (OprI, OsmY, PelB, OmpA). Different promoters (T7, Trc, LacUV5) were used to induce the expression of SecB chaperonin in type Ⅱ secretory pathway to realize the hydrolysis of glycoside-type substrate from the aspect of whole-cell catalysis. Through representation of the activities of β-glucosidase located in different cells, it was found that the secretion effect of signal peptide PelB was obviously higher than other signal peptides, and in the recombinant strain which combined LacUV5 promoter and SecB chaperonin to express bglH, the whole-cell catalytic enzyme activity was the highest. In addition, activity of β-glucosidase was the highest under the condition of whole-cell catalysis when the mass fraction of glycine in the solution was 1.0%. The optimum conditions for β-glucosidase fermentation were determined through optimizing the induction conditions, which were as follows: the initial cell density (OD600) was 1.0, the fermentation temperature was 25 ℃, the fermentation time was 24 h and the fermentation pH was 6.5. Under these conditions, activity of β-glucosidase from the aspect of whole-cell catalysis can reach 2.55 U/ml.
Key words: β-glucosidase;secretory expression;signal peptides;chaperonin SecB
糖苷是天然产物的重要组成成分,具有多种重要的生理活性,有些糖苷通过水解生成苷元(如槲皮素、京尼平和稀有人生皂苷等[1-2]),可以产生更好的药理活性。β-葡萄糖苷酶(BGL)是纤维素类水解酶,可水解末端、非还原性的烃基-β-葡萄糖苷或芳香基-β-葡萄糖苷的β-D-糖苷键,释放出β-葡萄糖和相应的配基[3]。β-葡萄糖苷酶对糖苷的水解有关键作用,工业上通过向糖苷水解系统中添加β-葡萄糖苷酶来提高糖苷的水解效率[4]。糖苷类化合物转化方法包含商品酶催化、微生物转化和酸水解。目前,从植物中很难直接纯化得到大量的β-葡萄糖苷酶,并且纯化蛋白质生产成本高[5],产生β-葡萄糖苷酶能力强的野生型菌株不易获取,而异源表达系统的建立能够有效解决这个问题,该系统反应条件温和、操作简单、成本低、污染少,因此常用基因工程手段进行异源表达,实现外源蛋白质的高效表达,有利于降低生产成本[6]。由于全细胞可保护酶免受外界环境的影响,且无需添加任何辅因子或酶,因此全细胞催化已经逐渐替代粗酶或纯酶广泛应用于目标产物的生物合成中[7]。大肠杆菌具有遗传背景清楚、表达周期短、操作简单、转化效率高等优点,常用于外源蛋白质的表达[8]。但是,由于大肠杆菌缺乏有效的分泌系统、细胞质空间有限,外源蛋白质的大量表达会聚集形成包涵体,而且胞内蛋白质种类多,含量大,破碎后的纯化步骤极易造成目的蛋白质的损失[9-10]。研究结果表明,胞外蛋白质种类和蛋白酶较少,一般情况下可直接纯化得到高纯度、稳定的目的蛋白质[11]。卢俊文[12]将丙酮酸氧化酶基因在大肠杆菌中分别进行胞内和分泌表达,发现丙酮酸氧化酶分泌表达酶活性比胞内表达提高了61%。细胞循环发酵已被证明可以提高菌株生产效率,降低生产成本,通过向发酵罐中連续添加底物可使目标蛋白质分泌表达菌株连续生产[13]。目前工程菌表达的糖苷酶多是胞质酶,但糖苷型底物难以进入胞内与酶结合,因此糖苷酶的可及性差,难以实现全细胞高效催化[14-16]。因此,研究β-葡萄糖苷酶的胞外分泌表达,有利于提高酶和糖苷型底物的可及性,提高全细胞催化效率。
Ⅱ型分泌系统是分泌表达外源蛋白质的常用方法,该系统利用信号肽介导外源蛋白质至周质空间,再透过外膜至培养基中实现分泌[17]。SecB途径是Ⅱ 型分泌途径的一种亚途径,SecB途径通过转运信号肽(PelB、OmpA等)帮助蛋白质定位[18-19]。SecB是一种特殊的伴侣蛋白质,当前体蛋白质被翻译后,含有信号肽的蛋白质前体跨过内膜之前与SecB蛋白结合,阻止前体蛋白质自我折叠,使其转移至周质空间后进行折叠[20]。本研究选用来自枯草纳豆芽孢杆菌B.N.K的具有高异黄酮糖苷水解活性的2个β-葡萄糖苷酶基因bglH(基因ID:64305721)和yckE(基因ID:17139092)为研究对象,将大肠杆菌Ⅱ型分泌途径中的信号肽序列添加到β-葡萄糖苷酶N端,通过测定全细胞蛋白质、胞内蛋白质、周质空间蛋白质的表达量和酶活性衡量β-葡萄糖苷酶跨膜表达效果,除此之外,考察伴侣分子SecB的表达对蛋白质内膜转运的影响,通过添加甘氨酸及优化发酵条件提高β-葡萄糖苷酶的分泌表达,提高β-葡萄糖苷酶与糖苷型底物的可及性,进而实现糖苷型异黄酮向苷元型异黄酮的高效转化。
1 材料与方法
1.1 试验材料
本试验所用的枯草纳豆芽孢杆菌B.N.K菌株由本实验室保存。
1.2 试剂与仪器
试剂:胰蛋白胨、酵母提取物、琼脂、氯化钠、氯霉素、氨苄青霉素、链霉素、丙三醇由南京寿德有限公司生产,基因组提取试剂盒由天根生化科技(北京)有限公司生产;SanPrep柱式质粒DNA小量抽提试剂盒、SanPrep柱式DNA胶回收试剂盒、PCR引物由生工生物工程(上海)股份有限公司生产; DNA Marker,琼脂糖,Taq DNA聚合酶(TaKaRa公司产品);Goldview I 型核酸染色剂由北京索莱宝科技有限公司生产。
仪器:DSX-280B 型压力蒸汽灭菌器由上海申安醫疗器械厂生产; W-CJ-2G型超净工作台、LRH-150型生化培养箱由德国 Sartorius生产;3K15型高速冷冻离心机由美国 Sigma生产; WH-3型漩涡混合仪由上海跃进医疗器械有限公司生产;PCR仪、GelDocEQ 型凝胶成像仪和蛋白质电泳仪由BIO-RAD公司生产;恒温水浴锅由常州国华电器有限公司生产;One Drop OD-2000分光光度计由南京五义科技有限公司生产。
1.3 试验方法
1.3.1 β-葡萄糖苷酶的表达与发酵
1.3.1.1 β-葡萄糖苷酶基因重组质粒的构建 以枯草纳豆芽孢杆菌B.N.K菌株的基因组DNA作为模板,通过同源臂引物bglH-F和bglH-R扩增bglH基因,通过yckE-F和yckE-R扩增yckE基因,引物序列见表1。使用同源重组酶将扩增产物与经Bam HⅠ和NcoⅠ酶切的载体PACYCDuet-1连接,得到重组质粒A-bglH、A-yckE,将重组质粒转化至大肠杆菌BL21(DE3)获得重组菌株,分别命名为BglH、YckE。
1.3.1.2 纳豆芽孢杆菌来源的β-葡萄糖苷酶的定位研究 将50 μl的样品与50 μl 5 mmol/L pNPG在100 mmol/L的磷酸钠缓冲液(pH 6.0)中混合,37 °C下孵育10 min,用Na2CO3终止反应,测量405 nm处的吸光度。1个酶活性的单位定义为1 min释放1 μmol对硝基苯酚的酶量。直接测定得到的发酵液上清液β-葡萄糖苷酶酶活性即为胞外β-葡萄糖苷酶酶活性;将细胞悬浮于200 μl 30 mmol/L Tris-HCl溶液中,冰浴30 min后离心,上清液即为周质空间组分;将离心得到的细胞悬浮于400 μl的25 mmol/L Tris-HCl和150 mmol/L NaCl缓冲液中进行超声破碎,离心取上清液即为细胞质组分;离心得到的不溶物质即为细胞沉淀组分。
1.3.1.3 重组β-葡萄糖苷酶的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测 按照方法1.3.1.2的方法制备不同组分的样品,分别取200 μl的样品,加入等体积的2×SDS上样缓冲液,沸水浴处理10 min,4 ℃ 12 000 r/min离心5 min,取上清液进行SDS-PAGE检测。
1.3.2 不同的信号肽与BglH的融合表达 以A-BglH为模板,用表1中的引物通过PCR的方法将信号肽PelB、OmpA、OprI和OsmY融合到BglH的N端,PCR扩增产物使用限制性核酸内切酶(Dpn Ⅰ)处理1 h后,将胶回收产物进行末端磷酸化,磷酸化产物使用Soution Ⅰ DNA连接酶连接,获得重组质粒A-ompA-bglH、A-oprI-bglH、A-osmY-bglH和A-pelB-bglH,转化至大肠杆菌BL21(DE3)即得重组菌株,分别命名为PelB-BglH、OmpA-BglH、OprI-BglH、OsmY-BglH。按照1.3.1.2和1.3.1.3的方法对其进行酶活性测定以及SDS-PAGE检测。
1.3.3 SecB伴侣蛋白在不同启动子质粒下的表达 将A-pelB-bglH片段和线性化的PACYCDuet-1载体在16 ℃用T4连接酶连接过夜,以获得A-T7-pelB-bglH,通过PCR获得Trc启动子,与线性化的A-pelB-bglH连接获得A-Trc-pelB-bglH。以大肠杆菌BL21(DE3)基因组作为模板,扩增得到secB基因,将其与线性化A-Trc-pelB-bglH质粒在16 ℃下用T4连接酶连接过夜,以获得A-Trc-pelB-bglH-T7-secB。将PCR获得的Trc启动子与线性化A-Trc-pelB-bglH连接获得重组质粒A-Trc-pelB-bglH-Trc-secB,用同样的方法构建重组质粒A-Trc-pelB-bglH-LacUV5-secB。将重组质粒转化至大肠杆菌BL21(DE3)即得重组菌株Trc-PelB-BglH、Trc-PelB-BglH-T7-SecB、Trc-PelB-BglH-Trc-SecB、Trc-PelB-BglH-LacUV5-SecB。按照1.3.1.2的方法对其进行酶活性测定。
1.3.4 甘氨酸对分泌表达的影响 在方法1.3.3的基础上,挑取含有重组A-Trc-pelB-bglH-LacUV5-secB单菌落接种于LB培养基(含50 μg/ml氯霉素抗生素)中,37 ℃ 200 r/min培养过夜。将种子液以1%接种量接种于含氯霉素的LB液体培养基中,在37 ℃ 200 r/min的条件下,培养至初始细胞密度(OD600)达到0.45~0.55时,加入0.1 mmol/L异丙基-β-D-硫代半乳糖苷(IPTG)进行诱导表达,同时加入甘氨酸至最终质量分数分别为0.5%、1.0%、1.5%、2.0%。在25 ℃、100 r/min的条件下诱导24 h后测定全细胞酶活性、全细胞破碎上清液酶活性以及OD600。
1.3.5 发酵条件优化 在方法1.3.4的基础上,研究诱导时初始细胞密度OD600(0.5、0.8、1.0、1.5、2.0)、诱导时间(12 h、18 h、24 h、36 h,添加诱导剂IPTG时为0 h)、诱导温度(15 ℃、20 ℃、25 ℃、30 ℃、35 ℃)以及初始pH(5.5、6.0、6.5、7.0、7.5)对β-葡萄糖苷酶分泌表达的影响。
2 结果与分析
2.1 β-葡萄糖苷酶工程菌的表达
2株重组菌的全细胞蛋白质以及胞外蛋白质的SDS-PAGE结果如图1A所示,重组大肠杆菌BglH和YckE中β-葡萄糖苷酶主要存在于细胞质中,胞外组分中几乎观察不到目标蛋白质。如图1B所示,在细胞质组分中,重组大肠杆菌BglH和YckE的β-葡萄糖苷酶酶活性分别可达到5.33 U/ml和4.17 U/ml。而在发酵液上清液中并未检测到葡萄糖苷酶活性。这一结果表明,重组大肠杆菌BglH、YckE中β-葡萄糖苷酶主要存在于细胞内部,属于胞质酶,并没有分泌到细胞外与糖苷型底物充分结合。對重组大肠杆菌BglH和YckE的破胞粗酶液进行比较,发现重组大肠杆菌BglH的β-葡萄糖苷酶酶活性略高于YckE,可达到12 U/ml,说明重组大肠杆菌BglH的水解糖苷能力高于YckE。 Kuo等[21]也发现BglH在水解糖苷型异黄酮方面比YcKE更加有效,BglH更适用于异黄酮去糖基化。此外,利用上述菌株的粗提液进行全细胞催化,在重组大肠杆菌BglH和YckE中均检测到少量的β-葡萄糖苷酶活力,但是重组大肠杆菌BglH的β-葡萄糖苷酶酶活性略高于YckE,说明重组大肠杆菌BglH更能有效地进行全细胞催化,因此选用BglH进行后续研究。
2.2 不同信号肽对β-葡萄糖苷酶分泌表达的影响
信号肽是辅助前体蛋白质折叠以及前体蛋白质跨膜的重要元件,对于异源蛋白质的分泌表达效率及产量具有重要影响,筛选信号肽可以实现异源蛋白质的高效表达以及提高目的蛋白质的产量[22]。
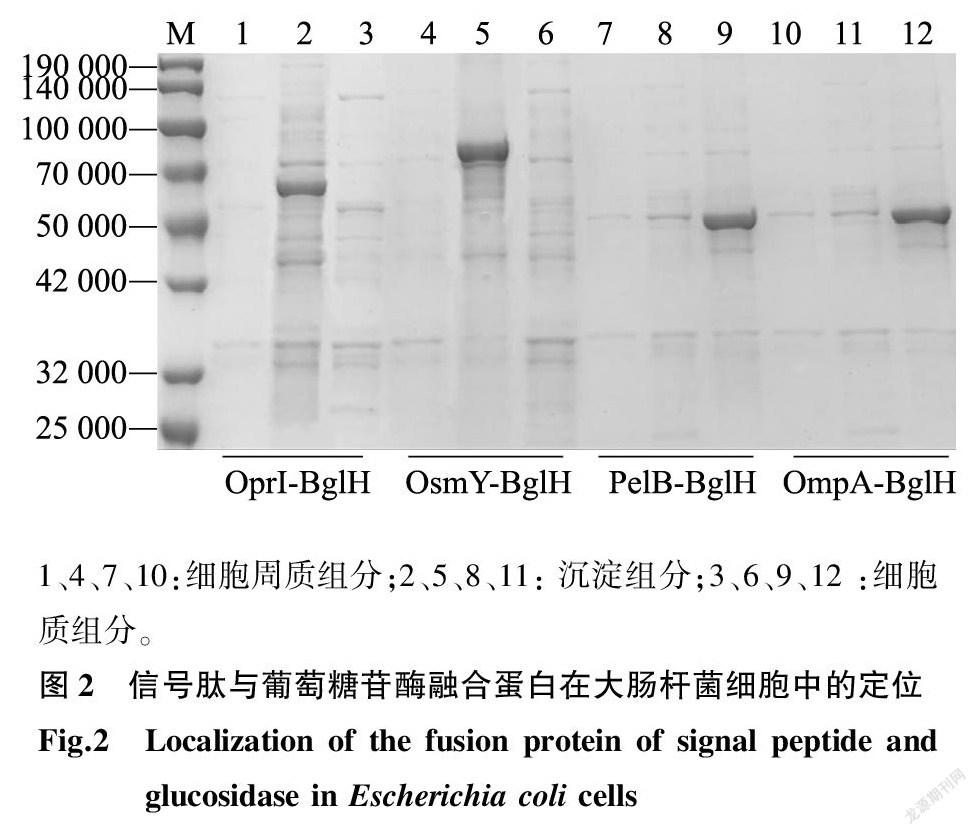
本研究从信号肽OprI、OsmY、PelB、OmpA中进行筛选。如图2所示,融合蛋白OprI-BglH、OsmY-BglH绝大部分在胞内以沉淀的形式存在,泳道2、泳道5的沉淀中大部分为目标蛋白质。这是因为β-葡萄糖苷酶在大肠杆菌中高水平表达时,其表达蛋白会折叠不正确而形成无天然活性的包涵体,从而导致蛋白质无法利用,降低了该酶的产量和利用率[23-24]。而泳道1、泳道4细胞周质组分和泳道3、泳道6细胞质组分中几乎无目标蛋白质。融合蛋白PelB-BglH、OmpA-BglH多以可溶状态存在,主要存在于细胞质组分中,在细胞周质中观察到少量目标蛋白质。
以未与信号肽融合表达的BglH菌株作为对照,对不同的信号肽OprI、OsmY、PelB、OmpA与BglH共表达的重组菌株各组分的酶活性进行测定,如图3A所示,信号肽OprI、OsmY表达后在细胞周质和发酵液上清液中未检测到葡萄糖苷酶活性,说明OprI、OsmY的表达并未将葡萄糖苷酶锚定到膜上与底物之间进行充分结合。沙冲[25]将OsmY与脂肪酶融合表达,经过细胞定位分析,发现该融合蛋白存在于细胞质中,而非定位于细胞表面或分泌到细胞外,说明OsmY信号肽的适用蛋白需要进一步甄别。如图3B所示,由OprI、OsmY与BglH共表达后的全细胞催化酶活性远低于对照组,根据图2的电泳结果推测这2个信号肽形成了包涵体,从而导致酶活性下降。对于信号肽PelB、OmpA与BglH共表达的重组菌株,细胞质组分中的酶活性均有下降,且在细胞周质和发酵液上清液中都检测到了较低的葡萄糖苷酶活性,这说明PelB、OmpA的表达能使β-葡萄糖苷酶分泌到细胞周质中,进一步分泌到细胞外。如图3B所示,全细胞催化的结果与对照组相比,信号肽PelB和OmpA与BglH共表达的菌株进行全细胞催化后酶活性明显提高。Wang等[26]利用PelB天然信号肽分泌表达内切菊糖酶,其酶活性可达到75.22 U/mg。Yamabhai等[27]发现大肠杆菌外膜蛋白OmpA能够提高重组蛋白在大肠杆菌表达系统中的分泌效率,实现了α-淀粉酶、甘露聚糖酶以及壳多糖酶的胞外分泌表达量。李琦等[28]同样发现信号肽PelB和OmpA的表达可提高重组蛋白的可溶性表达量。图3A显示,PelB表达的菌株细胞周质中酶活性明显高于OmpA。如图3B所示, PelB-BglH对于底物pNPG的催化效率最高,发酵24 h后酶活性可达0.98 U/ml,因此信号肽PelB的共表达能够使酶更高效地分泌表达。
2.3 不同启动子表达伴侣蛋白SecB对BglH分泌表达的影响
启动子是基因转录调控的重要表达元件,筛选强启动子能够明显提高异源基因的转录水平[29]。如图4A所示,使用Trc启动子的重组菌株在细胞周质中β-葡萄糖苷酶活性稍高,全细胞催化的β-葡萄糖苷酶活性能达到1.23 U/ml。因此选用Trc启动子实现信号肽PelB与BglH融合表达进行下一步试验。据报道SecB伴侣蛋白有利于Ⅱ型分泌系统信号肽的分泌表达[30] ,由于Trc启动子表达的PelB-BglH菌株全细胞催化酶活性仍然低于细胞质组分,考虑通过伴侣蛋白SecB提高外源蛋白质的分泌效率。
为了进一步提高伴侣蛋白SecB的表达效率,本研究选用T7、Trc、LacUV5启动子表达伴侣蛋白SecB。如图4B所示,T7启动子与伴侣蛋白SecB共表达后的重组菌株中各组分的糖苷酶活性均比对照组低。这可能是因为伴侣蛋白SecB的过量表达是大肠杆菌细胞的负担,导致包涵体形成的增加,降低β-葡萄糖苷酶活性[31]。而Trc启动子和LacUV5启动子与伴侣蛋白SecB共表达的菌株细胞质酶活性均有一定程度的降低,细胞周质中β-葡萄糖苷酶活性有所提升,这表明Trc启动子和LacUV5启动子与伴侣蛋白SecB共表达使得β-葡萄糖苷酶能更好地从胞内向胞外转移,与糖苷型底物更充分地结合。将上述菌株进行全细胞催化,LacUV5启动子与SecB的组合表达后全细胞催化酶活性最高,可达2.02 U/ml,因此选用A-Trc-PelB-BglH-LacUV5-SecB可进行下一步的表达优化。由于伴侣蛋白有利于异源蛋白质分泌,但是伴侣蛋白的过量表达会对重组大肠杆菌造成负担,因此有必要对不同的异源蛋白质和伴侣蛋白进行分析研究。Lu等[32]选用3个启动子(T7、lac、bla)共表达伴侣蛋白SecB来实现丙酮酸氧化酶的细胞外表达,与T7和Lac启动子相比,弱启动子bla提供了最佳的细胞外丙酮酸氧化酶活性。
2.4 甘氨酸对β-葡萄糖苷酶表达分泌的影响
酶的分泌表达不仅受酶的表达效率的影响,还与细胞膜的通透性有关,若不能及时分泌到胞外,就会造成累积,从而堵塞分泌通道[33]。通过添加甘氨酸破坏重组大肠杆菌细胞壁和Cu2+作为bglH稳定剂,使周质空间的外膜蛋白渗透至胞外,可以进一步提高重组蛋白质分泌表达量[34]。
添加甘氨酸对大肠杆菌A-trc-pelB-bglH-lacUV5-secB细胞密度和β-葡萄糖苷酶活性的影响如图5所示。由图5A可知,甘氨酸对细胞生长具有显著的负面影响,随着甘氨酸含量的增加,菌体浓度降低,这可能是因为甘氨酸对细胞生长具有一定的毒害作用[34]。从图5B可知,甘氨酸的添加对细胞质中β-葡萄糖苷酶活性也有负面影响,细胞质的酶活性随着甘氨酸质量分数的增加呈现下降的趋势。而全细胞催化酶活性随着甘氨酸质量分数的增加呈现先上升后下降的趋势,甘氨酸质量分数为1%时酶活性最高,可达到2.24 U/ml。细胞外的β-葡萄糖苷酶活性的提高证明了甘氨酸对蛋白质渗漏的影响,与前期优化甘氨酸以实现蛋白质渗漏的研究结果类似[35]。
2.5 重组表达菌株培养条件优化
分子水平的操作可以提高β-葡萄糖苷酶的细胞外分泌表达产量,优化培养条件也可以提高β-葡萄糖苷酶的胞外分泌量[35]。本研究通过对诱导表达过程中初始菌体密度、诱导时间、诱导温度以及初始pH进行优化,进一步提高胞外分泌量。
大肠杆菌 A-trc-pelB-bglH-lacUV5-secB在不同初始细胞密度(OD600)下诱导后的生长曲线以及全细胞β-葡萄糖苷酶活性变化如图6A所示,细胞初始密度(OD600)为0.4~1.6时,β-葡萄糖苷酶酶活性显著增加,而在细胞初始密度大于1.5后β-葡萄糖苷酶酶活性保持相对稳定。随着初始细胞密度的增加,全细胞酶活性整体表现为先缓慢上升后迅速下降,在初始细胞密度(OD600)为1.0时进行诱导,发酵24 h后全细胞酶活性最高,达到2.31 U/ml,初始细胞密度大于1.0之后进行诱导不利于β-葡萄糖苷酶的分泌表达,说明诱导时机过晚比过早对表达的影响更大[36]。杨涛等[33]也发现诱导时菌体生长时期会对蛋白质的表达和分泌造成影响,他们考察了诱导时菌体OD600对多铜氧化酶在大肠杆菌中分泌的影响,结果表明当OD600=1时,多铜氧化酶胞内、胞外酶活性均为最高。由图6B可知,发酵24 h后重组大肠杆菌A-Trc-PelB-BglH-LacUV5-SecB的终细胞密度随着诱导时间的增加上升,而全细胞催化酶活性随着诱导时间的延長呈现先上升后下降的趋势,诱导时间为24 h时,全细胞β-葡萄糖苷酶活性最高,可达2.52 U/ml。图6C显示了诱导温度对重组大肠杆菌A-Trc-PelB-BglH-LacUV5-SecB的细胞密度以及β-葡萄糖苷酶活性的影响,总体而言,在20~35 ℃获得高细胞密度,诱导温度为25 ℃时,β-葡萄糖苷酶活性最高,且较高温度和较低温度均不利于β-葡萄糖苷酶的胞外表达。这是因为诱导温度是影响蛋白质表达的一个重要因素,温度过高会形成包涵体,温度过低会造成外源基因表达不足[37]。诱导期的初始pH对大肠杆菌A-Trc-PelB-BglH-LacUV5-SecB的细胞密度和β-葡萄糖苷酶活性有显著影响(图6D)。在pH为5.5~7.5时β-葡萄糖苷酶的全细胞催化酶活性先上升后下降,初始pH为6.5时,全细胞催化酶活性最高,达到2.55 U/ml, 且pH为6.0~7.5时能够保持较高酶活性,这与何成等[38]的研究结果一致。因此通过优化诱导条件确定β-葡萄糖苷酶的最优发酵条件为,初始细胞密度(OD600)=1.0,诱导时间为4 h,初始pH为6.5,诱导温度为25 ℃。
3 结论
本研究以β-葡萄糖苷酶BglH为模式酶,结合信号肽结构特点对大肠杆菌Ⅱ型分泌系统中4种信号肽进行筛选,发现在N端融合PelB实现了β-葡萄糖苷酶BglH在大肠杆菌中的胞外分泌表达。并使用4种不同的启动子调控伴侣蛋白SecB的表达,提高信号肽PelB对β-葡萄糖苷酶BglH的分泌效率。此外,通过添加甘氨酸以及优化培养条件,进一步提高β-葡萄糖苷酶全细胞催化活性,进而提高其与糖苷型底物的可及性,使其转化为具有更高利用效率的苷元型物质。
参考文献:
[1] 原 野,胡彦波,周义发,等. 糖苷水解酶-生物转化制备活性糖苷与苷元的有效工具[J].微生物学报,2017,57(8):1219-1234.
[2] ZHAO Y, KANG L P, LIU Y X, et al. Steroidal saponins from the rhizome of Paris polyphylla and their cytotoxic activities[J]. Planta Medica, 2009, 75(4): 356-363.
[3] PAVEL V, VOLKOV A M, ROZHKOVA I N, et al. Cloning, purification and study of recombinant GH3 family β-glucosidase from Penicillium verruculosum[J]. Biochimie,2020,168(1):231-240.
[4] 朱龙宝,汤 斌,陶玉贵,等. 黑曲霉β-葡萄糖苷酶基因克隆及在毕赤酵母中分泌表达[J].食品与生物技术学报,2012,31(9):973-977.
[5] 何 成,吴 言,孟春雨,等. 新型β-葡萄糖苷酶BglD2异源表达及水解虎杖苷能力[J].生物工程学报,2021,37(2):580-592.
[6] 蔡小雨,闫培生,高秀君,等. 人参皂苷生物转化的研究进展[J].中国农业科技导报,2018,20(4):52-60.
[7] 徐春英. 高效分泌表达耐热性β-葡萄糖苷酶工程菌的构建[D].南京:南京师范大学,2013.
[8] HABIMANA,乔郅钠,徐美娟,等. 重组谷氨酸棒杆菌全细胞催化一步法合成高果糖浆[J].食品与发酵工业,2021(6): 1-9.
[9] THOMAS JG, AYLING A, BANEYX F. Molecular chaperones, folding catalysts, and the recovery of active recombinant proteins from E. coli to fold or to refold[J]. Appl Biochem Biotechnol,1997,66(3):197-238.
[10]王培立,王 平,田 健,等. 芽胞杆菌高效分泌表达异源蛋白的研究进展[J].生物技术进展,2015,5(2):95-102.
[11]张 伟. 谷氨酸棒杆菌外源蛋白分泌表达系统的开发及其应用研究[D].无锡:江南大学,2019.
[12]卢俊文. 丙酮酸氧化酶在大肠杆菌中的胞内表达及分泌表达的研究[D].上海:上海理工大学,2019.
[13]SCHLUESENER D, FISCHER F, KRUIP J, et al. Mapping the membrane proteome of Corynebacterium glutamicum[J]. Proteomics,2005, 5(5):1317-1330.
[14]刘艺婷. 淀粉分支酶在大肠杆菌中的分泌表达及其分子改造研究[D].无锡:江南大学,2017.
[15]丁小娟. 嗜酸乳杆菌β-葡萄糖苷酶及其与槲皮素糖苷底物作用研究[D].贵阳:贵州大学,2019.
[16]崔世修. 黑曲霉胞内β-葡萄糖苷酶的酶学性质研究[D].郑州:河南农业大学,2016.
[17]MERGULHO F J, SUMMERS D K, MONTEIRO G A, et al. Recombinant protein secretion in Escherichia coli[J]. Biotechnol Adv,2005,23(3):177-202.
[18]KHOKHLOVA O V, NESMEIANOVA M A. Interaction of SecB and SecA with the N-terminal region of mature alkaline phosphatase on its secretion in Escherichia coli[J]. Mol Biol (Mosk),2003,37(4):712-718.
[19]黃 磊,谢玉娟,李 申,等. 纳豆激酶基因的克隆及其在大肠杆菌和枯草芽孢杆菌中的表达[J].食品科学,2007(5):199-202.
[20]YAMABHAI M, EMRAT S, SUKASEM S, et al. Secretion of recombinant Bacillus hydrolytic enzymes using Escherichia coli expression systems[J]. Journal of Biotechnology,2008,133(1):50-57.
[21]KUO L C, LEE K T. Cloning, expression, and characterization of two beta-glucosidases from isoflavone glycoside-hydrolyzing Bacillus subtilis natto[J]. J Agric Food Chem,2008,6(1):119-25.
[22]YAO D, SU L, LI N. Enhanced extracellular expression of Bacillus stearothermophilus α-amylase in Bacillus subtilis through signal peptide optimization, chaperone overexpression and α-amylase mutant selection[J]. Microb Cell Fact,2019,18(1):69.
[23]张 瑶. β-葡萄糖苷酶分泌表达型乙醇发酵E.coli工程菌的构建[D].上海:华东理工大学,2013.
[24]KAWAKAMI Y, TSURUGASAKI W, NAKAMURA S. Comparison of regulative functions between dietary soy isoflavones aglycone and glucoside on lipid metabolism in rats fed cholesterol[J]Nutr Biochem,2005,16(4): 205-212.
[25]沙 冲. 华根霉(Rhizopus chinensis)脂肪酶在异源宿主中的高效分泌表达[D].无锡:江南大学,2015.
[26]WANG P, MA J, ZHANG M, et al. Efficient secretory overexpression of endoinulinase in Escherichia coli and the production of inulooligosaccharides [J]. Applied Biochemistry and Biotechnology, 2016,179(5): 880-894.
[27]YAMABHAI M, EMRAT S, SUKASEM S, et al. Secretion of recombinant Bacillus hydrolytic enzymes using Escherichia coli expression systems[J], Journal of Biotechnology, 2008,133(1): 50-57.
[28]李 琦,童欣怡,蒋玉洁,等. 全细胞催化剂pelB-Xln-DT构建及其在水解三七皂苷R1中的应用[J].林业工程学报,2020,5(4):114-120.
[29]SONG Y F, NIKOLOFF J M, FU G. Promoter screening from Bacillus subtilis in various conditions hunting for synthetic biology and industrial applications[J]. PLoS One, 2016, 11(7):e0158447.
[30]周 颖,张 青,殷长传,等. 分子伴侣 SecB 基因和人淋巴毒素基因在大肠杆菌中的共表达[J].生物工程学报,1997,13(4):433-436.
[31]JIA Q, LUO Y. The selective roles of chaperone systems on over-expression of human-like collagen in recombinant Escherichia coli[J]. J Ind Microbiol Biotechnol,2014,41(11):1667-1675.
[32]LU J, ZHANG J. Extracellular expression of Aerococcus viridans pyruvate oxidase in recombinant Escherichia coli through SecB co-expression[J]. J RSC Advances,2019,9(45): 26291-26301.
[33]楊 涛,陈 坚,方 芳. 多铜氧化酶在大肠杆菌中的分泌表达[J].过程工程学报,2020,20(10):1210-1217.
[34]BAO R M, YANG H M, YU C M, et al. An efficient protocol to enhance the extracellular production of recombinant protein from Escherichia coli by the synergistic effects of sucrose, glycine, and Triton X-100[J]. Protein Expr Purif,2016, 126(10):9-15
[35]OLUSESAN A T, AZURA L K, ABUBAKAR F. Enhancement of thermostable lipase production by a genotypically identified extremophilic Bacillus subtilis NS 8 in a continuous bioreactor[J]. J Mol Microbiol Biotechnol,2011,20(2):105-115.
[36]周 勇,徐 刚,杨立荣,等. 信号肽优化在枯草芽孢杆菌体系中对脂肪酶LipS分泌表达的影响[J].中国生物工程杂志,2015,35(9):42-49.
[37]李海军, 王林刚,王治泽,等. 枯草杆菌脂肪酶基因在大肠杆菌中的诱导分泌表达[J].生物技术通报, 2010,26(3): 90-94.
[38]何 成,吴 言,孟春雨. 新型β-葡萄糖苷酶BglD2异源表达及水解虎杖苷能力[J].生物工程学报,2021,37(2):580-592.
(责任编辑:陈海霞)
1514501186312

