毛囊黏蛋白病1例
杨海潮,宋志强,张 恋,黄 慧
(重庆陆军军医大学第一附属医院皮肤科,重庆 400038)
1 临床资料
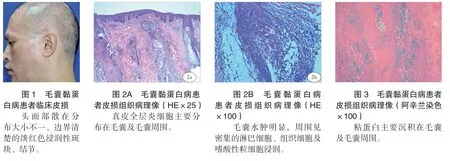
患者男,36岁。因头面部皮疹2月余就诊。患者于2020年8月发现头面部出现大小不一的红斑,无自觉症状,未引起重视,后皮损逐渐增大。家族成员中无类似疾病史。体格检查:一般情况好,系统检查未见明显异常。皮肤科情况:头面部可见散在的大小不一的边界清楚的淡红色斑块、结节,质较硬,部分表面隆起呈胶稠状,表面无毛发,无糜烂,无压痛(见图1)。自身抗体谱阴性。组织病理检查示:表皮灶状角化不全,棘层增生肥厚,真皮全层血管周围散在或小片状的淋巴细胞及组织细胞浸润,毛囊水肿明显,有较多黏蛋白沉积,周围可见密集淋巴细胞、组织细胞及嗜酸性粒细胞浸润(见图2A、2B)。阿辛兰染色:毛囊及毛囊周围可见粘蛋白沉积(见图3)。直接免疫荧光阴性。免疫组化:CD3、CD4、CD5、CD7、CD8阳性,CD20部分阳性,CD68阴性,Ki67约5%细胞阳性(见图4A、B、C、D、E、F、G、H)。符合毛囊粘蛋白病(头皮)。
诊断:毛囊黏蛋白病。
2 讨论
毛囊黏蛋白病(Follicular Mucinosis,FM)是一种临床较少见的慢性炎症性皮肤病,以酸性黏多糖聚集在毛囊(毛囊外根鞘和皮脂腺) 内为其特征,本病由Pinkus于 1957年首次以黏蛋白脱发报道本病,但此病并非都有脱发,于1959年Jablonska等提出以毛囊黏蛋白病命名。据研究,FM 与各种全身性疾病相关,包括血液系统恶性肿瘤、造血干细胞移植 (HSCT) 和其他恶性和良性皮肤病、HIV等均有相关报道[1]。该病发病机制不明,毛囊角质形成细胞被假定为粘蛋白的来源,可能与细胞介导的免疫反应有关,也可能是一种非特异性的毛囊反应,或者是毛囊周围的T淋巴细胞释放细胞因子刺激毛囊上皮分泌黏蛋白所致。
本病可发生于任何年龄段,有报道最小发生于4岁[2],男女均可发病,无明显性别差异,皮疹好发于头、面部、颈部,也可见于躯干四肢,多局限分布,无自觉症状,可伴有感觉异常、瘙痒、麻木等。典型皮疹特征是具有光泽的淡红色或肤色毛囊性丘疹,或带鳞屑的红色浸润性斑块或结节,其上毛囊显著,可有不同程度毛发脱落,也可表现为多种形式:痤疮、湿疹、囊肿、结节等[3]。也可在病灶周围出现无症状的低色素病变[4]。
FM 可分为原发性良性(或特发性)和继发性,可能与炎症或恶性肿瘤相关,最常见的为蕈样肉芽肿(Mycosis fungoides,MF)[5]。本病按临床经过又可分为 3种类型:① 急性良性型:临床相对常见,好发于较年轻患者,皮损多局限于头、颈、 上肢等部位,一般2个月至 2年自行消退。本型无皮肤外表现。②慢性良性型:好发于年龄较大患者,少见,皮损较大较多,分布较广泛,形态亦多种多样.可反复出现或持续数年。③ 淋巴瘤相关型:多见于成年人,最常见的恶性肿瘤是皮肤 T细胞淋巴瘤,以 MF最多见。有学者认为FM 可能与血液系统恶性肿瘤和造血干细胞移植相关联,但不一定是T细胞淋巴瘤前兆[6],Mir-Bonafé等学者认为FM 是一种反应性组织学模式,与皮肤T细胞淋巴瘤无关[1]。原发性与淋巴瘤相关型FM早期组织学特征相似,前者以头部/颈部的单发病变居多,而后者以头部/颈部区域以外的身体区域呈现多个病变[7],粘蛋白被证明是一种真皮型粘蛋白,由透明质酸和硫酸化糖胺聚糖组成。原发性或继发性FM中滤泡粘蛋白的组成没有差异,但良性型组织病理通常为毛囊间隙中充满黏蛋白,附属器周围轻度淋巴细胞浸润,无亲表皮性和轻微的血管周围和附件周围多克隆浸润,免疫组化CD4+与CD8+细胞正常表达。淋巴瘤相关型组织病理表现为异型淋巴细胞密集带状浸润和亲表皮性,免疫组化以CD4+淋巴细胞为主和浸润的单克隆重排[8]。本例患者组织病理经反复阅片,无淋巴细胞亲表皮现象及异型淋巴细胞,暂排除淋巴瘤相关型,但良性型和淋巴瘤相关型之间鉴别并没有单一的、无可争议的诊断标准,区分这两种形式具有挑战性,因为它们具有许多重叠的特征,鉴别诊断需要将临床、组织病理、免疫组化和分子研究等一起评估和关联。所以对于良性型,特别是慢性良性型和儿童期发病的FM应注意长期随访[4],必要时定期进行组织病理学检查对病情发展进行监控。同时患者自身抗体谱、直接免疫荧光阴性,故也不支持红斑狼疮的诊断。
目前本病尚无特效治疗方法,避免过度诊断和过度治疗,建议长期随访观察[9]。有些皮疹可自行消退。可选择糖皮质激素局部外用或皮损内注射,或者口服低剂量糖皮质激素、异维 A酸、氨苯砜、米诺环素、硫酸羟氯喹等治疗,可有不同程度的疗效。本例患者未规律使用药物治疗,皮疹无明显缓解,半年后失访。

