中华绒螯蟹三龄群体的生物学可塑性初探
彭飞,方弟安,周彦锋,唐永凯,徐东坡,刘凯,苏胜彦,尤洋,*
(1.南京农业大学渔业学院,江苏 无锡 214081;2.中国水产科学研究院淡水渔业研究中心,江苏 无锡 214081)
中华绒螯蟹(Eriocheir sinensis)的生活史具有生态可塑性,生活史缩短的性早熟现象并不鲜见[1];在资源调查中,发现长江自然繁殖洄游群体中有零星未成熟个体现象。2005 年,史为良[2]在东北黑龙江虾蟆通水库(46°30′62″N,132°50′48″E,7 月水温21.6 ℃)中发现有批量大规格中华绒螯蟹产出,认为是三龄性成熟蟹,并提出性成熟受温度阈值制约的假设。在自然繁殖季节中,发现青海省可鲁克湖(海拔2 817 m)等草型湖泊的繁殖群体存在一定比例的二龄未成熟群体。高纬度和高海拔区域条件都会使中华绒螯蟹晚熟的比例较长江流域明显增加,有利于批量收集和后续利用。
水产动物的生长性能和可食组织中的营养组成是种质资源评价和遗传选育中的重要评价指标[3]。在长江、辽河、黄河和闽江[4−8]等中华绒螯蟹主要产地水域中,其生长性能和营养组成均存在差异,不同的养殖方式对于其成熟后的规格和营养品质也会造成影响[9]。本研究中,中华绒螯蟹三龄蟹的生活史,包含了历经高原湖泊冰封期的低温胁迫以及返回长江流域池塘生长后的夏季高温期,既有地理位置的变更,又有养殖方式的改变。对于水产动物而言,水体温度是影响生长发育的重要环境因素。水温的变化直接干扰着中华绒螯蟹胚胎、幼蟹的发育[10]。例如,水体积温升高会导致中华绒螯蟹蟹种更易性早熟[11]。而处于低温胁迫下的水产动物会发生滞育,等待温度正常时恢复生长,从而提高成活率[12−13]。最适宜中华绒螯蟹生长的温度为28~30 ℃[11],可鲁克湖夏季水温不超过20 ℃,湖中的中华绒螯蟹存在着明显的发育停滞阶段。已有研究证实,由于环境胁迫而发生滞育的水产动物,待恢复正常的生长条件后,会出现不同程度的补偿生长现象[14]。
此前研究聚焦于不同区域、不同养殖模式的中华绒螯蟹正常成熟和性早熟群体,缺乏对性晚熟群体的关注和系统研究。因此,本研究旨在验证三龄性晚熟蟹在人工培育条件下的可利用性,并描述分析其生长性能、繁殖力和营养成分特征,为其后续的选育和进一步研究等积累种质资源。
1 材料与方法
1.1 人工培育三龄蟹的获得和采样
青海省可鲁克湖(草型湖泊)所投放的中华绒螯蟹大眼幼体来源于江苏沿海土池育苗;翌年9 月大部分成熟,开始捕捞上市,其中有二龄未成熟群体的存在(超过10%)。本实验所使用的蟹种为第3年4 月在湖中收集的未成熟个体(二冬龄),重新运回江苏省,在中国水产科学研究院淡水渔业研究中心扬中基地于4—12 月养殖获得中华绒螯蟹三龄蟹。在每次实际观察到蜕壳完成后1周采集雌雄蟹各5只,分别统计形态学指标。在鲜样状态下,擦干中华绒螯蟹体表水分,称量(电子天平,精确到0.01 g);采用游标卡尺测量其形态规格,精确到0.01 mm。并与同一基地养殖的长江蟹(常规蟹)作对比。在性成熟后取鲜样(雌雄蟹各5只)进行营养成分分析。
养殖三龄群体的蟹种阶段历经了北方高原湖泊2 个冬季的冰封期,成蟹阶段又经历了南方的1个夏季高温期,生活史较为复杂(图1)。

图1 中华绒螯蟹三龄群体生活史示意图Fig.1 Life cycle diagram of the third-year-old population of Chinese mitten crab
1.2 生长指标分析方法
测量三龄雌雄蟹的头胸甲长、头胸甲宽、体高和体质量,计算增重率(weight gain rate,WGR)、特定增长率(specific growth rate,SGR),并绘制成图;使用FISAT Ⅱ软件中的电子体长频率分析法(electronic length frequency analysisⅠ,ELEFANⅠ)拟合Von Bertalanffy 生长方程,对中华绒螯蟹渐进头胸甲宽(L∞)、生长参数(K)和理论生长起点(t0)进行估算,模拟头胸甲宽与体质量(W)之间的关系。
1.3 营养成分组成分析方法
氨基酸含量测定采用6 mol/L盐酸水解法(参考GB/T 5009.124—2016),用Agilent 1100 高效液相色谱仪检测17种氨基酸(色氨酸在水解过程中受到破坏,未被检测出);使用气相色谱仪检测分析脂肪酸含量(参考GB/T 5009.168—2016);采用微波消解法对矿质元素进行前处理,消解完成后采用火焰原子吸收光谱仪测定矿质元素含量[15]。
1.4 数据处理与分析
数据经Excel 2019初步处理后,采用SPSS 26.0进行统计分析,采用独立样本t检验分析不同性别间的差异性,运用方差分析确定不同特征指标差异性。结果以平均值±标准差表示,以P<0.05表示差异有统计学意义,P<0.01 表示差异有高度统计学意义。使用Origin 2017绘图。
2 结果与分析
2.1 三龄蟹的生长性能
2.1.1 主要生长参数
对青海省可鲁克湖区的二龄蟹种、三龄成蟹,池养三龄蟹以及对照池塘常规蟹的形态学指标进行测量,结果如表1 所示。池养三龄蟹在2018 年5月处于蟹种阶段,12月为成蟹,养殖期间共观察到4次蜕壳。三龄蟹蜕壳时生长速率较快,在8 月观察到最后一次蜕壳后,到12 月起捕,其体质量差异极显著(P=0.006)。
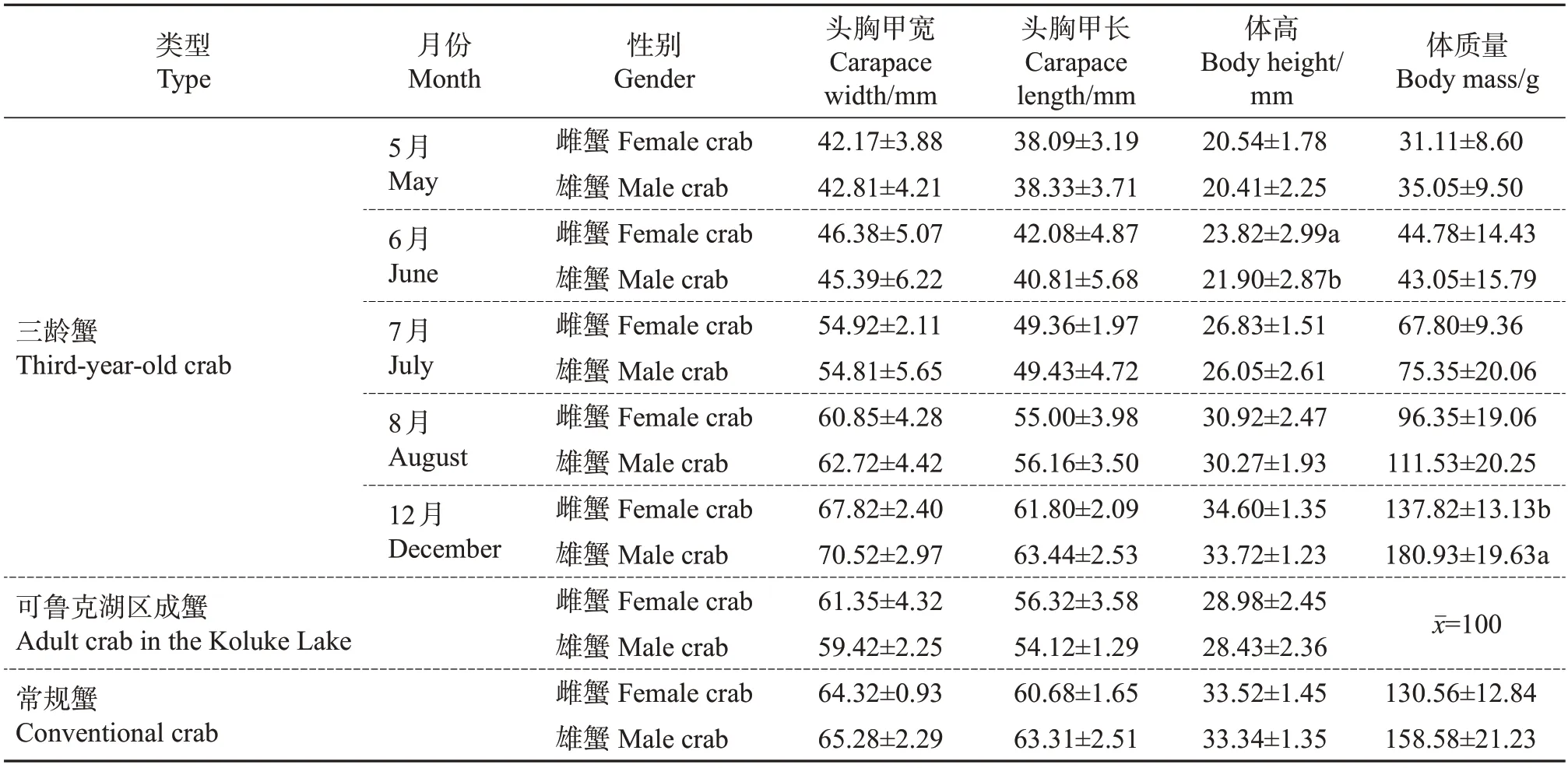
表1 不同中华绒螯蟹群体的形态学指标(2018年)Table 1 Morphological indexes of different populations of Chinese mitten crab in 2018
增重率与特定增长率的变化趋势相似(图2),三龄蟹在池塘养殖阶段的生长有明显的加速期和平缓期,但雌、雄蟹的生长高峰期略有不同,雄蟹的增长峰值出现在6—7 月,增重率为73.73%,雌蟹则出现在5—6 月,增重率为71.80%。雄蟹平均特定生长率为1.09%,雌蟹为1.11%。而在徐佳倩等[16]的研究中,池塘养殖的二龄雄蟹在6—7月(夏季高温)时的生长明显减缓。与长江下游养殖常规蟹[16]和东营池塘养殖蟹[17]相比,三龄蟹的平均特定生长率较低。同时,三龄蟹群体与常规蟹的形态特征指标无显著差异。

图2 三龄蟹的增重率和特定生长率Fig.2 Weight grain rate and specific growth rate of the third-year-old crab
2.1.2 头胸甲宽-体质量拟合曲线
对三龄蟹头胸甲宽与体质量的关系进行曲线拟合(图3)。雌、雄蟹的头胸甲宽与体质量拟合的幂函数的幂指数(b值)均大于3,说明三龄蟹的生长为正异速增长,体质量的生长优于头胸甲宽的生长。拟合结果显示,三龄蟹的头胸甲宽−体质量呈指数相关,符合中华绒螯蟹形态的普遍特征[18−19]。
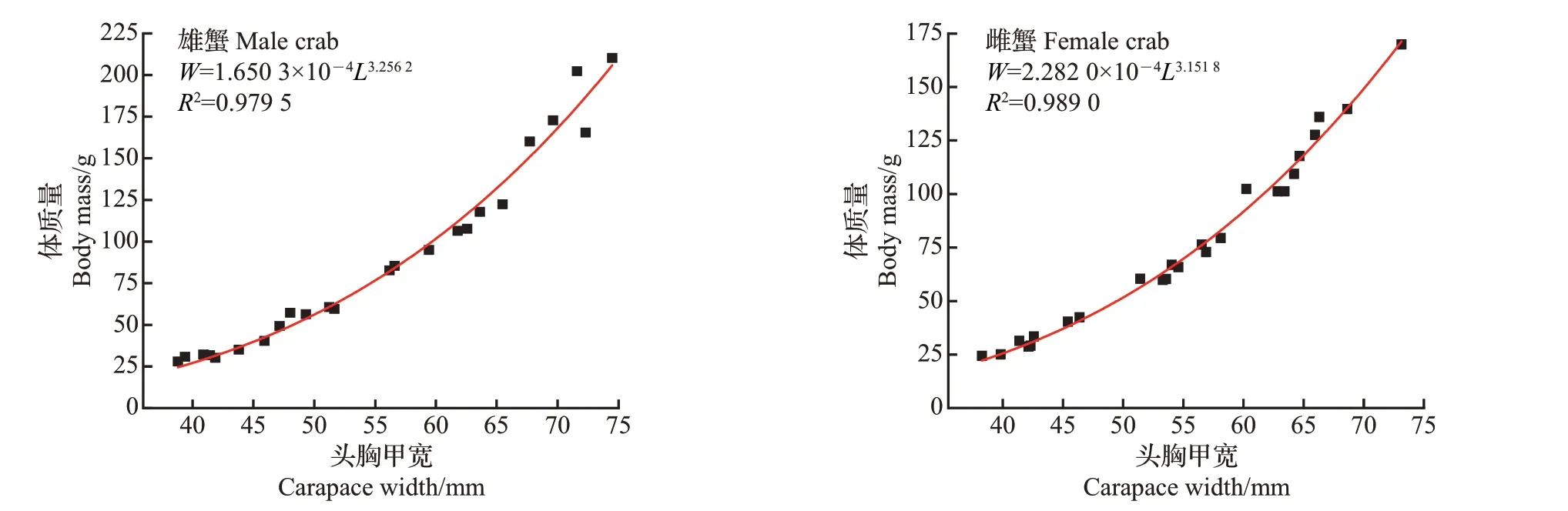
图3 三龄蟹头胸甲宽与体质量的回归曲线Fig.3 Regression curves between carapace width and body mass of the third-year-old crab
2.1.3 生长方程模拟结果
根据Snedecor和Sturges计算分组组距的方法,得出的组距为3或6 mm,经过验证,当间距为6 mm时,所得的K值和渐进头胸甲宽(L∞)在生物学上能接受[20]。因而三龄蟹生长方程如下。
雄 蟹:Lt=84.00[1-e-2.0(t+0.097)],L∞=84.00 mm,K=2.0,a=0.54;
雌 蟹:Lt=77.70[1-e-2.4(t+0.082)],L∞=77.70 mm,K=2.4,a=0.63。
式中:L表示头胸甲宽,mm;t表示日龄,d;a表示估算拟合优度的指数。
实际捕捞到的最大个体的头胸甲宽为85.09 mm,说明本生长方程的模拟有一定可靠性。雌、雄蟹模拟极限头胸甲宽大于黄河口野生蟹(雄蟹,68.25 mm;雌蟹,69.30 mm)[18],生长系数也略高于黄河口野生蟹(雄蟹,1.8;雌蟹,1.9)。
2.2 三龄蟹的繁殖性能
比较三龄蟹和常规蟹的繁殖力指标(表2)发现,其繁殖力之间无显著差异,表明二者繁殖能力相当。

表2 三龄蟹与常规蟹的繁殖力比较Table 2 Comparisons of fecundity between the third-year-old crab and the conventional crab
2.3 营养组成分析结果
2.3.1 氨基酸组成与分析
在三龄蟹可食部位共检测出17种氨基酸,包括9 种必需氨基酸和8 种非必需氨基酸(表3)。性腺和肌肉这2个主要可食部位均表现为谷氨酸含量最高,其次是天冬氨酸,与朱清顺等[6]对太湖蟹、阳澄湖蟹等8个中华绒螯蟹群体的研究结果相似。

表3 三龄蟹可食部位氨基酸组成Table 3 Amino acid compositions of edible parts of the third-year-old crab %
水产动物的呈味氨基酸比例是影响其风味的重要因素[21]。三龄蟹肌肉的呈味氨基酸比例高于性腺,总呈味氨基酸比例(46.65%)高于太湖蟹(46.40%)、滆湖蟹(45.70%)、固城湖蟹(45.26%)和大纵湖蟹(46.43%)[6]。在适宜的盐度范围内,盐度的增加能够在一定程度上提高蟹肉的鲜度和风味[22],呈味氨基酸含量偏高可能与蟹种生活阶段水体中的盐碱度有关。
三龄雌蟹性腺和肌肉中的氨基酸总量均高于雄蟹,其中雄蟹性腺中的氨基酸总量与雌性性腺和肌肉中的含量相比显著偏低,辽河自然种群中的氨基酸组成也出现了类似现象[5]。高海拔、低温环境可能是该现象的原因之一,因此,应在养殖前期通过高蛋白饲料的强化喂养,以进一步提高三龄蟹的存活率。
根据世界卫生组织/联合国粮食及农业组织/联合国大学(World Health Organization/Food and Agriculture Organization of the United Nations/United Nations University, WHO/FAO/UNU)制定的氨基酸评分模式[23]对三龄蟹性腺和肌肉的氨基酸进行评价,主要可食部位氨基酸的评分如表4 所示。从中可知:雌蟹可食部位的氨基酸评分均大于100,说明雌蟹可食部位中不存在限制性氨基酸;雄蟹性腺中苏氨酸、苯丙氨酸+酪氨酸、亮氨酸和赖氨酸评分均低于100,为限制性氨基酸,其中赖氨酸为第一限制性氨基酸,亮氨酸为第二限制性氨基酸。与常规蟹的研究结果[4]相似。

表4 必需氨基酸评分情况Table 4 Essential amino acid score(EAAS)
2.3.2 脂肪酸的组成与分析
三龄蟹脂肪酸测定结果如表5 所示。从中可知:实验共检测出23 种脂肪酸,其中饱和脂肪酸(saturated fatty acid, SFA)8 种,单不饱和脂肪酸(mono-unsaturated fatty acid,MUFA)4 种,多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)11 种。性腺中的总不饱和脂肪酸比例低于肌肉,性腺中以MUFA 为主(49.28%~51.53%),以油酸(C18:1)比例最高,肌肉中的脂肪酸以PUFA 为主(47.18%~50.02%),与成永旭等[24]研究结果相似。

表5 三龄蟹可食部位脂肪酸组成Table 5 Fatty acid compositions of edible parts of the thirdyear-old crab %
三龄雌、雄蟹肌肉中PUFA 含量高于MUFA。水产动物在不饱和脂肪酸利用过程中优先利用MUFA,中华绒螯蟹在高原湖泊越冬时受到低温和饥饿的双重胁迫,会大量消耗脂肪酸,甚至影响越冬后的蜕壳成功率[25],池塘套养的中华鳖与温室养殖的相比也有类似现象[26]。三龄蟹肌肉中的脂肪酸组成差异可能与其蟹种历经了2个冰封期生活环境相关。
三龄蟹性腺和肌肉中的二十碳五烯酸(eicosapntemacnioc acid,EPA)和二十二碳六烯酸(docosa hexaenoic acid, DHA)含量与池塘精养蟹[3−4]相比均较低。EPA和DHA必须从食物脂肪中获取[27],提示了养殖过程中也应通过脂类功能性饲料的强化来为三龄蟹补充脂肪酸营养,以进一步提高其存活率。
2.3.3 矿质元素的含量与分析
实验共检测了5种常量元素和3种微量元素在可食部位中的含量。结果(表6)显示:三龄雌、雄蟹不同可食部位的矿质元素含量差异显著,钠(Na)、钾(K)是可食部位中含量最高的元素,K元素在雌、雄蟹的可食部位中含量分布一致(肌肉>肝胰腺>性腺),Na的含量在雌、雄蟹不同可食部位中的含量存在差异,其中雌蟹中的含量顺序为肝胰腺>肌肉>性腺,雄蟹中则为肌肉>肝胰腺>性腺;肌肉中的微量元素含量显著高于性腺和肝胰腺[除锰(Mn)外]。与长江、辽河和黄河等水域的二龄蟹相比,三龄蟹可食部位的Na、K 和锌(Zn)元素含量较高[5]。Na、K元素含量受渗透压影响[15],Zn在中华绒螯蟹性腺发育中具有重要作用[28],这几种元素的含量差异可能与三龄蟹高原湖泊生活史有关。

表6 三龄蟹矿质元素含量对比Table 6 Comparisons of mineral element contents of the third-year-old crab mg/kg
3 讨论与结论
根据以上分析结果可知,经高原湖泊低温胁迫而发生滞育的二龄未成熟蟹种,返回长江流域池塘养殖后,可以正常地生长并繁殖后代。三龄蟹成熟后的规格接近长江和辽河流域的常规蟹[8],形态判别指标对比无明显差异,生长方程模拟和实际捕捞的最大规格数值显示其具有较好的生长潜力。池塘条件下三龄蟹的生长性能明显优于可鲁克湖区成蟹,说明补偿生长假说可能同样适用于中华绒螯蟹三龄阶段。对可食部位营养组成的测定和分析结果显示:三龄蟹具有正常的营养价值;但在氨基酸评价中,雄蟹性腺的氨基酸总量、呈味氨基酸含量,以及脂肪酸评价中的MUFA总量和EPA+DHA含量等指标与常规蟹相比存在差异。已有研究显示,地理位置与中华绒螯蟹脂肪酸组成存在一定关联,并提出了以脂肪酸组成作为生物标志物的构想[29]。营养沉积特征、矿质元素含量、阶段性生长和积温差异等提示了复杂生境对中华绒螯蟹生活史的诸多影响,为进一步揭示中华绒螯蟹滞育−补偿生长机制的研究提供了参考依据。
中华绒螯蟹在其生活史中仅繁殖一次。利用其生活史的可塑性,已有学者成功构建了中华绒螯蟹一龄性早熟自交家系、一龄性早熟与二龄正常成熟杂交家系[30],证实了一龄性早熟中华绒螯蟹群体(生活史缩短)的育种可利用性。三龄蟹具有生活史延长的特点,若利用其同源亲本子代繁殖周期的差异,可为构建中华绒螯蟹回交系(图4)提供一种可能。此外,三龄蟹与一龄蟹是否能够正常繁育等问题尚需后续研究进一步验证。
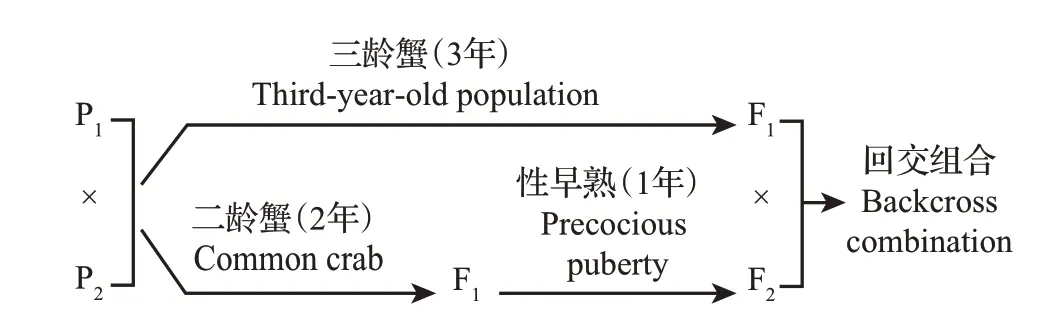
图4 回交组合示意图Fig.4 Backcross combination diagram

