斑马鱼心脏再生模型及研究进展
张维嘉,梁金秀,韩佩东
(浙江大学医学院遗传学研究所,杭州 310058)
人类心脏由两心房和两心室构成,经过体循环和肺循环,为人体提供氧气以及供应营养。根据流行病学调查结果,心血管疾病已经成为人类健康的“头号杀手”,其发病率和死亡率都显著高于其他疾病。其中心力衰竭是一种进行性的心血管疾病,其外显率随年龄增大呈显著上升的趋势。在心力衰竭进程中,心肌细胞死亡导致心脏收缩和舒张功能下降,并诱发损伤区域纤维化。成年哺乳类动物心肌细胞都具有一定的分裂增殖能力,但是心肌细胞发生分裂增殖的频率很低[1],不足以补偿心脏损伤导致的细胞损失。目前,治疗心血管疾病的主要策略是延缓病情进展,临床上缺乏对受损心肌进行修复和再生的方法。而对于终末期心力衰竭患者而言,心脏移植是唯一有效的治疗方法。但是心脏器官的供应有限,无法满足临床面临的大量需求。因此,胚胎干细胞[2]或者诱导多功能干细胞[3]治疗心脏疾病的疗法得到了广泛的关注。这些细胞可以在体外扩增培养,当注射到心脏的损伤区域后,可以原位分化为心肌细胞,或通过旁分泌的机制诱导局部血管新生,以此来显著改善损伤区域的心脏功能。但是,目前有研究发现在干细胞移植后,其分化产生的心肌细胞和内源性心肌细胞功能在耦联上存在一定的障碍,容易诱导心律失常的发生[2]。因此,探索内源性心肌细胞的再生机制对治疗人类心血管疾病具有重要意义。
斑马鱼心脏具有单心房、单心室的结构,且其发育过程与哺乳类动物具有高度的相似性。与哺乳动物不同的是,成年斑马鱼心脏具有损伤后再生的能力,在损伤诱导的不同信号通路作用下,已有的心肌细胞可以发生去分化和再分化以再生心肌组织[4−5],替代损伤区域纤维化瘢痕;损伤区域的冠状血管也重构以提供血液循环,心脏的整体结构和功能在损伤后30~60 d 可完全恢复。对斑马鱼心脏再生研究的意义在于:探寻心脏在损伤时对损伤信号的感知途径,研究损伤后心肌细胞增殖所需的反应机制,摸索完全再生的心脏即时接收终止再生信号的相关过程,并基于以上生物学机制为人类心脏疾病的治疗提供新的思路和干预策略。首先,在斑马鱼正常心脏上构建相关研究的损伤模型,如心尖切除损伤模型、冰冻损伤模型、心肌细胞遗传消融模型和缺氧/复氧模型等,以深入研究斑马鱼心脏再生过程中的具体机制。同时,斑马鱼心脏具有多种类型的细胞,如心肌细胞、心外膜细胞、心内膜细胞、成纤维细胞和免疫细胞等。不同种类细胞在损伤后的激活过程中具有独特的时空特征,其协调作用促进了心脏再生的进程。因此,本文将详述近年来斑马鱼心脏再生、心脏损伤模型构建以及不同细胞类型对再生过程调控作用的研究进展,以便探究人类心脏疾病的发生过程,进一步提供新的治疗策略,最终帮助人们摆脱心脏疾病的困扰。
1 心脏再生现象的发现和斑马鱼用于心脏再生研究的独特优势
脊椎动物斑马鱼作为器官再生研究的模式生物,其肝脏[6]、视网膜[7]、鳍[8]等器官都被证实存在再生的能力。2002 年,POSS 等[9]首次发现:斑马鱼心脏内切除20%的心室在2个月内完全再生;同时,标记有丝分裂检验点蛋白的单极纺锤体1基因(mps1)在损伤区域表达上调,证实在斑马鱼再生过程中出现了有丝分裂现象。
斑马鱼作为心脏再生研究模型的主要优点是能够获得大量的转基因或基因缺失品系,这对于确定在再生进程中特定基因的功能至关重要。在过去20 年里,研究人员发现了潜在的调控斑马鱼心脏再生的关键分子和细胞的事件主要包括:1)心外膜的激活。斑马鱼心脏损伤后1~2 d 心外膜细胞开始被激活,表现为视黄酸合成酶(retinoic acid synthesizing enzyme 2, RALDH2)[10−11]、心外膜发育编码T−box 转录因子18(T−box transcription factor 18, tbx18)[12]、Wilms 肿 瘤 蛋 白(Wilms’ tumor 1,WT1)[13]和纤维连接蛋白1(fibronectin 1, Fn1)[14]等心外膜标志物基因表达量上调;心外膜细胞在心尖切除损伤后7 d 在损伤区域聚集[10−11]。2)表观遗传程序的变化。染色质重构复合物核心催化亚基基因(Brahma-related gene 1,Brg1)是腺苷三磷酸(adenosine triphosphate,ATP)依赖的染色质重构复合物SWI/SNF 的一个组成部分,在损伤诱导后在损伤区域表达量上调[15]。Brg1通过与DNA 甲基化相关基因(DNA methyltransferases related 3ab,Dnmt3ab)的相互作用,提高了细胞周期蛋白依赖性激酶抑制剂基因cdkn1c启动子上CpG 位点的甲基化水平,以抑制cdkn1c的表达。故Brg1通过依赖Dnmt3ab的DNA甲基化抑制cdkn1c的表达,以促进心脏再生。3)心脏发育必需的关键转录因子基因的再激活。通过构建Tg(gata4∶EGFP)[4]、Tg(hand2∶EGFP)[16]转基因斑马鱼品系,发现心脏损伤后gata4和hand2启动子驱动的增强绿色荧光蛋白(enhanced green fluorescent protein, EGFP)在心肌细胞中表达,提示了心脏发育必需的相关转录因子如gata4[4]和hand2[10,16]被重新激活。4)心肌细胞肌节结构的解体。再生的心肌细胞失去了一些分化细胞的特征,包括肌节结构的解聚,以及部分肌节蛋白表达量下调和肌球蛋白的重新表达[5]。
2 斑马鱼心脏损伤模型的构建
通过构建不同的斑马鱼心脏损伤模型,可以模拟人类心肌梗死等疾病中的心脏损伤。与哺乳动物类似,斑马鱼心脏损伤反应的最初阶段包括血凝块形成、成纤维细胞的积累和胶原沉积。目前常用的斑马鱼心脏再生研究模型主要有心尖切除模型、冰冻损伤模型、心肌细胞遗传消融模型和缺氧/复氧模型。
2.1 心尖切除模型
POSS等[9]将心室尖端组织切除20%后,观察到损伤后的组织经过60 d 的恢复,从形态上完全再生,再生区域的功能也得以恢复。心尖切除模型制作的步骤如下:首先将斑马鱼麻醉后,腹部朝上放在用海绵凹槽制作的“手术台”上;然后用镊子拨开胸腔,露出心室(图1A);接着使用显微手术剪,切除斑马鱼心室尖端的组织;最后立刻将斑马鱼放回无麻醉剂的养殖水中,同时使用巴氏管反复吹吸将其唤醒。心尖切除后损伤区域的变化过程如下:损伤后1 min 内,损伤区域立即形成血凝块;损伤后2~4 d,血凝块逐渐被纤维组织替代;损伤后7~9 d,血凝块完全被纤维组织替代;损伤后14 d,纤维蛋白减少,心肌开始重建;损伤后30 d,在损伤区域形成连续的由心肌细胞组成的心肌壁;损伤后60 d,心肌细胞完全取代纤维组织,形成一层新的致密心肌层,再生的心肌细胞电传导功能完全恢复正常[4]。不同于人类心肌梗死,斑马鱼心尖被切除后,在损伤区域并没有形成永久性的瘢痕,而是先形成大量的血块再形成纤维组织,最终由新生的心肌细胞代替纤维组织,完成再生过程(图1B)。
2.2 冰冻损伤模型
在人类心肌梗死发生过程中,冠状血管堵塞造成心肌细胞死亡,而后成纤维细胞增殖并转化为纤维化瘢痕组织。而上述的心尖切除模型是依靠物理剪切移除掉部分心室组织以达到心脏损伤的目的,与人类心肌梗死造成的损伤仍具有一定的差异。且由于斑马鱼心脏较小,直径1 mm 左右[17],难以在解剖镜下识别冠状血管。为了更好地模拟人类心脏冠状动脉堵塞造成的心肌损伤,有研究者构建了冰冻损伤模型[12−13,18]。冰冻损伤模型制作的基本步骤如下:首先将斑马鱼麻醉,使其腹部朝上平躺在用海绵凹槽制作的“手术台”上;然后使用镊子打开胸腔,露出心室;接着使用液氮处理过的低温铜丝快速接触心室的尖端部位;最后立刻使用室温水滴在铜丝与心室交联处以终止损伤,并将斑马鱼立刻放进无麻醉剂的养殖水中,同时使用巴氏管反复吹吸将其唤醒。
与心尖切除模型相比,冰冻损伤模型导致大量细胞死亡和纤维化瘢痕形成,更加类似于哺乳动物心肌梗死的现象。其具体表现为:冰冻损伤后1 d,损伤区域占心室面积的25%,血细胞在损伤区域堆积,在心脏外表面特别是在损伤区域边缘发生大量的心外膜细胞增殖;损伤后3 d,心肌细胞的死亡量达到最大程度,纤维化瘢痕在损伤区域堆积以替代死亡的心肌细胞;损伤后7 d,出现明显的胶原沉积;损伤后21 d,形成纤维组织,瘢痕位于更靠近心腔的位置,心肌细胞已经出现明显再生,环绕着剩余的瘢痕;损伤后90 d,在心室心尖仍然出现残余的瘢痕;直到损伤后130 d,瘢痕完全消失,在损伤区域新生成的心肌细胞层比未损伤心室更为厚实,且其收缩能力也完全恢复[12](图1C)。与心尖切除损伤相比,冰冻损伤后心脏再生需要的时间更长,且在早期阶段的损伤区域出现大量的细胞凋亡[13]。其原因可能与冰冻损伤导致的血流中断和局部缺氧有关。
2.3 心肌细胞遗传消融模型
斑马鱼心脏心尖切除模型和冰冻损伤模型虽然都能够用于研究心脏损伤修复的过程,但是其共同的缺点在于不能损伤特定的细胞类型,进而区分该细胞类型参与心脏再生的机制。CURADO 等[19]通过结合化学和遗传学工具,使用细菌硝基还原酶(nitroreductase, NTR)/甲硝唑(metronidazole, Mtz)系统[原理是依赖于NTR介导的无毒性的硝基咪唑底物(如Mtz)的转化,引起细胞毒性以诱导细胞死亡,从而消融细胞],构建Tg(myl7∶CFP-NTR)转基因斑马鱼品系,其心肌细胞高效表达由青色荧光蛋白(cyan fluorescent protein, CFP)和NTR 组成的融合蛋白(CFP−NTR)[19]指示,使用药物Mtz 处理后,表达CFP−NTR的心肌细胞快速死亡;终止药物Mtz处理后的几天内,心脏的形态、结构和收缩功能可以完全恢复,血液循环也可以重建,心脏完成再生过程。运用类似的技术手段,通过特异性地消融斑马鱼心室心肌细胞,揭示了心房心肌细胞在胚胎心脏再生过程中转分化为心室心肌细胞的能力[20]。这些研究表明,NTR/Mtz系统可以在时间和空间上精准操控斑马鱼细胞消融;组织特异性启动子调控的NTR表达,能够在特定的时间诱导心脏上不同细胞的死亡,从而提供了分析不同类型细胞相互作用和研究再生机制的有效遗传学工具(图1D~E)。
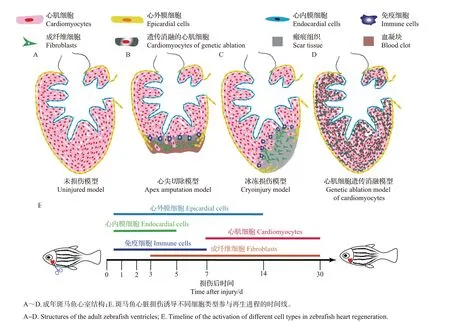
图1 斑马鱼心脏损伤模型示意图Fig.1 Schematic diagram of zebrafish heart injury models
2.4 缺氧/复氧模型
缺氧/复氧模型[21]可以在一定程度上模拟哺乳动物冠状动脉堵塞后发生的心肌梗死。缺氧/复氧模型制作过程[21]如下:提前准备一个5 L 的玻璃水槽,分别用溶解氧和pH探针监测水溶氧浓度和pH。首先构建缺氧的环境,即接入95%氩气和5%二氧化碳的混合气体,从而降低槽内的氧气浓度,使水溶氧质量分数从80%逐渐降低到5%,同时在水中加入碳酸氢钠,以保持pH 为7.50,避免缺氧引起酸化;接着将成年斑马鱼移入上述低氧环境中进行低氧处理15 min;随后将斑马鱼转移到常氧水中,每条成年斑马鱼放入1 L 水箱中,进行复氧处理。每个水箱中放入1条成年斑马鱼。
缺氧/复氧处理后2 h,斑马鱼心脏的氧化应激作用达到高峰;4 h 后,心脏出现零星的炎性细胞;6 h 后,心脏中的炎性细胞数目达到峰值,同时心肌细胞出现凋亡;24 h后,中性粒细胞和巨噬细胞的增殖减少并恢复到正常水平,心肌细胞的凋亡和坏死明显增加,心肌细胞开始增殖;3 d后,心肌细胞的增殖达到峰值;30 d 后,心肌细胞数量恢复正常,心室功能也完全恢复。然而,由于斑马鱼整体暴露在低氧环境中,这种模型导致的损伤并不局限于心脏。目前仍有待开发出使斑马鱼心脏局部性缺氧的方法,以更好地模拟人类心肌梗死。
3 斑马鱼心脏不同细胞类型参与心脏再生的机制
成年斑马鱼心脏由多种细胞类型组成,包括心肌细胞、心外膜细胞、心内膜细胞等,其通过不同的信号通路和细胞间的互作建立信息交流,以维持心脏正常的生理功能。斑马鱼心脏损伤后,心外膜和心内膜细胞发生增殖和迁移,并参与损伤区域血管系统的重建;心肌细胞也发生增殖以恢复心脏正常的收缩−舒张功能。这些细胞类型参与心脏再生的具体机制如下。
3.1 心肌细胞
心肌细胞起源于侧板中胚层,具有收缩和舒张功能,通过维持血液循环以向体内器官和组织运输氧气和营养物质。2010 年的2 项研究[4−5]通过运用Cre/Loxp 系统介导的心肌细胞谱系示踪技术,证实了再生的心肌细胞来源于已有心肌细胞的去分化。KIKUCHI等[4]发现:在未损伤的成年斑马鱼心脏中,心脏发育关键转录因子gata4的内源性表达量极低;但在心室损伤后7 d,gata4启动子驱动的EGFP在再生的心肌细胞中表达,表明再生的心肌细胞经历了去分化的进程。同时,JOPLING 等[5]通过构建Tg(myl7∶Cre-Ert2)和Tg(myl7∶LnL-GFP)转基因斑马鱼品系,并经过他莫昔芬药物处理,将心肌细胞标记为绿色荧光蛋白(green fluorescent protein,GFP)阳性;随后对成年斑马鱼进行心尖切除手术,发现损伤区域再生的心肌细胞也呈现GFP阳性,且再生区域发生心肌细胞肌节重组以及细胞周期相关因子plk1基因表达量上调,说明再生的心肌细胞来源于已有的心肌细胞分裂增殖。
参与心肌细胞再生相关信号的通路有:1)神经调节蛋白1(neuregulin 1, Nrg1)信号通路。现有的研究证实,酪氨酸激酶配体Nrg1/酪氨酸激酶受体(erb−b2 receptor tyrosine kinase 2, Erbb2)信号通路能够诱导心肌细胞的增殖和损伤修复。其中Nrg1在损伤后的斑马鱼心脏冠状血管周围表达和分泌,并结合心肌细胞上的Erbb2,在心脏再生过程中起到重要作用[22];使用药物抑制Erbb2基因的功能会降低心肌细胞增殖;而过表达Nrg1基因则增强了损伤后心肌细胞的增殖能力[22]。2)核因子κB(nuclear factor−κB, NF−κB)信号通路。NF−κB 信号通路是多种组织中早期损伤反应的重要组成部分[23],损伤后的心肌细胞发生了NF−κB 信号的激活[24]。通过构建心肌细胞特异性抑制NF−κB 信号通路的转基因斑马鱼,发现阻断NF−κB 信号通路则抑制了gata4基因调控序列的激活,进而导致心肌细胞增殖减少和心脏再生障碍[23]。3)低氧诱导因子−1(hypoxia inducible factor−1, HIF−1)信号通路。在心脏损伤后,缺氧导致HIF−1a表达量上调并与HIF−1β形成二聚体来激活下游序列[25],进而诱导相关基因表达,保护缺血环境中的心肌细胞;通过对心尖切除的斑马鱼进行缺氧处理,发现HIF−1a可调节心脏再生[26];对斑马鱼进行缺氧/复氧损伤,发现HIF−1依赖基因[21]如hmox1、epo和Vegfaa被激活,以保护损伤后的心肌细胞。4)P53 信号通路。肿瘤抑制因子P53的信号通路在心脏再生和氧化应激的反应中起到重要作用[27]。在斑马鱼心脏再生过程中,质谱分析表明P53 信号受到抑制[28]。而在损伤后心外膜细胞产生的过氧化氢(H2O2)刺激下,p53异构体Δ133p53的表达量上调,并通过增强抗氧化基因的表达来促进细胞存活[29]。Δ113p53在斑马鱼心脏再生区域的心肌细胞中表达。谱系示踪结果显示,Δ113p53阳性的心肌细胞可进行细胞增殖并促进心肌再生,缺失Δ113p53的斑马鱼心脏再生受损。因此,在损伤部位的心肌细胞中p53亚型Δ113p53通过增加抗氧化基因的表达来维持氧化还原平衡,从而促进心脏再生。
3.2 心外膜细胞
在发育过程中,心外膜前体细胞附着并最终覆盖胚胎心肌细胞的表面,形成一层心外膜[30],通过分泌营养因子刺激心肌细胞增殖[31]。心外膜细胞经过上皮−间充质转化(epithelial−mesenchymal transition,EMT)形成心外膜来源细胞(epicardial derived cells,EPDCs),并在胸腺素β4(thymosinβ4, Tβ4)[32]诱导下,最终形成成纤维细胞和血管平滑肌细胞[31]。
通过不同心外膜细胞标志物的应用,相关研究阐释了该细胞类型在心脏再生过程中的动态变化过程及功能:1)心外膜标志物基因raldh2在正常生理状态下的成年斑马鱼心外膜细胞中表达量极低[10],然而心尖切除损伤后1~2 d,raldh2在心脏流出道、心房和心室中表达量显著上调,且心外膜细胞开始被激活进入增殖和迁移进程;损伤2周以后,raldh2表达逐渐局限于损伤区域,且增殖的心外膜细胞主要聚集在损伤区域。2)运用标记心外膜细胞基因的Tg(wt1b∶GFP)转基因斑马鱼品系,发现冰冻损伤后的斑马鱼心脏中,GFP阳性细胞比例显著升高[13],提示损伤诱导了心外膜细胞增殖。3)通过运用NTR/Mtz系统在Tg(tcf21∶NTR)转基因斑马鱼中遗传消融心外膜细胞,然后进行心脏损伤操作,结果证实心肌细胞增殖和心脏再生受到抑制[33],提示了心外膜细胞在心脏再生过程中的重要作用。
损伤后的心外膜细胞参与再生的相关信号通路有:1)成纤维细胞生长因子(fibroblast growth factor, FGF)信号通路。FGF 信号通路中的配体基因fgf17b在损伤后再生的心肌细胞中表达[10];而FGF信号受体基因fgfr2、fgfr4在损伤后增殖的心外膜细胞中表达[10],提示FGF 信号通路介导了再生过程中心肌细胞和心外膜细胞的互作。进一步的研究通过构建Tg(hsp70∶dn-fgfr1)转基因斑马鱼品系[10],热激后激活显性−负性的fgfr1的表达,从而抑制FGF 信号通路的活性,导致再生进程受到抑制,且再生的区域仍存在胶原和纤维瘢痕组织;且在损伤区域缺少Tg(fli1∶EGFP)转基因标记的冠状动脉血管新生。上述研究结果证实FGF 信号与心外膜细胞增殖、冠状血管生成以及心肌细胞的再生密切相关。2)血小板衍化生长因子(platelet-derived growth factor,PDGF)信号通路。壁细胞和间充质细胞与心外膜细胞EMT进程相关,壁细胞和间充质细胞的标记基因pdgfr在损伤区域的心外膜细胞中表达量上调[34];通过药物处理抑制PDGF 信号通路则造成体外培养的心外膜细胞增殖受到限制和pdgfrβ表达量下调[34],进一步影响心外膜细胞EMT 进程,使冠状动脉形成受阻。因此,PDGF 信号通路对损伤后心外膜细胞增殖及其经过EMT 转化为冠状动脉的过程有重要作用。3)Hh 信号通路。运用基于荧光泛素化的细胞周期指示剂(fluorescent ubiquitination-based cell cycle indicator, FUCCI)的转基因斑马鱼品系[35],发现Hh信号通路影响了心肌细胞增殖。在斑马鱼心脏切除损伤后7 d,Hh 信号通路中配体基因shha在损伤区域的心外膜细胞中被激活[35],而Hh 信号通路的靶基因ptch2在再生区域内的心肌细胞中表达[35],说明Hh信号通路在再生过程中介导了心外膜细胞与心肌细胞的互作。通过运用Cre/Loxp 系统条件性敲除损伤心脏心外膜细胞中shha的表达[36],进一步证实了Hh信号通路具有在再生过程中促进心肌细胞增殖以及调节心外膜细胞再生的功能[33]。
3.3 心内膜细胞
心内膜是一层特化内皮细胞,覆盖在心脏的管腔表面,为血液循环提供生理屏障。在未受损伤的心脏中,心内膜细胞呈现扁平状,紧密地附着在相邻的心肌上;在损伤后1~3 h,心内膜会经历快速的形态变化[11];在损伤后3~5 d内,损伤区域周围的心内膜细胞发生显著增殖[37]。
心内膜损伤后激活的主要信号通路有:1)视黄酸(retinoic acid, RA)信号通路。心脏损伤诱导raldh2在损伤部位的心内膜细胞表达[11]。当过表达显性−负性类视黄酸受体基因RAR-α或RA 信号降解酶基因Cyp26,从而在斑马鱼中抑制RA信号转导时,心肌细胞增殖会受到抑制。在发育过程中,RA信号通路是通过肝促红细胞生成素(erythropoietin,EPO)信号发挥作用,该信号激活IGF2 因子的表达[38],进而通过心脏IGF 信号受体激活心肌细胞的增殖。但在心脏再生过程中,RA 信号调控心肌细胞增殖的具体机制仍有待研究。2)Notch 信号通路。在不同的斑马鱼心脏损伤模型中,研究者都观察到了Notch 信号通路的激活。心尖切除损伤后,Notch信号受体基因notch1a、notch1b和notch2在心内膜中的表达水平显著升高[39];而冰冻损伤则诱导了心内膜细胞中Notch 信号受体基因notch1b、notch2和notch3的表达[37];在遗传消融系统介导的胚胎心室损伤中,由于notch1b表达量上调,心房内膜细胞介导Notch 信号通路的活性增强[20,40]。运用小分子抑制剂或基因操作手段[15,29−30]抑制Notch信号通路活性,会降低心肌细胞增殖,从而阻断心脏再生。3)JAK1/STAT3 信号通路。激活的心内膜细胞和炎症细胞都会释放细胞因子白细胞介素11a(interleukin 11a, Il11a)和 白 细 胞 介 素 11b(interleukin 11b, Il11b),这些分泌因子激活了心肌细胞中的JAK1/STAT3 信号通路,从而导致刺激心肌细胞增殖的分泌因子relaxin3a表达量上调[41]。心肌细胞特异性stat3显性失活会显著减少心肌细胞的增殖并阻碍再生。
3.4 成纤维细胞
纤维组织在斑马鱼心脏损伤后的持续时间是短暂的,最终会被心肌细胞替代以完成再生。在修复过程中,纤维组织形成和降解的动态平衡对心脏再生起到重要作用。纤维组织由大量的成纤维细胞组成,通过分泌产生细胞外基质以维持成年心脏正常结构和功能。通过对标记成纤维细胞的骨膜蛋白[42]和胶原蛋白[43]的转录组分析,证实了损伤区域成纤维细胞的存在;经特异性消融成纤维细胞后,心肌细胞的再生过程受到抑制,故成纤维细胞对斑马鱼心脏损伤后修复过程有重要调节作用。转化生长因子β(transforming growth factorβ, TGFβ)信号通路与成纤维细胞参与心脏再生过程有重要联系。成纤维细胞产生的胶原蛋白和其他细胞外基质在心脏损伤区域富集[43],并激活TGFβ信号通路。在斑马鱼心脏再生过程中,TGFβ的Ⅰ型受体基因tgfbr1b在损伤区域的纤维化组织和再生心肌细胞中表达,TGFβ配体在损伤区域和周围的心肌细胞中表达;另可以通过药物处理TGFβ信号通路的Ⅰ型受体抑制磷酸化的Smad3[44],进而抑制TGFβ信号活性,最终使斑马鱼心脏再生过程受到抑制。因此,TGFβ信号通路通过依赖Smad3 的信号传导来实现在心脏损伤后促纤维化与促再生的平衡[44]。
3.5 免疫细胞
心脏损伤后,免疫反应参与了从组织修复阶段到再生阶段的转变[45]。心脏再生的早期阶段类似于伤口愈合反应[46],该阶段斑马鱼心脏中心肌细胞的大量死亡引起炎症反应[12,31,47],并招募巨噬细胞和T细胞。在免疫细胞招募过程中,过氧化氢通过降解Dusp6[48]从而解除对MAPK的抑制作用[49],在斑马鱼心肌再生中发挥着重要功能。而免疫细胞在斑马鱼心脏损伤后修复过程中的主要功能如下:1)巨噬细胞。在斑马鱼心脏发育过程中,巨噬细胞能够促进心脏传导系统发育[50]以及冠状动脉血管形成[51]。而在瘢痕组织形成和心脏再生过程中,巨噬细胞也发挥了不可或缺的功能。原位杂交结果显示,心脏损伤后1 d 巨噬细胞特异性标记基因mpeg1在损伤区域表达,证明在损伤早期阶段出现了巨噬细胞招募[52];经过转录组分析,发现巨噬细胞通过合成胶原以形成短暂的瘢痕组织而影响下游的伤口愈合过程[52]。巨噬细胞介导的先天免疫系统能够促进ECM 重塑和血管生成,进而促进心脏再生[53];而减少巨噬细胞介导的免疫反应[47],导致心脏再生进程受到抑制。2)调节性T细胞。这类细胞可维持对自身抗原的耐受性,并限制组织损伤引起的过度炎症反应[54]。通过遗传消融调节性T 细胞,会抑制斑马鱼的心脏再生进程[55],并伴有纤维蛋白的沉积和胶原瘢痕的形成[56]。
4 小结与展望
心脏病具有高发病率和高致死率的特点,严重危害人类生命。近年来的研究表明,脊椎动物斑马鱼心脏具有良好的再生功能,基于该模型的再生医学研究将为修复受损心脏提供一种新的策略。本文阐述了多种斑马鱼心脏损伤模型,包括心尖切除损伤、冰冻损伤、心肌细胞遗传消融以及缺氧/复氧模型,进而分析斑马鱼心脏损伤后出现的生物学进程:在损伤早期阶段快速形成血凝块,心肌细胞的大量死亡引起炎症反应,机体开始招募免疫细胞限制进一步炎症反应,而后由成纤维细胞形成纤维组织,同时发生心内膜细胞和心外膜细胞的增殖迁移、中性粒细胞和嗜酸性粒细胞的增殖以及冠状血管的新生,损伤后期在其他类型细胞的分泌因子和多种信号通路的诱导下,纤维组织随着心肌组织的增殖逐渐被替代,最终斑马鱼心脏重塑形成一层致密的新的心肌细胞层,恢复收缩和舒张的功能。总之,斑马鱼心脏损伤模型的构建,为心脏再生过程中的分子和细胞生物学机制研究提供了新的手段。近年来不断发展的荧光标记技术和高分辨率光学成像技术,将有助于我们进一步解析心脏多种细胞类型在此过程中互作的具体机制,有望为人类心脏疾病的治疗提供新的思路和策略。

