大花蕙兰种质资源的简单重复序列标记分析
沈竑哲,李春楠,傅巧娟,崔海瑞*
(1.浙江大学农业与生物技术学院原子核农业科学研究所,杭州 310058;2.杭州市农业科学研究院园艺研究所,杭州 310024)
大 花 蕙 兰(Cymbidium hybridum)为 兰 属(Cymbidium)多年生植物,是原产于印度、缅甸、泰国、越南和中国南部等地区兰属中的大花附生种、小花垂生种以及这些原生种经过人工杂交形成的杂种群[1−2]。目前,市售的大花蕙兰品种中大多植株雄健,花朵硕大,花色既具有洋兰的艳丽与华贵,又有国兰的多姿与雅致,且花期较长,深受大众青睐,具有很高的观赏价值。
从DNA 水平上明确和评价不同大花蕙兰品种资源的遗传多样性及其亲缘关系,不仅可以为其资源保护和利用提供依据,而且可以为其杂交育种亲本的选配提供理论指导。近20年来,一些国内外学者采用多种分子标记对大花蕙兰的遗传多样性和亲缘关系进行了研究,所用的DNA分子标记有扩增片段长度多态性(amplified fragment length polymorphism, AFLP)[3]、限制性片段长度多态性(restriction fragment length polymorphism,RFLP)[4]、随机扩增多态性DNA(random amplified polymorphic DNA, RAPD)[5−8]、相关序列扩增多态性(sequencerelated amplified polymorphism,SRAP)[9]。
微卫星又称为简单重复序列(simple repeated sequence,SSR),是1~6 bp DNA基序的简单串联重复序列。SSR 在基因组中广泛分布,具有高度的变异性,是建立多态性DNA标记的资源[10]。随着测序技术的飞速发展,基因组测序和转录组测序在非模式植物中得到了广泛应用,积累的数据也为SSR标记的开发奠定了基础。其中,基于转录组数据或表达序列的SSR标记开发,是根据基因内部SSR两侧的 保 守 序 列 而 设 计 引 物,也 称 为genic−SSR[11−14]。SSR 标记具有较强的品种鉴别力、共显性遗传和可重复性等优点,在植物遗传育种中有着广泛的应用[11,15]。在大花蕙兰中,MOE 等[16]利用春兰基因组富集基因文库开发了14对SSR引物;孙叶等[17]利用春兰和大花蕙兰杂交种的转录组测序数据开发了200 对SSR 引物,并将这些SSR 标记用于研究兰属植物种群间的关系。但尚未见SSR 标记应用于大花蕙兰种内资源分析的报道。
大花蕙兰是通过兰属原生种自然杂交衍化或人工杂交培育的,蕙兰是大花蕙兰的近缘原生种之一。根据美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)(https://www.ncbi.nlm.nih.gov)中已收录的大花蕙兰和蕙兰转录组测序数据的差异,基于genic−SSR 标记的通用性,本研究选用蕙兰转录组序列资源开发SSR标记,对杭州市农业科学研究院兰花资源圃中41个大花蕙兰品种的遗传多样性及亲缘关系进行了分析,以期为大花蕙兰种质资源的合理利用以及杂交育种中亲本的选配提供理论依据。
1 材料与方法
1.1 试验材料
供试的大花蕙兰材料共41个,其品种名及植株特性信息等详见表1。于杭州市农业科学研究院大花蕙兰种植温室采集幼嫩叶片,放于冰盒中带回实验室用无菌水洗涤并室温晾干,低温保存,备用。
1.2 试验方法
1.2.1 DNA 提取
将所称取的80~100 mg 幼嫩叶片在液氮中研磨成细粉,按Ezup 柱式植物基因组DNA 抽提试剂盒[生工生物工程(上海)股份有限公司]操作说明提取DNA,用1%琼脂糖凝胶电泳检测基因组DNA的质量和完整性,采用Nanodrop 2000 微量分光光度计(美国Thermo Fisher Scientific 公司)测定DNA质量浓度,并统一至50 ng/μL。
1.2.2 SSR 引物设计
从NCBI数据库中下载蕙兰转录组测序的非冗余基因序列(https://www.ncbi.nlm.nih.gov/nuccore/874594650)158 048 条,利用SSRIT(https://archive.gramene.org/db/markers/ssrtool)在线进行SSR搜寻,设置SSR 基元的最小重复数标准分别为单核苷酸重复16 次,二核苷酸重复6 次,三核苷酸重复5 次,四至六核苷酸各重复4次[18]。选择部分含有SSR的序列,用Primer 3.0(http://frodo.wi.mit.edu/)进行引物设计,共合成了68 对引物(附表1,http://www.zjujournals.com/agr/CN/10.3785/j.issn.1008−9209.2021.03.082)。
1.2.3 简单重复序列-聚合酶链反应(polymerase chain reaction,PCR)与扩增产物的检测
以随机抽取10 个样品等量混合的DNA 为模板,采用梯度(50~62 ℃)PCR确定引物的适宜退火温度。SSR−PCR 的扩增体系如下:2 μL 预混液(含Mg2+、dNTP 和Taq酶),1 μL 模板(约50 ng DNA),0.6 μL 正、反向引物(终浓度为0.4 μmol/L)和10.8 μL 超纯水[19]。扩增条件:94 ℃预变性5 min;94 ℃变性1 min,适宜温度退火45 s,72 ℃延伸2 min,共35个循环;72 ℃延伸5 min。
对于利用混合模板测试引物的扩增产物,采用1.5%的琼脂糖凝胶电泳检测有无扩增产物。对于各大花蕙兰材料扩增产物,采用10%聚丙烯酰胺凝胶电泳进行检测,进样量为1 μL,以110 V恒压电泳约2.5 h,银染检测,扫描电泳图谱并保存图像文件。
1.2.4 扩增条带的统计与分析
根据各样本扩增产物的电泳图谱,在相同迁移位置上,有条带记为“1”,无条带记为“0”,生成原始数据矩阵。根据BOTSTEIN等[20]描述的方法计算多态性信息含量(polymorphism information content,PIC)值。利用NTSYS−pc 2.10软件对数据进行分析,通过SIMQUAL程序计算出材料间的遗传相似系数,用SHAN 程序中的非加权成对算术平均法(unweighted pair-group method with arithmetic mean,UPGMA)进行聚类分析,通过TREE PLOT模块生成聚类图。
2 结果与分析
2.1 SSR 引物的开发与扩增结果
对下载的158 048 条蕙兰非冗余基因序列进行搜索,共检出9 473个SSR,这些SSR分布于8 860条序列中,发生频率为5.60%。蕙兰中SSR 种类较为丰富,单核苷酸至六核苷酸重复均有出现,但出现频率有很大差异。其中,二核苷酸重复(62.15%)和三核苷酸重复(23.85%)占主导地位,二者占总SSR的比例高达86%,而单核苷酸、四核苷酸、五核苷酸和六核苷酸重复类型数量较少(表2)。

表2 蕙兰非冗余基因序列中的SSR发生频率Table 2 Frequency of SSR in C.faberi unigene sequences
选择其中含有SSR的序列开发引物,共设计引物68 对,各引物的具体信息见附表1。采用混合模板对这些引物进行了测试,图1 是部分SSR 引物的测试结果。经测试发现,SSR2、SSR4、SSR10、SSR19、SSR23、SSR27、SSR41、SSR47、SSR48、SSR54、SSR56、SSR62、SSR63 等13 对引物没有扩增产物或扩增条带较弱,其余55 对具有扩增产物,且条带清晰。

图1 部分SSR引物扩增产物的琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of PCR products from some SSR primer pairs
2.2 不同SSR 的扩增多态性
利用其中的25对SSR(表3)进一步对41份参试材料进行分析,共扩增出187个条带,平均每对引物扩增出7.48条;多态性条带171个,平均每对引物扩增多态性条带6.84 个。不同SSR 的扩增条带数在2~14条之间,多态性条带比率为60.00%~100.00%。25对SSR的PIC值在0.503 3~0.960 1之间,平均值为0.770 3。通过不同SSR标记分析,41份材料显示的等位基因型(材料类型)数为3~31个。
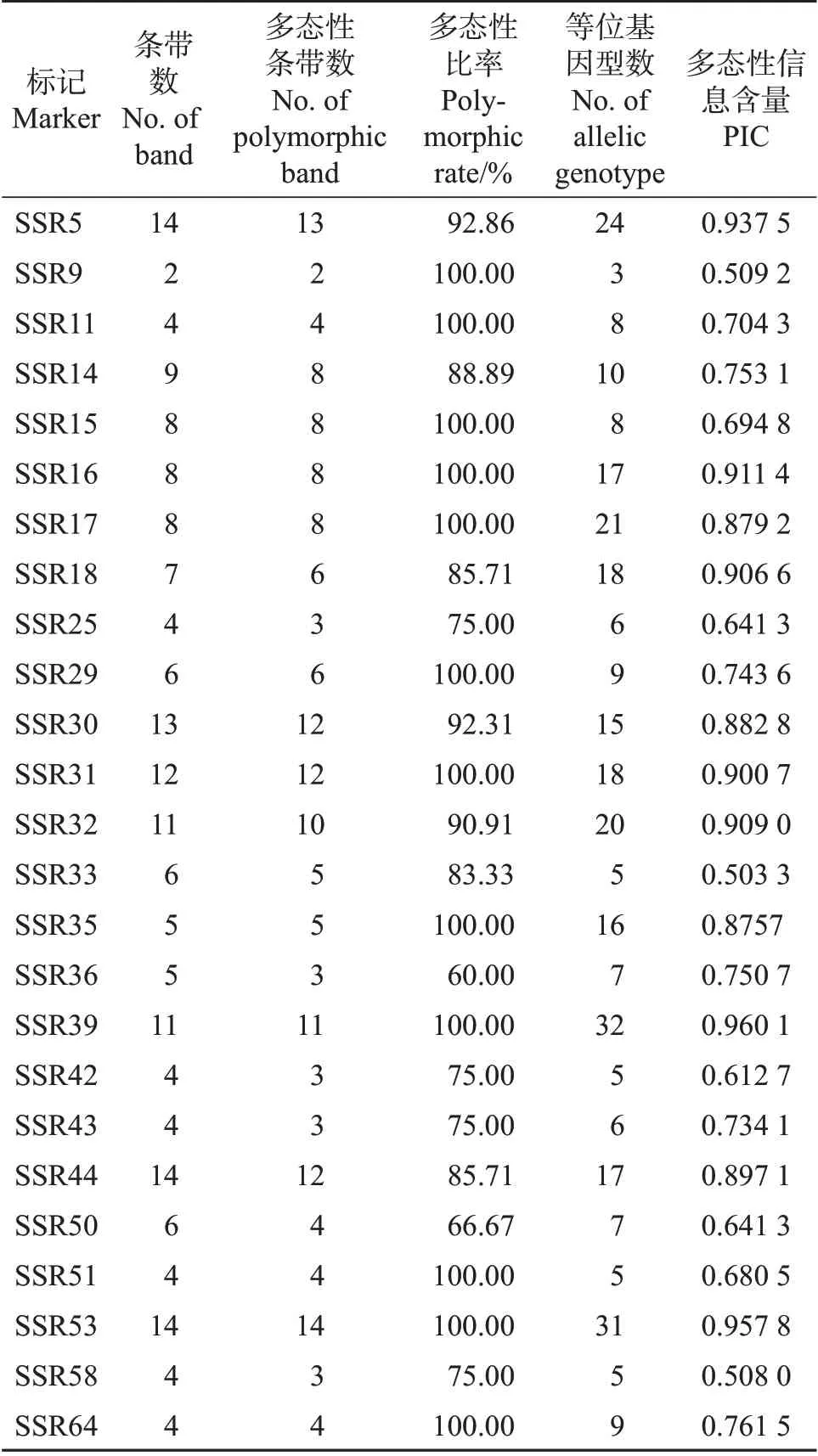
表3 25对多态性引物扩增情况Table 3 Amplification of 25 polymorphic primer pairs
2.3 供试材料特有的SSR 标记
通过25对SSR对41份供试材料进行分析,发现7份材料具有特异性的SSR条带,其中,义大蕙6、垂兰1、天之骄子、JOIC 和YN−3 等5 份材料具有特异性扩增条带,而另外2份材料义蕙1和1056既具有特异性扩增条带,又呈现特异性缺失(表4)。7个特异性扩增条带扩增自SSR14、SSR29、SSR30、SSR32 和SSR44 5个SSR标记,而2条特异性缺失条带均扩增自SSR15。这些特异性扩增条带和特异性缺失条带可作为大花蕙兰品种鉴定的重要分子依据。
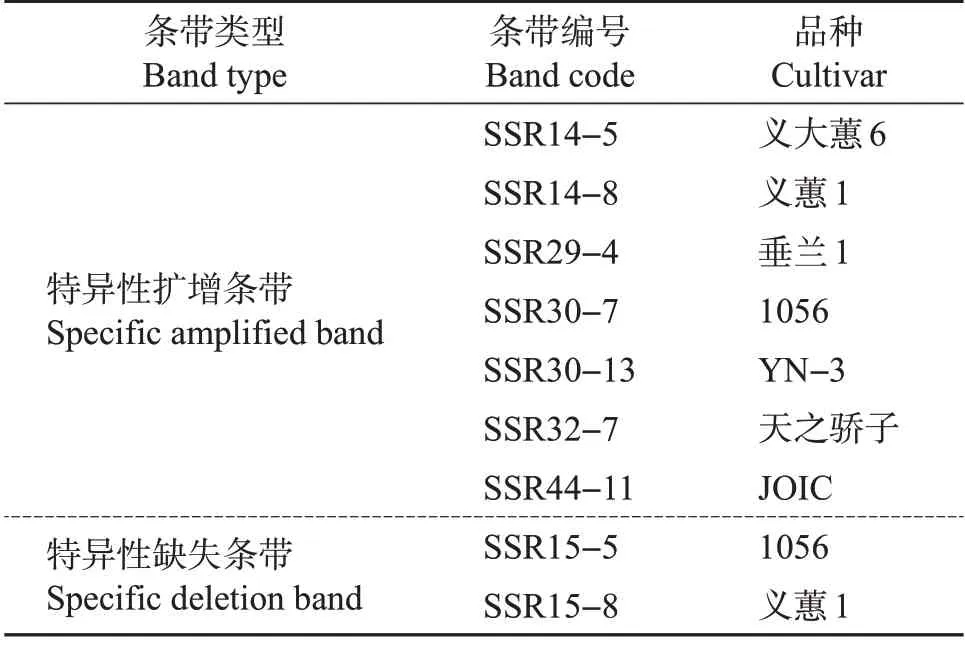
表4 部分品种显示的特异性SSR条带Table 4 Specific SSR bands showed in some cultivars
2.4 遗传多样性与亲缘关系聚类分析
对41 份大花蕙兰材料的聚类分析结果见图2。参试的41 份大花蕙兰材料的遗传相似系数为0.57~0.99,大部分品种间的遗传相似系数在0.60~0.80之间,平均值为0.72。其中,遗传相似系数最高的是YN−4−4(33 号)与YN−4−2(35 号),最低的是1056(9号)与义蕙3(16号)。上述结果表明,多数大花蕙兰品种间表现出一定的遗传相似性,少数品种间存在较大的遗传差异。本试验检测到的遗传相似系数变化范围相对较大,说明所分析的41份材料具有较丰富的遗传多样性。
从图2中可知,在遗传相似系数0.71处,可将供试材料分为5个类群:A类群只含1个大花蕙兰材料1056;B 类包括3 份材料,如义大蕙5(4 号)、垂兰1(25 号)、义大蕙6(31 号);C 类和D 类各包含5 份材料;E类所包含的材料较多,共有27份,其在遗传相似系数0.75 水平上又可以进一步分为3 个亚类,分别包含9、4和14份材料。对照表1中各材料的3个主要形态特征可以看出,SSR 标记聚类分析的结果与形态指标能较好地吻合。
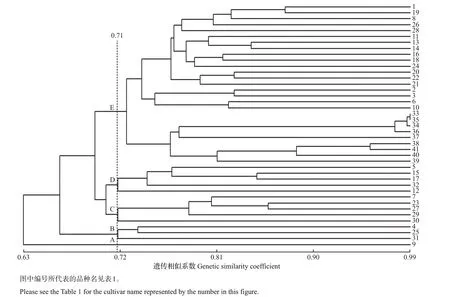
图2 依据UPGMA建立的41份种质的聚类图Fig.2 Dendrogram constructed for 41 germplasms based on UPGMA
3 讨论
3.1 分子标记与大花蕙兰资源分析
分子标记已成为种质资源分析与评价的重要手段。在大花蕙兰中,有研究者已采用不同的分子标记进行了相关研究。其中,报道较多的是RAPD 标记,如甘娜等[4]、李冬梅等[5]、施隆文等[6]、孙彩云等[7]及OBARA-OKEYO 等[8]都曾将RAPD 标记应用于大花蕙兰的资源分析,结果显示,RAPD标记能对大花蕙兰品种进行明显地区分,可以揭示不同大花蕙兰材料间的遗传相似性、多样性和亲缘关系。朱根发等[3]用AFLP标记以及马红勃等[9]用SRAP标记对大花蕙兰品种资源进行的分析也获得了类似的结果。
SSR 标记具有稳定性高、共显性遗传和较强的品种鉴别力等优点[11,15],已在兰属植物中得到广泛应用。在大花蕙兰中,MOE等[16]利用春兰基因组富集基因文库开发了14 对SSR 引物,研究了包含72 份春兰、4 份墨兰、20 份大花蕙兰的遗传多样性;孙叶等[17]利用春兰和大花蕙兰杂交种的转录组测序数据开发了200对SSR标记引物,并用其中的20个标记对11 份大花蕙兰资源以及它们的F1代的亲缘关系进行了分析。但前面这些研究均侧重于研究种群之间的关系,而不是对大花蕙兰种内资源的遗传变异评价,且所分析的大花蕙兰资源数目有限。在蕙兰中,尚无利用转录组数据开发genic−SSR的报道,利用SSR 标记进行大花蕙兰种内资源的遗传多样性和亲缘关系的分析也未见报道。本研究从蕙兰转录组序列中开发genic−SSR标记并将其应用于大花蕙兰的资源分析,结果表明,genic−SSR一方面揭示了参试材料较为丰富的遗传多样性,另一方面也显示出所用SSR标记具有较强的品种鉴别能力,同时也准确地反映出材料间的亲缘关系,例如,YN−4−2、YN−4−4、YN−4−5、YN−4−6是从同一杂交组合中选育的,在聚类图中也显示出非常近的亲缘关系,并与来自云南的大花蕙兰品种YN−1、YN−2、YN−2−2、YN−3 共同聚在大花蕙兰E 类分类的一个亚类中。
与以往大花蕙兰资源分析中所使用的RAPD、AFLP和SRAP等标记不同,本研究所采用的SSR标记是基于蕙兰转录组序列开发的。基于表达或转录组序列可开发出多种类型的分子标记[12−13,21],SSR就是其中之一。目前,在NCBI 数据库中已收录了大花蕙兰和蕙兰的转录组序列。其中,大花蕙兰的转录组(PRJNA165853)测序的总碱基数为4.9 Gbp,而蕙兰转录组(PRJNA281138)测序的总碱基数达到19.8 Gbp,显然后者的容量更大,从而容易挖掘出类型更丰富的SSR。大花蕙兰的转录组序列来源于共生根,蕙兰转录组序列则来自叶片,对于观赏植物来说,根据地上部器官的表达序列开发的标记显然更具应用潜力。鉴于这2方面的原因和来自表达序列标记的通用性,本研究基于蕙兰转录组数据开发了genic−SSR 标记,并将其用于大花蕙兰种内遗传多样性的评鉴和亲缘关系的分析。这种SSR 标记除具有一般分子标记的特点外,还有特殊优势。首先,它来自已知的表达基因序列,可提供的遗传信息量大。利用这种标记分析是对表达基因变异的直接评价,一旦确认标记与某一性状连锁,那么其来源的序列就可能与控制此性状的基因相关,其所在的基因以及相关信息也有助于了解此基因与表现型的内在联系[22−23]。其次,它来自保守性较高的表达序列,具有较好的可转移性[12−13,24],不但可以用于种内不同品种间的遗传多样性评价,而且可直接用于种间的遗传多样性比较。
尽管本研究所用引物是严格按照标准设计合成并采用了温度梯度测试,但仍有少部分引物(约19%)无扩增产物,这与其他物种中对基于表达基因序列设计的引物研究结果[25−26]类似。其原因可能有:1)引物横跨2 个外显子,导致与DNA 模板不匹配;2)扩增区域内存在较大的内含子,导致引物间目标区段较长而无法扩增;3)蕙兰与大花蕙兰间基因组序列存在差异而导致引物难以结合。
3.2 基于标记的聚类与形态分类
在大花蕙兰种质资源的收集、分类整理、评价及资源数据库构建中,形态学指标一直作为一类重要的依据,也是利用生物技术加快大花蕙兰遗传改良的基础。在自然进化和人工改良的过程中,大花蕙兰形成了不同的外观形态,根据不同的形态性状,如花色、花枝、开花时间等的不同而有不同的分类结果。例如,大花蕙兰按花色可分为红−粉红花系、白花系、黄花系、绿花系和奇花系等,按花枝着生的角度可分为直立型和下垂型,按花期可分为早花型、中花型和晚花型等[27]。
利用分子标记进行种质资源分析,不受环境影响且相对较稳定。在大花蕙兰中,已开展了基于RAPD、AFLP 和SRAP 等标记的资源聚类分析。OBARA-OKEYO 等[8]利用RAPD 分析法对36 个大花蕙兰栽培种进行了聚类分析,所揭示的亲缘关系与同工酶分析结果相吻合,但与按农艺性状分类的结果不一致。朱根发等[3]对来源于不同国家的42个大花蕙兰品种进行了AFLP 分析,聚类结果与根据形态指标分类的结果相吻合,即来源于相同地域甚至相同育种单位的品种基本上能聚类在一起。李冬梅等[5]利用RAPD 标记揭示了,大花蕙兰种质间的遗传亲缘关系与其花枝类型、花径大小或花色等形态指标分类的结果相吻合。马红勃等[9]利用SRAP标记的聚类分析也得出相近的结果。这些报道的结果表明,利用分子标记可以对大花蕙兰的种质进行有效地分类。与这些结果类似,在本研究中,采用genic−SSR 标记聚类,得出A 类只有1 份材料1056,其株型披散,主花色为红色,植株高大,与其他品种具有明显的差异;B类有3份材料,分别是义大蕙5、垂兰1和义大蕙6,它们在株型上一致,均为披散型,植株中−大型,且花色均较深;聚在C 类的5 个品种均为中型植株,绿色花,直立−半直立株型;而聚在D 类的5 个品种为半直立−披散株型,植株中小型,花色较浅。这一聚类结果与形态类别具有较高的吻合度。
目前,大花蕙兰的形态分类只是基于单个或少数的形态指标,而形态学指标的数量有限,也易受环境条件和数据采集过程中人为因素等的影响,某些情况下形态特征并不能完全真实地反映遗传多样性。采用分子标记技术能对品种资源进行有效地鉴定和分类,可从基因组水平上全面评价资源的遗传变异与多样性,但基于标记的分类结果与形态聚类结果不可能完全吻合。在上述相关报道中,基于标记分析所建立的个别类群或亚类中存在不同形态类别的混聚。本研究中也存在类似情形,如E类中各品种的植株大小、株型及花色等外观形态并不一致。整体来看,基于标记聚类的结果与形态分析的结果具有一定的相关性,但又有差异,这些差异对基于分子标记的大花蕙兰种质资源遗传多样性评价具有补充和辅助作用。
4 结论
本研究根据蕙兰转录组序列设计SSR引物,从中筛选了25对SSR标记对41份大花蕙兰资源进行了分析。结果表明:平均每对SSR 标记可扩增6.84条多态性条带,多态性比率为91.44%;平均每对SSR标记揭示的多态性信息含量和基因型数分别为0.770 3和12.88。41份大花蕙兰种质资源之间的遗传相似系数为0.57~0.99,可分为5 类,分类结果与植株大小、花枝类型及花色等性状具有一定程度的吻合性。这些新开发的SSR 标记可为大花蕙兰分子育种提供有用的工具,其应用的结果也较好地揭示了大花蕙兰品种间的遗传多样性与亲缘关系,可为大花蕙兰种质资源利用及杂交育种中亲本选择提供科学依据。

