匹伐他汀对合并脂代谢异常的稳定型冠心病患者HDL-C水平及功能的影响
王会娟,王继红,赵兴山,刘 巍
(北京积水潭医院 心内科,北京 100096)
高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平与冠状动脉疾病的发病风险呈一种显著的负相关趋势,即使在强化他汀(statins)治疗使LDL-C达标后,这种负相关作用依然存在[1]。HDL-C发挥心血管保护作用的主要机制为胆固醇的逆转运(reverse cholesterol transport RCT),即将周围血管壁巨噬细胞中的胆固醇转运至肝脏,从而排出体外的过程[2]。此外,HDL-C还具有抗氧化、抗感染、抗凋亡、抗栓等多种抗动脉粥样硬化作用[3]。他汀类药物均具有显著降低低密度脂蛋白胆固醇(LDL-C)水平的作用,但升高HDL-C水平的作用却存在很大差异。目前的多项研究显示,与其他类型的他汀类药物相比,匹伐他汀(pitavastatin)升高HDL-C的作用更为显著[4]。但关于匹伐他汀对HDL-C功能的研究却鲜有报道。基于上述研究现状,本研究通过检测匹伐他汀对HDL-C胆固醇外流功能以及抗氧化因子对氧磷酶1(paraoxonase-1, PON-1)的影响,从而探索匹伐他汀的多效性抗动脉粥样硬化作用。
1 材料与方法
1.1 材料
1.1.1 研究对象:选取2018年1月至2020年1月就诊于北京积水潭医院心内科门诊及病房的合并脂代谢异常的稳定型冠心病患者60例,纳入标准包括:1)经冠状动脉造影证实或既往存在心肌梗死病史的稳定型冠心病患者;2)年龄≥18岁;排除标准:1)肝、肾功能异常者;2)甲状腺疾病及甲状腺药物应用史;3)妊娠;4)严重心力衰竭、感染、电解质紊乱。上述所有患者签署知情同意书,经北京积水潭医院伦理委员会批准(批准号:201803-05)。符合上述标准的受试者随机分为两组,一组予以匹伐他汀(pitavastatin)2~4 mg/d,另一组予以阿托伐他汀(atorvastatin)10~20 mg/d,观察治疗6个月,调整他汀剂量使LDL-C达标(<70 mg/dL)。
1.1.2 试剂与细胞:胎牛血清、RPMI1640培养基(Gibco公司);PCR引物(上海生工生物工程公司); Trizol(TaKaRa公司);qPCR检测试剂盒(DBI公司);3H-胆固醇油酸酯(GE公司);20%的聚乙二醇、对氧磷、苯乙酸酯(Sigma-Aldrich公司);急性单核细胞白血病细胞系THP-1(由中国医学科学院基础所免疫学系免疫学实验室友情提供)。
1.2 方法
1.2.1 脂代谢指标的检测:分别于治疗前、治疗后6个月抽取外周静脉血10 mL,应用湿化学法进行各项脂代谢指标检测,包括:LDL-C、HDL-C、TG、apoA-1和apoB等。
1.2.2 细胞的培养: THP-1细胞在含有20%胎牛血清(FBS)与100 μg/mL青链霉素的RPMI-1640培养基中培养,经0.4 μmol/L的PMA孵化48 h分化为巨噬细胞,用油红O染色及CD68免疫组化染色鉴定巨噬细胞。
1.2.3 聚乙二醇(PEG)-HDL的制备:血清标本与20%的PEG溶液按100∶40的比例混合,在200 mmol/L的甘氨酸缓冲液中在室温下共同孵育15 min,4 000 r/min离心20 min,使含有apoB的脂蛋白沉淀,获得上清液(PEG-HDL)备用。
1.2.4 胆固醇外流率的测定:THP-1巨噬细胞加入3.7×104Bq/mL[1 ci(居里)=3.7×1010Bq(贝可勒尔)]的3H胆固醇孵育液,37 ℃孵育24 h,同步化2 h,分别以PEG-HDL、apoA1及自身血清为接受体,观察胆固醇外流率的变化。具体方法如文献[5]所述。
1.2.5 氧磷酸1(PON-1)活性的测定:以PEG-HDL作为HDL相关性PON-1活性酶测定的反应物,以对氧磷和苯乙酸酯为底物,用分光光度法检测对氧磷酶与芳基酯酶两种酶活性。具体方法如下:对氧磷酶活性测定:应用对氧磷作为底物,以100 mmol/L Tris-Cl缓冲液(pH 8.5)建立200 μL的分析体系,包含2 mol/L NaCl和2 mmol/L CaCl2,1.2 mmol/L对氧磷,加入20 μL PEG-HDL。在25 ℃下,利用酶标仪在405 nm处连续扫描记录5 min内产物生成速率。酶活性以μmol/(min·L)表示 1个PON-1酶活性单位值(U)。芳基酯酶活性测定:通过苯乙酸酯水解为苯酚的速率来进行测定,以20 mmol/L Tris缓冲液制成200 μL体系,包括:5 μL PEG-HDL样品,1 mmol/L苯乙酸酯,0.9 mmol/L Cacl2(pH 8.0)。上述反应在37 ℃下,用酶标仪在260 nm处连续扫描5 min。酶活性以μmol/(min·L)表示1个PON-1活性单位。
1.3 统计学分析

2 结果
2.1 两组患者治疗前后血脂水平变化比较
两组患者基线资料差异无统计学意义。治疗后,两组患者的LDL-C水平均有显著下降(P<0.05)。HDL-C水平在匹伐他汀组治疗后较治疗前升高了9.0%,而阿托伐他汀组仅升高了1.8%(表1)。

表1 治疗前后血脂水平比较
2.2 胆固醇外流率变化
2.2.1 PEG-HDL介导的胆固醇外流率:PEG-HDL介导的胆固醇外流率在匹伐他汀组治疗后较治疗前显著增加(P<0.001),而阿托伐他汀组治疗前后则差异无统计学意义(图1A)。
2.2.2 ApoA1及自身血清介导的胆固醇外流:两组患者治疗前后apoA1介导的胆固醇外流率差异均无显著性(图1B)。自身血清介导的胆固醇外流率在匹伐他汀治疗后较治疗前显著增加(P<0.01);而阿托伐他汀治疗前后差异则无显著性(图1C)。

A.cholestrol efflux to PEG-HDL before and after statin treatment; B.cholestrol efflux to apoA1 before and after statin treatment; C.cholestrol efflux to auto-serum before and after statin treatment; *P<0.01 compared with pre-treatment
2.3 氧磷酶1(PON-1)酶活性水平的变化
PON-1酶活性水平(包括对氧磷酶和芳基酯酶)治疗前后在匹伐他汀和阿托伐他汀两组中均有显著升高。匹伐他汀组,对氧磷酶和芳基酯酶活性水平较治疗前分别增加了21%和18%(P<0.001);阿托伐他汀治疗组,对氧磷酶和芳基酯酶活性分别增加了24%和17%(P<0.001)(图2)。
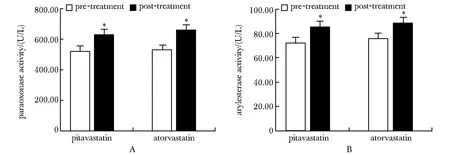
A.paraoronase activity of pre-and post-statin treatment; B.arylesterase activity of pre-and post-statin treatment;*P<0.001 compared with pre-treatment
3 讨论
本研究在合并脂代谢异常的稳定型冠心病患者中观察到,匹伐他汀可使患者HDL-C水平显著升高,而阿托伐他汀治疗对HDL-C水平则无显著影响,这与之前的研究结果相一致[6]。匹伐他汀具有更广的降脂作用谱(不仅作用于含apoB的脂蛋白,还作用于含apoA的脂蛋白),能够刺激肝细胞apoA1的合成与分泌,从而导致HDL-C合成增加[7]。此外,匹伐他汀可通过诱导肝细胞ATP结合盒转运蛋白A1(ATP-binding cassette transporter A1 ABCA1)的表达,使肝细胞内胆固醇外流至apoA1,从而使HDL-C合成增加[8]。
尽管大量研究结果显示血浆 HDL-C水平与冠心病发病风险呈负相关,但HDL是一类异质性脂蛋白,不同HDL亚组分的组成、形状大小、密度、电荷和抗动脉粥样硬化特性等方面均不相同[9],因此近年的研究认为,除了HDL-C水平检测,针对HDL功能的评价指标将对冠心病的风险评估具有更重要的价值。本研究在观察到匹伐他汀升高HDL-C的基础上进一步探索了HDL-C功能的变化。结果发现,匹伐他汀治疗6个月使HDL介导的胆固醇外流率显著增加,同时,作为HDL-C相关的抗氧化因子PON-1活性水平也存在显著升高。
胆固醇逆转运是HDL-C发挥抗动脉粥样硬化作用最重要的机制之一。在胆固醇逆转运过程中,胆固醇外流是其中的限速步骤,多种转运蛋白及分子参与了这个复杂的过程。本研究发现HDL介导的胆固醇外流率在匹伐他汀治疗组显著增高,提示匹伐他汀升高HDL-C水平的同时,使HDL-C的胆固醇外流功能得到改善,这与之前的研究结果是一致的[10]。
除了胆固醇外流功能外,抗氧化功能是HDL-C的另一项重要的抗动脉粥样硬化机制。PON1是循环中与HDL紧密结合的一种钙依赖性酯酶,是HDL抗氧化活性的最重要的成分之一。PON-1具有对氧磷酶活性,通过抑制LDL的氧化修饰发挥抗氧化作用,此外,PON-1还具有磷脂酶活性,通过水解氧化磷脂(致炎因子),使细胞间黏附分子-1(ICAM-1)表达水平下降,从而发挥抗炎作用[11]。与之前的研究相一致,本研究发现,无论是匹伐他汀还是阿托伐他汀,均可导致PON-1水平增高,而这一HDL-C相关性的抗氧化作用可能是他汀类药物的类效应[12]。
综上所述,匹伐他汀治疗不仅能使HDL-C水平升高,而且使HDL-C的胆固醇外流功能及抗氧化功能也得到保留和改善。本研究也存在一定局限与不足,样本量偏小,治疗时间相对较短,研究结果还需要为更多的研究所证实。

