LRCH1维持狼疮肾炎模型小鼠调节性T细胞的功能
覃智慧,谭德敏,王旺珍,张 瑶
(湖北民族大学附属民大医院 肾病内科, 湖北 恩施 445000)
狼疮肾炎(lupus nephritis)就是系统性红斑狼疮(systemic lupus erythematosus,SLE)肾损伤的临床表现,是机体的自身抗体形成免疫复合物后所引发的肾脏炎性反应[1]。调节性T细胞(regulatory T cells, Tregs)是维持免疫耐受和自身免疫平衡的关键细胞,通过抑制自身免疫中的T细胞活化可防止自身免疫病的发生[2]。在MRL/lpr SLE模型小鼠中Tregs功能活跃[3],上调Tregs的功能可以减轻狼疮肾炎的进展[4],但SLE过程中影响Tregs功能的机制尚未完全明确。本研究在MRL/lpr狼疮肾炎模型小鼠中研究富含亮氨酸的重复序列和钙调理蛋白同源域1(leucine rich repeats and calponin homology domain containing 1,LRCH1)在Tregs内的表达和功能,从而揭示狼疮肾炎的进展机制。
1 材料及方法
1.1 材料
1.1.1 实验动物:SPF级SLE模型小鼠MRL/lpr(6月龄)和C57BL/6(6月龄)小鼠(南京大学模式动物实验平台),绿色荧光蛋白(GFP)转基因小鼠(C57BL/6背景)(赛业生物模式动物中心)。
1.1.2 试剂及试剂盒:Hank’s平衡盐溶液(HBSS)和红细胞裂解液和RIPA裂解液(Thermo Fisher Scientifical公司);RPMI1640培养基(Gibco公司);胶原酶 D(Roche Diagnostics公司);DNA酶Ⅳ(Sigma-Aldrich公司);流式抗体:FITC-CD45、APC/Cy7-CD、APC-CD25、PE-CD127和FOXP3 Fix/Perm Buffer Set(Biolegend公司);Trizol(上海闪晶分子生物科技有限公司);BeyoRTTMcDNA试剂盒和BeyoFastTMSYBR Green qPCR Mix(上海碧云天生物技术公司);EasySepTM小鼠CD4+CD25+调节性T 细胞分选试剂盒Ⅱ(Stemcell Technologies公司);抗p-STAT5和STAT5抗体(Cell Signaling Technology公司);辣根过氧化物酶标记的羊抗兔IgG(Biolegend公司);白细胞介素2(Interleukin-2,IL-2,上海沪震生物科技公司);抗CD3抗体和CD28抗体(eBioscience公司);羧基荧光素二醋酸盐琥珀酰亚胺酯(carboxyfluorescein succinimidyl ester,CFSE,北京诺为生物技术公司)。
1.2 方法
1.2.1 制备单细胞悬液:断椎处死小鼠后,40 mL冰预冷的HBSS 从心尖灌注小鼠。研磨脾脏至单个细胞悬液。1 mL红细胞裂解液重悬细胞3 min。离心洗涤后用冰预冷的0.02%自制磷酸盐缓冲液重悬细胞。去除肾脏包膜,剪成约1 mm×1 mm×1 mm组织块,用3 mL含1 600 kU/mL 胶原酶 D 和浓度为0.2 g/L DNA酶 Ⅳ 的RPMI1640培养基于37 ℃ 孵育30 min后,按照脾脏单细胞悬液的制备方法进行处理。
1.2.2 流式细胞测量术检测L细胞表面标志染色:200 μL PBS重悬1×106个细胞,一抗冰上孵育30 min,洗涤重悬后行流式细胞仪检测。抗体均为2 μg/mL。Foxp3染色:FOXP3 Fix/Perm Buffer Set说明书进行固定、破膜、染色和检测。
1.2.3 实时定量PCR(RT-qPCR)检测:用Trizol提取细胞RNA。用BeyoRTTMcDNA试剂盒合成cDNA。cDNA与BeyoFastTMSYBR Green qPCR Mix混合后放入7500荧光定量PCR仪50 ℃加热2 min,95 ℃预变性5 min;95 ℃变性30 s,62 ℃退火15 s,75 ℃延申15 s,40个循环。2-ΔΔCt方法计算基因的相对表达量。引物序列见表1。

表1 RT-qPCR引物序列
1.2.4 过继输注:制备GFP转基因小鼠脾脏单细胞悬液,用EasySepTM调节性T 细胞分选试剂盒Ⅱ分选CD4+CD25+T细胞。将2×106CD4+CD25+T细胞重悬于100 μL PBS,经眼球后静脉注射到C57BL/6小鼠或MRL/lpr小鼠体内。对照组输注PBS。1周后处死受者小鼠进行检测。
1.2.5 免疫印迹(Western blot)检测蛋白:RIPA裂解液冰上裂解细胞30 min提取蛋白。常规电泳、转膜和封闭后与一抗(1∶1 000)4 ℃反应过夜。二抗(1∶2 000)孵育1 h。ODYSSE红外成像仪扫膜,测定条带吸光度值并计算相对表达量。
1.2.6 CD4+CD25+T细胞培养 按上述方法分选C57BL/6小鼠的CD4+CD25+T细胞,流式细胞测量术验证细胞纯度为92.44%。Tregs的培养和siRNA转染按照文献方法[5]。转染48 h后进行检测。LRCH1 siRNA(正向引物:5′-CAGCUAGUGAUACUU CCUAUCAUGT-3′;反向引物:5′-ACAUGAUAGGAA GUAUCACUAGCUGCC-3′)和阴性对照siRNA(可参1.1.2)。为检测IL-2信号途径的活化,转染48 h后加入500 μL RPMI1640培养基孵育6 h,加入100 U/mL IL-2处理细胞10~20 min。
1.2.7 流式细胞测量术检测CD4+CD25-T细胞的增殖 从6月龄的MRL/lpr小鼠与C57BL/6小鼠收集脾脏和肾脏内的单个核细胞,依次识别淋巴细胞和CD45+CD4+T细胞,继而识别并分选CD45+CD4+CD25+CD127lowT细胞(图1A)。
96孔板(Corning)用5 μg/mL CD3抗体4 ℃包被过夜。用调节性T细胞分选试剂盒Ⅱ阴性分选C57BL/6小鼠脾脏CD4+CD25-T细胞并用5 μmol/L MCFSE进行标记。用含4 μg/mL CD28抗体和200 U/mL IL-2的RPMI1640培养基调节细胞为1×106/mL,接种至96孔板,每孔100 μL。4 h后每孔加入1×105Tregs,共同培养72 h后用流式细胞术测量检测。
1.3 统计学分析
2 结果
2.1 MRL/lpr小鼠肾脏Tregs高表达LRCH1
与C57BL/6小鼠的CD45+CD4+T细胞相比,两种小鼠的脾脏和肾脏CD45+CD4+CD25+CD127lowT细胞均高表达Foxp3(图1B),确定该群细胞为Tregs。与其他组细胞相比,MRL/lpr小鼠肾脏Tregs高表达LRCH1 mRNA(图1C)。

A:gating and sorting of CD45+CD4+CD25+CD127low T cells from mouse spleens and kidneys, B6-S.C57BL/6 mouse spleen, B6-K.C57BL/6 mouse kidney, Lpr-S.MRL/Lpr mouse spleen, Lpr-K.MRL/Lpr mouse kidney; B:Foxp3 mRNA levels in sorted CD45+CD4+CD25+CD127low T, the mouse splenic CD4+ T cells(B6-CD4)were used as control,*P<0.01 compared with B6-CD4 group; C:LRCH1 mRNA levels in sorted CD45+CD4+CD25+CD127low T cells, 2m.2-month-old mice, 6m.6-month-old mice, *P<0.01 compared with B6-S group
2.2 MRL/lpr小鼠肾脏局部环境诱导LRCH1在Tregs 的表达
检测受者小鼠脾脏和肾脏内过继输注的外源性GFP+Tregs(图2A),只有MRL/lpr小鼠肾脏GFP+细胞中LRCH1的表达上调(图2B)。与野生型小鼠GFP+细胞相比,MRL/lpr小鼠脾脏和肾脏内的GFP+细胞IL-10上调(interleukin-10,IL-10)、TGF-β(transforming growth factor beta,TGF-β)(图3A)和CD25表达均上调(图3B)。
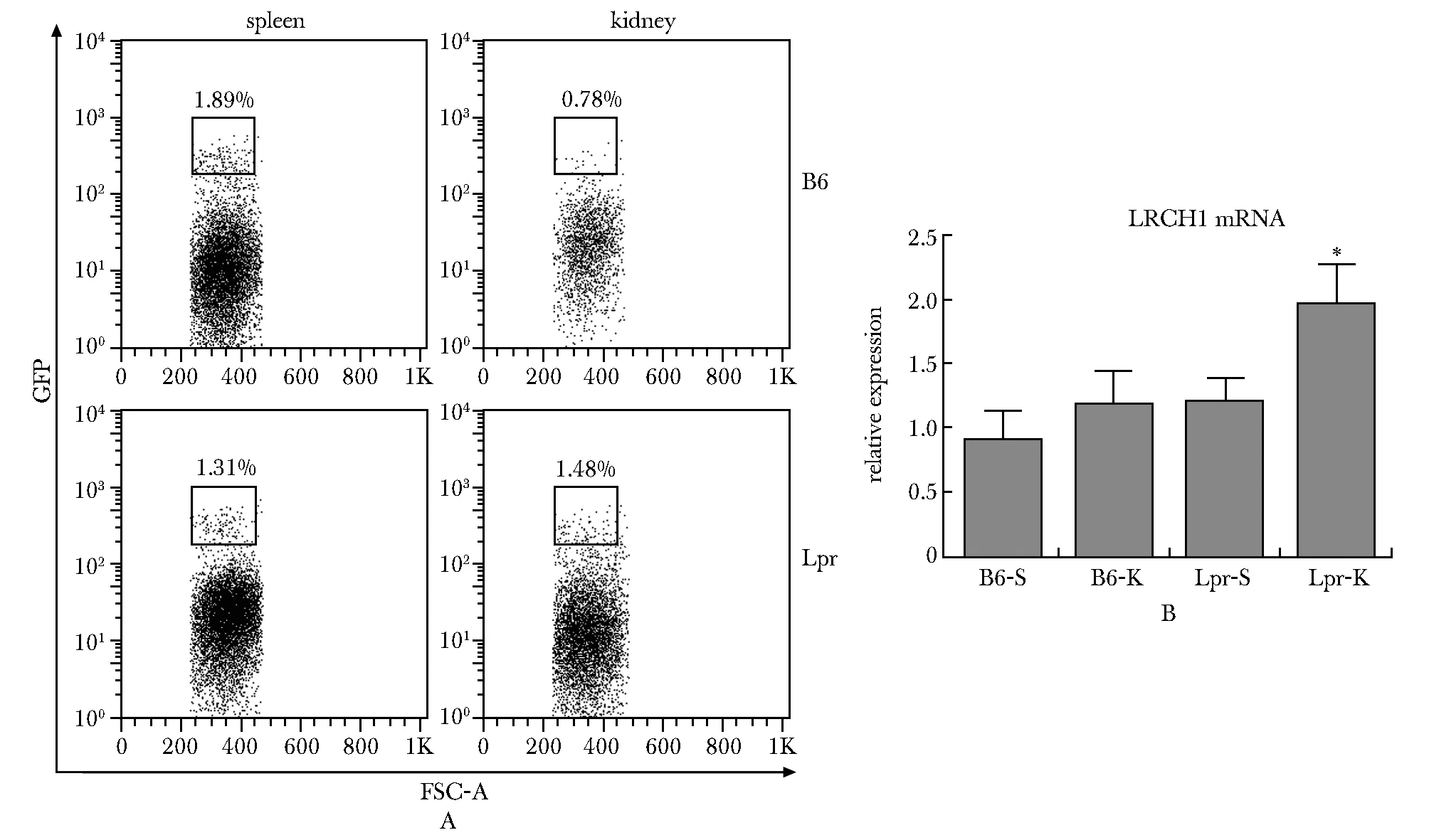
A:gating and sorting of GFP+ cells from mouse spleens and kidneys, B6.C57BL/6 mice, Lpr.MRL/Lpr mice;B:LRCH1 mRNA levels in sorted GFP+ cells, B6-S.spleens of recipient C57BL/6 mice, B6-K.kidneys of recipient C57BL/6 mice, Lpr-S.spleens of recipient MRL/Lpr mice, Lpr-K.kidneys of recipient MRL/Lpr mice; *P<0.05 compared with B6-S group

A.mRNA levels of IL-10 and TGF-β in GFP+ cells(n=8); B.expression of CD127 and CD25 on the surface of GFP+ cells; *P<0.05,**P<0.01, ***P<0.001 compared with B6-S group
2.3 LRCH1维持Tregs的免疫抑制功能
转染LRCH1 siRNA的CD4+CD25+Tregs,LRCH1的表达降低(图4A)。在无IL-2的培养环境中,Tregs的Foxp3表达显著下降,而IL-2可有效维持Foxp3的表达(图4B,C)。Lrch1敲低后即使IL-2存在,Foxp3的表达也显著降低(图4B,C)。Lrch1敲低的Tregs不能有效抑制CD4+CD25-T细胞的增殖,表现为CD4+CD25-T细胞的CFSE荧光显著降低(图4D)。
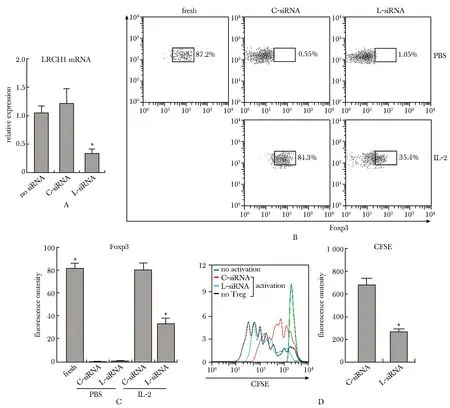
A:LRCH1 mRNA levels in Tregs 48 hours after siRNA transfection, No siRNA.Tregs treated with Lipofectamine 2000 only, C-siRNA.Tregs transfected with scramble control siRNA, L-siRNA.Tregs transfected with LRCH1 siRNA(n=6);B.representative plots showing Foxp3 staining in transfected Tregs, Fresh.freshly sorted Tregs, C-siRNA PBS.Tregs transfected with scramble control siRNA were treated with PBS, L-siRNA PBS.Tregs transfected with LRCH1 siRNA were treated with PBS, C-siRNA IL-2.Tregs transfected with scramble control siRNA were treated with IL-2, L-siRNA IL-2.Tregs transfected with LRCH1 siRNA were treated with IL-2; C.statistical analysis of the fluorescence intensity of Foxp3 in Tregs(n=8); D.proliferation of CD4+CD25-T cells, Left panel.histograms of CFSE intensities in CD4+CD25-T cells, Right panel.statistical analysis of CFSE intensities, No activation.CFSE-labeled CD4+CD25-T cells without activation, C-siRNA activation.CFSE-labeled CD4+CD25-T cells activated by CD3 antibody and CD28 antibody in the presence of Tregs transfected with scramble control siRNA, L-siRNA activation.CFSE-labeled CD4+CD25-T cells activated by CD3 antibody and CD28 antibody in the presence of Tregs transfected with LRCH1 siRNA, No Treg activation.CFSE-labeled CD4+CD25-T cells activated by CD3 antibody and CD28 antibody in the absence of Tregs(n=6); *P<0.001 compared with C-siRNA
2.4 LRCH1维持IL-2信号转导的活化
如图5,IL-2处理20 min后,L-si RNA组Tregs内p-STAT5水平较C-siRNA降低;而在Lrch1敲低的Tregs内,p-STAT5水平受到抑制(图5)。

A:Western blot images showing phosphorylated STAT5 in C57BL/6 mouse splenic Tregs after IL-2 treatment for different time intervals, C-siRNA.Tregs transfected with scramble control siRNA, L-siRNA.Tregs transfected with LRCH1 siRNA;B:statistical analysis of STAT5 phosphorylation level relative to the group of IL-2 treatment for 0 min(n=5); *P<0.01 compared with L-siRNA
3 讨论
以往研究提示系统性红班狼疮(SLE)患者存在外周血Tregs数量减少、Foxp3表达降低或分泌的细胞因子异常[6-7]。本研究首次揭示了LRCH1对Tregs功能的影响。MRL/lpr小鼠肾脏局部环境诱导LRCH1在Tregs的表达增高,但具体是何种因子尚不清楚。Lrch1的启动子区域含有AhR、Arnt、Cart-1、FOXJ2、等转录因子的结合位点(https://www.genecards.org/cgi-bin/carddisp.pl?gene=LRCH1)。本研究团队下一步的研究将围绕这些转录因子所参与的信号途径来揭示LRCH1表达的调控机制。有证明在溃疡性结肠炎,LRCH1抑制CD4+T 细胞的迁移[8]。虽然本研究未检测Tregs的迁移,但今后也将对此做进一步的探讨。
本研究提示LRCH1对Tregs的功能起正调控作用,基因敲除实验显示LRCH1通过维持IL-2信号途径的活化从而稳定Foxp3的表达,继而维持Tregs的免疫抑制功能,使Tregs能够通过分泌IL-10和TGF-β等免疫抑制分子减轻自身免疫反应和炎性反应。以往有报道显示,LRCH1缺失可促进CD8+T细胞活化连接蛋白(linker for activation of T-cell,LAT)信号传导及CD8+T细胞的抗病原和抗肿瘤应答[9],可见在不同的细胞类型LRCH1的作用效果可以是截然相反的,提示有可能是因为LRCH1参与了不同的信号途径。此外,LAT信号途径对Tregs的功能十分重要[10],因此,将来也应该检测LRCH1对Tregs内LAT信号途径的影响。
综上所述,LRCH1是狼疮肾炎浸润性Tregs的重要调控分子。对LRCH1的研究为临床上理解狼疮肾炎的进展机理和制定治疗方案提供了新的思路。

