奶牛乳房炎源金黄色葡萄球菌溶原性噬菌体的诱导及其裂解能力分析
常军帅,张琪,程露露,屈勇刚,梁晏,李娜,张小玉,李彦芳
(1.石河子大学动物科技学院,石河子 832003;2.动物疾病防控兵团重点实验室,石河子 832003)
乳房炎在全球奶牛场中最为常见且治疗成本也最高,临床型乳房炎所导致的乳区疼痛严重损害了奶牛的卫生福利[1,2]。乳房炎主要是由病原菌感染引起的,最常见的病原菌为金黄色葡萄球菌、无乳链球菌、化脓性链球菌、大肠杆菌、肺炎克雷伯菌和巴氏杆菌等[3,4]。其中金黄色葡萄球菌(Staphylococcus aureus)是最常见的分离菌之一,也是造成乳制品行业重大经济损失的主要病原体[5]。研究发现,致病性金黄色葡萄球菌通常含多种毒力基因、耐药基因,这些基因的存在导致了乳房炎易发、频发、久治不愈[6,7]。噬菌体是一种细菌病毒,根据其侵染宿主菌的生命周期不同,分为烈性噬菌体和溶原性噬菌体。烈性噬菌体只能通过裂解性循环方式进行基因组的复制和子代噬菌体的释放,在短时间内就可导致宿主菌裂解;温和噬菌体在紫外线、电离辐射等干扰因素的影响下则可以进行溶原性循环,受影响后则开始裂解性循环。前噬菌体(prophage)为溶原性噬菌体整合入溶原菌体内的基因,广泛存在于细菌体内,可通过转化、接合转移和转导等形式增强其宿主溶原菌的毒力基因与耐药基因[8~10]。部分金黄色葡萄球菌溶原性噬菌体可编码肠毒素A、肠毒素P、表皮剥脱毒素A、潘顿-瓦伦丁杀白细胞毒素等毒力基因,使其宿主菌产毒[8,11];金黄色葡萄球菌的耐药性转导较为常见,溶原性噬菌体φ11、φ80和φ80α可对携带mecA基因的I型SCCmec遗传元件进行包装,从而导致mecA基因在金黄色葡萄球菌中广泛传播,噬菌体φ80α在促进金黄色葡萄球菌流行株USA300获得青霉素、四环素类耐药基因中也起着积极作用[12,13]。溶原性噬菌体也可通过上调其寄主细菌的应激相关基因、细胞壁合成等基因,来增强溶原菌对不同环境的抵抗力,提高了溶原菌在环境中的丰度,防止自身过快灭绝,从而达到互惠互利的关系[14]。
综上所述,奶牛乳房中溶原性噬菌体的出现将可能导致乳房炎的发生,研究金黄色葡萄球菌溶原性噬菌体对防治乳房炎具有重要意义。因此,对乳房炎奶样中金黄色葡萄球菌使用不同方法诱导溶原性噬菌体产生,可为揭示该地区金黄色葡萄球菌溶原性噬菌体存在情况提供参考,也可为进一步研究临床型乳房炎微生态系统中调节的机制提供帮助。
1 材料
1.1 样品
经临床检查乳房是否红、肿、热、痛及乳汁颜色、质地等检测结果为临床型乳房炎的45份奶牛乳样。
1.2 菌株
本试验所用的链球菌菌株(L2、L3)、大肠杆菌菌株(G5、G37)及金黄色葡萄球菌阳性对照菌株(PC2)均由石河子大学动物科技学院传染病实验室分离鉴定。
1.3 仪器与试剂
全自动酶标仪购自赛默飞世尔科技公司;恒温培养箱、恒温震荡培养箱购自上海一恒科学仪器有限公司;生物显微镜购自Olympus有限公司;细菌基因组 DNA提取试剂盒购自天根生化科技(北京)有限公司;LB肉汤培养基购自海博生物技术有限公司;甘露醇氯化钠琼脂购自杭州滨和微生物试剂有限公司;酶标板购自杭州主诺生物技术有限公司;革兰氏染色液(快速法)购自珠海贝索生物技术有限公司;丝裂霉素C购自北京百奥莱博科技有限公司。
2 方法
2.1 菌株分离纯化
无菌操作,用灭菌棉签蘸取奶样划线于甘露醇氯化钠琼脂平板上,倒置放于37℃电热恒温培养箱培养24h后观察菌落形态颜色。挑取金黄色的单菌菌落,再次四区划线接种于甘露醇氯化钠琼脂平板上。反复操作3次以上,直到单个菌落区上的每个菌落大小、形状、颜色一致,按照革兰氏染色方法完成染色后,油镜下观察细菌形态、纯度及染色特征;通过接触酶试验检测疑似金黄色葡萄球菌的菌株是否有气泡产生。
2.2 金黄色葡萄球菌的PCR鉴定
参考细菌基因组 DNA提取试剂盒的说明书对接触酶试验有气泡产生的疑似金黄色葡萄球菌的菌株进行提取总DNA。参考文献[15],由北京睿博兴科生物技术有限公司合成金黄色葡萄球菌的特异性基因nuc。引物序列为F:5′-AGGGATGGCTATCAGTAATGTTTC-3′;R:5′-CATCAGCATAAATATACGCTAAGCCAC-3′。PCR反应体系的设计(20μL):2×Taq PCR Master Mix10μL,菌液模板2μL,上、下游引物各1μL,ddH2O 6μL。PCR反应条件:94℃预变性5min;94℃变性20s,58℃退火20s,72℃延伸40s,设置为30个循环;72℃延伸6min;4℃保存。反应结束后取7μL进行1%的琼脂糖电泳,预期产物大小为464bp。
2.3 金黄色葡萄球菌溶原性噬菌体的诱导
金黄色葡萄球菌溶原性噬菌体的诱导方法参考文献[16],略有改动。将纯化好的金黄色葡萄球菌活化,接种至含2mL的LB培养基的试管内,在37℃恒温振荡器内培养至OD600值约0.2后再加入8mL的的LB培养基。加入MMC(丝裂霉素C),终浓度为0.5μg/mL,在37℃环境下,220r/min培养12h,观察试验组与对照组(不加MMC,其他条件完全相同)试管菌液浓度。当同一株菌的试验组与对照组OD600值差值大于0.3时,初步判定该株金黄色葡萄球菌为溶原性菌株,取试验组液体12 000r/min离心3min,上清液过滤膜,得到的液体为噬菌体原液。
2.4 金黄色葡萄球菌溶原性噬菌体的裂解
使用点滴法来检测金黄色葡萄球菌溶原性噬菌体的裂解能力[17]。取无菌棉签蘸取纯化好的菌株后,均匀涂布于LB琼脂平板上固定区域,稍微干燥后,在不同位置点滴不同的噬菌体原液,并做好标记。置于37℃培养箱内培养12h后,观察裂解效果(是否出现空斑),做好记录。找到宿主菌后,使用双层琼脂平板法纯化噬菌体,观察噬菌斑形态。
3 结果
3.1 菌株分离纯化
从45份样品中共分离出16株在甘露醇氯化钠琼脂平板上为金黄色的菌落,分离率为35.56%(16/45)。疑似金黄色葡萄球菌的菌株在甘露醇氯化钠琼脂平板上为边缘光滑整齐、湿润、凸起的金黄色圆形菌落(图1A),与阳性对照菌PC2颜色、形态一致(图1B)。经纯化后的疑似金黄色葡萄球菌的菌株经革兰氏染色后,油镜下为紫色球形,呈不规则堆状排列、典型的葡萄串状(图1C)。通过接触酶试验检测镜检疑似金黄色葡萄球菌的菌株,有大量气泡产生,与阳性对照菌株PC2一致,而阴性对照无气泡出现(图1D)。
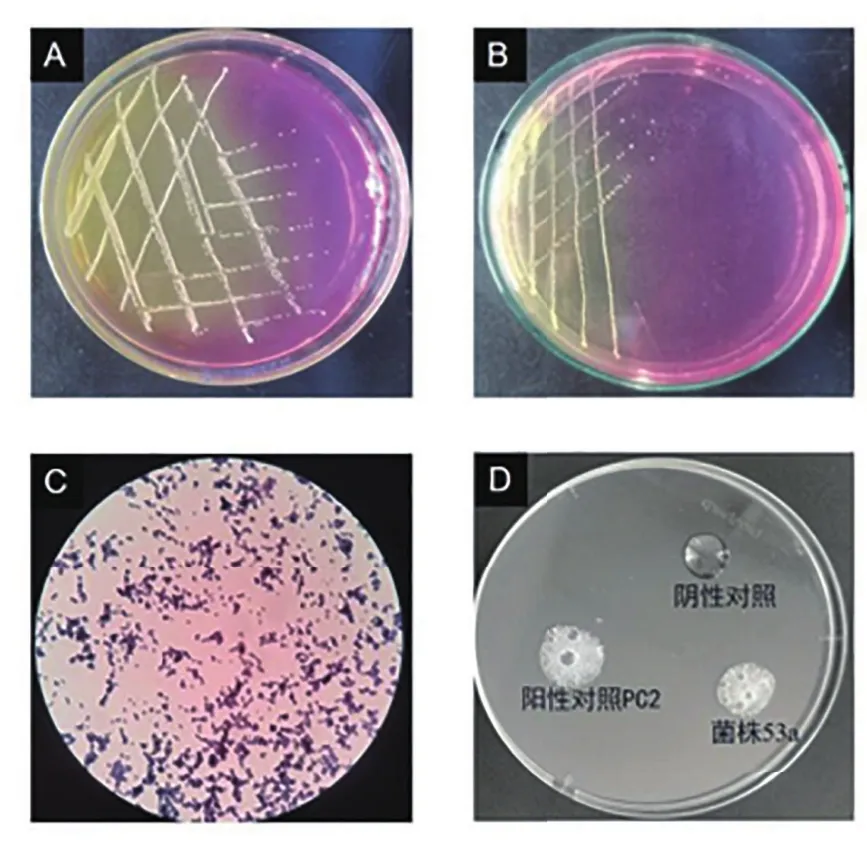
图1 金黄色葡萄球菌的分离鉴定
3.2 金黄色葡萄球菌的PCR鉴定
电泳结果显示,PCR试验中16株疑似金黄色葡萄球菌的菌株与预期大小及阳性对照菌株PC2一致,均为464bp(图2)。

图2 部分疑似金黄色葡萄球菌的RCR鉴定
3.3 溶原性噬菌体的诱导及裂解性试验
经过MMC诱导8h后,对试验组及对照组OD600值进行测量记录,发现有7株菌的OD600值与对照组OD600值差值超过了0.3(表1、图3A)。对分离出的溶原性噬菌体通过点滴法进行裂解试验,发现5株噬菌体可裂解金黄色葡萄球菌(表2),诱导率为31.25%,对金黄色葡萄球菌裂解率最高的为P65a,裂解率为58.82%(10/17),最低的为P27a,裂解率为11.76%(2/17),结果见表2、图3B。使用双层琼脂平板法纯化噬菌体,噬菌斑表现为中心透亮、边缘模糊的圆形空斑(图3C)。

表1 MMC诱导后OD600值对比结果

图3 溶原性噬菌体的分离及裂解试验
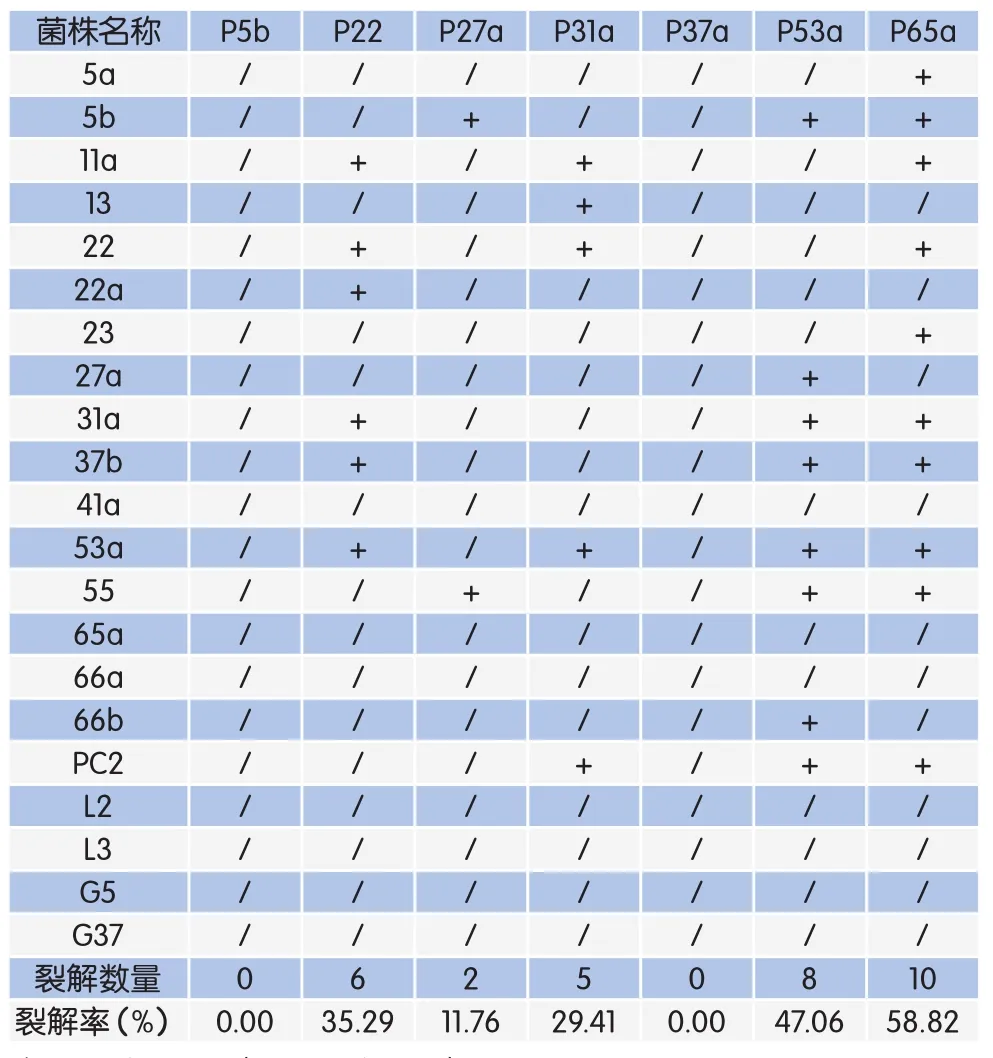
表2 溶原性噬菌体的裂解能力
4 讨论
金黄色葡萄球菌是导致奶牛患急、慢性乳房炎的最常见病原菌之一。本次试验分离出了16株金黄色葡萄球菌,分离率为35.56%(16/45),明显低于陈明杰等[18]得出的新疆某牧场临床型乳房炎样品中金黄色葡萄球菌70.00%(28/40)的分离率;但高于陈婷婷等[19]得出的甘肃部分地区奶牛乳房炎金黄色葡萄球菌30.11%(28/93)的分离率,这可能是由于各地、各牧场环境卫生及消毒、用药等方面的不同造成的。本次试验对奶牛乳房炎源金黄色葡萄球菌溶原性噬菌体的诱导率为31.25%(5/16),Schicklmaier等[20]研究发现大肠杆菌含前噬菌体率为77.57%(83/107),与之相比诱导率较低,可能受菌株来源所影响。在7份诱导后的清亮液中,只发现了5株噬菌体,推测原因有两种,一是在未发现噬菌体的2份诱导液中也可能存在2株溶原性噬菌体,但其裂解谱窄,在测试的16株金黄色葡萄球菌中未有其宿主菌株,才导致无空斑出现,后期可增加菌株的试验数量;二是丝裂霉素C抑制了菌株生长,所以出现试验组明显低于对照组OD600值。针对这种情况,后期可尝试不同诱导方法,如紫外诱导,也可通过基因测序工作,检测诱导后清亮液体是否含噬菌体。溶原性噬菌体转为烈性噬菌体后,对细菌具有了裂解能力,但温和噬菌体中的“仲裁”系统在裂解性循环和溶原性循环两者之间选择了后者,溶原性噬菌体基因则转导进入溶原菌基因内,很大概率将增强溶原菌的毒力和耐药,这将导致生产中乳房炎更易发生、更难治疗。
随着噬菌体对乳房炎治疗效果的深入研究,溶原性噬菌体也受到了越来越多的关注。对温和噬菌体的进一步研究,对了解乳房炎的发生、发展过程更为全面,也为了解微生态系统奠定了基础。

