发酵黄酒糟中蛋白营养组分及电泳分析
刘晨星,陈诚,姚凯勇
(1.浙江省农业科学院食品科学研究所,杭州 310021;2. 杭州申浙家禽有限公司,杭州 311402;3.澜海生态农业(杭州)有限公司,杭州 311402;4.浙江大学动物科学学院,杭州 310058)
近些年中国畜禽养殖规模增长十分迅速,动物源食品(奶、肉、蛋等)年产量规模达到了1.5亿t[1]。养殖规模的迅速扩张造成了国内动物饲料的严重短缺,其中蛋白质是动物饲料营养成分中最重要且缺口最大的成分[2]。目前,国内动物蛋白类饲料缺口近两千万t,而且随着畜产品消费需求的持续增长,这一缺口会进一步增加[3]。国内传统的蛋白质饲料(如大豆和鱼粉等)年产量远远无法满足养殖业对蛋白饲料的需求[4]。为了缓解我国蛋白饲料资源严重匮乏的现状,亟需挖掘可利用的新饲料资源。
黄酒源于商周,是一种历史悠久、风味独特的低度酿造酒。其生产副产物黄酒糟的适口性较好,蛋白质含量较高,且价格较低,是一种重要的蛋白质饲料资源[5]。中国黄酒产量规模已超30亿L,同时产生接近百万t的剩余黄酒糟[6]。黄酒糟水分含量较高,不及时处理容易腐败变质。目前国内许多酒厂将剩余酒糟脱水干燥处理后打包作为饲料出售[7],或是直接作为垃圾倒掉。而干燥处理成本高且附加值低,将黄酒糟作为垃圾处理掉不但污染环境且浪费资源。如果能实现对黄酒糟的科学利用,不仅可以节能减排,还能创造社会效益[8]。另外,由于鲜黄酒糟纤维含量高、氨基酸组成不均衡,直接饲喂牲畜消化率低,甚至会引发肠道疾病,所以要适当处理后再饲喂,才能充分发挥其营养价值。目前,微生物发酵在蛋白饲料生产上已得到广泛应用,微生物自身蛋白含量较高,同时其丰富的赖氨酸、蛋氨酸等限制氨基酸对于饲料是很好的营养补充。综上,研究黄酒糟混菌固态发酵对其蛋白营养组分产生的变化,对实际生产有非常重要的意义。本试验对发酵前后的黄酒糟进行蛋白营养成分、SDS-PAGE以及双向蛋白电泳分析,以探究发酵前后蛋白质变化情况。
1 材料与方法
1.1 发酵菌株
研究所用固态发酵菌株为一株产朊假丝酵母(Candida utilis)JZ-1以及一株枯草芽孢杆菌(Bacillus subtilis)JZ-2,均从发酵饲料中分离得到且有较好的发酵性能[9]。
1.2 黄酒糟混菌固态发酵
JZ-1和JZ-2的活化温度为30℃,120r/min在恒温培养箱中振荡培养24h,再在培养液中接种培养24h制成混菌发酵液。将黄酒糟补水至含水量50%后于121℃高压蒸汽灭菌30min,出锅冷却后再接菌,发酵液接种量为10%(JZ-1:JZ-2=1:1)。将接种好的黄酒糟铺在托盘上,用纱布进行包裹,然后放入30℃的通风恒温培养箱中发酵48h,发酵期间翻料1次。本试验发酵条件设置为预试验发现的最优发酵组合[9]。
1.3 检测指标及方法
将发酵前、后的黄酒糟置于65℃烘干,分装在自封袋中置于4℃保存。测定前粉碎,再先后通过2mm和1mm的筛子,保存在4℃条件下用于各项指标的测定。
1.3.1 常规成分测定
干物质(DM)、有机物(OM)以及粗蛋白(CP)含量的测定参考美国分析化学家协会(AOAC)在1990年颁布的标准方法。采用双缩脲法来测定黄酒糟中的多肽含量[9]。采用自动氨基酸分析仪测定氨基酸含量,具体操作过程参考GB/T 18246-2019[10]。
1.3.2 SDS-PAGE试验流程
对黄酒糟中的蛋白进行提取,采用氯醋酸-丙酮沉淀法[11]:在液氮中研磨发酵样品,加入提取液后于-20℃过夜,再在4℃、12 000r/min(下同)离心30min后弃上清。加入等体积丙酮冰浴30min,摇匀后同样条件离心30min,然后真空干燥沉淀后置于-20℃保存。在电泳上样前先加入裂解液在室温放置至蛋白充分溶解,然后离心至无沉淀,4℃暂存。将上清液定量至50μg/mL,以1:4比例加入SDS-PAGE上样缓冲液,混匀后放-80℃备用。SDS-PAGE电泳采用5%浓缩胶以及12%分离胶,在稳流40mA下电泳,待蛋白进入分离胶后停止,后设定稳流50mA进行电泳至溴酚蓝距离胶底1cm为止。电泳结束后,置凝胶于考马斯亮蓝G-250染色液中振荡过夜,双蒸水漂洗至背景清晰后采集图像[12]。
1.3.3 双向蛋白电泳试验流程
取0.3mg样品与350µL水化上样缓冲液(8mol/L尿素,4% CHAPS,100mmol/L DTT,0.5% IPG buffer)混合后离心,吸取清液沿槽边缘均匀加入样品。将17cm固相化pH非线性胶加入相应聚焦槽进行等电聚焦,聚焦程序设为被动水化12h,500V线性1h,1 000V快速1h,8 000V线性8h,最后聚焦500V 4h。将胶条在平衡缓冲液中轻微振荡12min,而后置于12.5%的SDSPAGE凝胶上,待胶条密封后置于垂直板电泳仪电泳。循环水浴温度为12℃,在15mA电流下电泳30min后,用30mA电泳至溴酚蓝距离胶下沿约0.5cm处时停止电泳。再将凝胶置于混合液(50%甲醇:10%醋酸=1:1)中银染至少1h。凝胶洗涤显色,再浸于1%醋酸终止反应,而后在蒸馏水中漂洗凝胶至背景清晰。
采用UMax Powerlook 2110XL(美国电气通用公司)对凝胶进行图像采集。分析差异蛋白位点采用Image Master软件。差异蛋白位点经MALDI-TOF-MS打靶鉴定,质谱鉴定成功后采用Protein Pilot Software v.5.0(AB SCIEX, USA)软件分析,然后比对到Uniprot数据库[9]。
2 结果与分析
2.1 黄酒糟发酵前后干物质中的营养成分
由表1可知,黄酒糟在发酵后有机物的占比有所下降,粗蛋白与多肽占比显著升高(P<0.01)。对于反刍动物尤其是奶牛而言,氨基酸营养是蛋白饲料的营养核心。黄酒糟干物质中含有的7种必需氨基酸的总含量在发酵48h后显著升高(P<0.01),占比从7.7%增加到10.1%。黄酒糟中10种非必需氨基酸的总含量在发酵后同样显著升高(P<0.01),占比从12.56%增加到15.21%。就单种氨基酸而言,在检测的17种氨基酸中,除脯氨酸外的16种氨基酸在发酵48h后均显著增加(P<0.01)。蛋氨酸(Met)含量增加倍数最多,约为发酵前的1.88倍。赖氨酸(Lys)是发酵前的1.65倍,增加倍数仅次于蛋氨酸(图1、图2)。
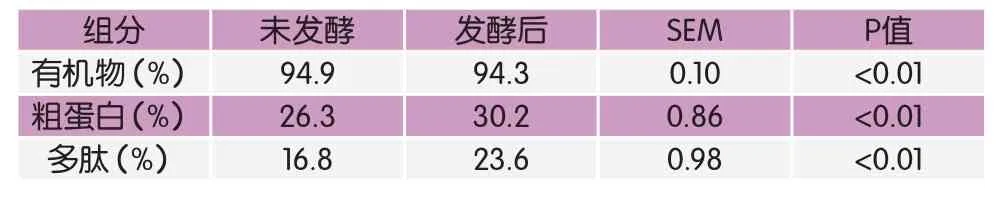
表1 未发酵和发酵黄酒糟干物质中的常规成分(干物质基础)
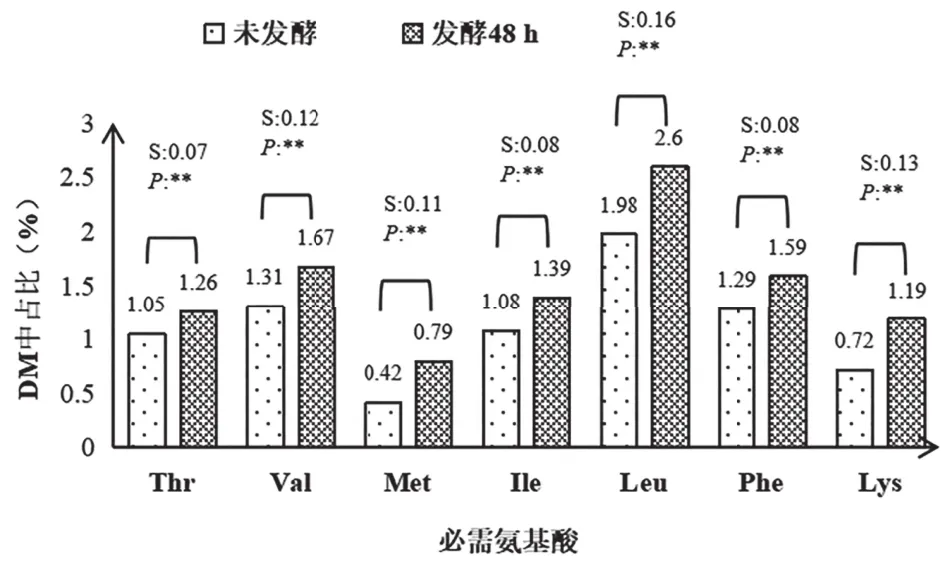
图1 未发酵和发酵48h黄酒糟干物质中必需氨基酸组成对比
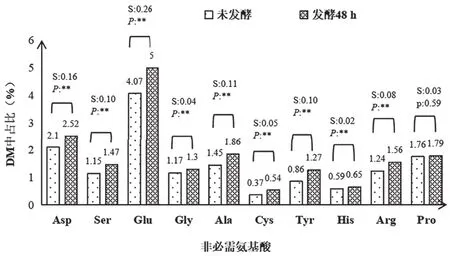
图2 未发酵和发酵48h黄酒糟干物质中非必需氨基酸组成对比
2.2 黄酒糟发酵前后的SDS-PAGE电泳结果
SDS-PAGE电泳图可以直观展示黄酒糟发酵前后的蛋白质分子质量变化情况,由此可以推测发酵前后蛋白营养组分的变化。如SDS-PAGE单向电泳图所示(图3),发酵前后的SDS-PAGE条带有着明显的差异,在发酵48h后的电泳图上分子质量45ku以上的蛋白条带几乎消失,25~45ku间的蛋白条带明显变淡。14.4ku以及18.8ku部分的蛋白条带在发酵前后无明显变化,可能是因为发酵前后均含有一定浓度的小分子蛋白,通过观察无法直接得出结论。通过对电泳图条带迁移率进行分析,可估算出酒糟样品中不同分子质量蛋白含量。结果如表2所示,酒糟中分子质量小于5ku、5(含)~10ku以及10(含)~15ku的小分子蛋白含量在发酵后均大幅上升,分别上升1.89倍、1.39倍和0.93倍。
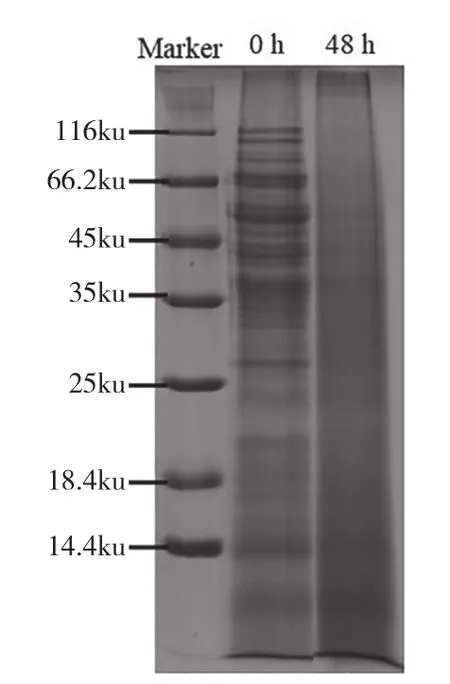
图3 未发酵和发酵48h黄酒糟的SDS-PAGE电泳图
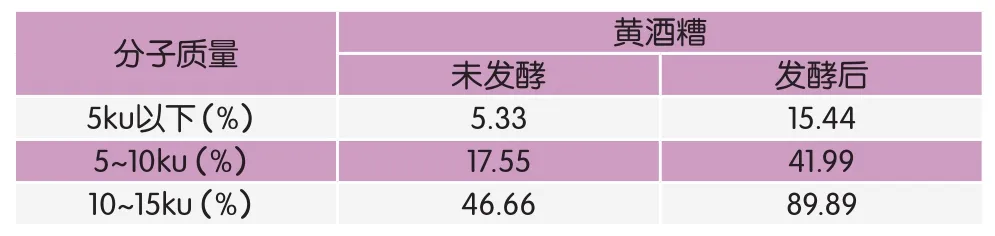
表2 未发酵和发酵48h黄酒糟的小分子蛋白含量
2.3 黄酒糟双向蛋白电泳及质谱鉴定分析
通过双向电泳可以分离蛋白,然后采用质谱对其进一步鉴定。在未发酵黄酒糟的电泳图上对差异蛋白位点进行标注(图4),双向蛋白电泳发现10个差异倍数大于1.5且蛋白得分大于95的差异蛋白。这10个差异蛋白再经MALDI-TOF-MS打靶,成功鉴定了其中3个差异表达蛋白,经对其进行GO分子功能分析(表3),发现编号2930的上调差异蛋白与抑制丝氨酸型内肽酶活性有关,查得分子途径为限制作用以及二硫键,编号3014的上调差异蛋白与GTP连接及GTP酶活性有关,编号3162的上调差异蛋白分子功能未见报道。
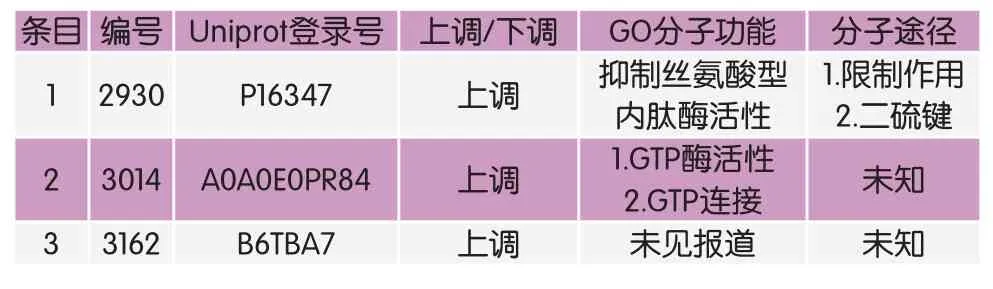
表3 质谱鉴定成功的差异表达蛋白及GO中的分子功能
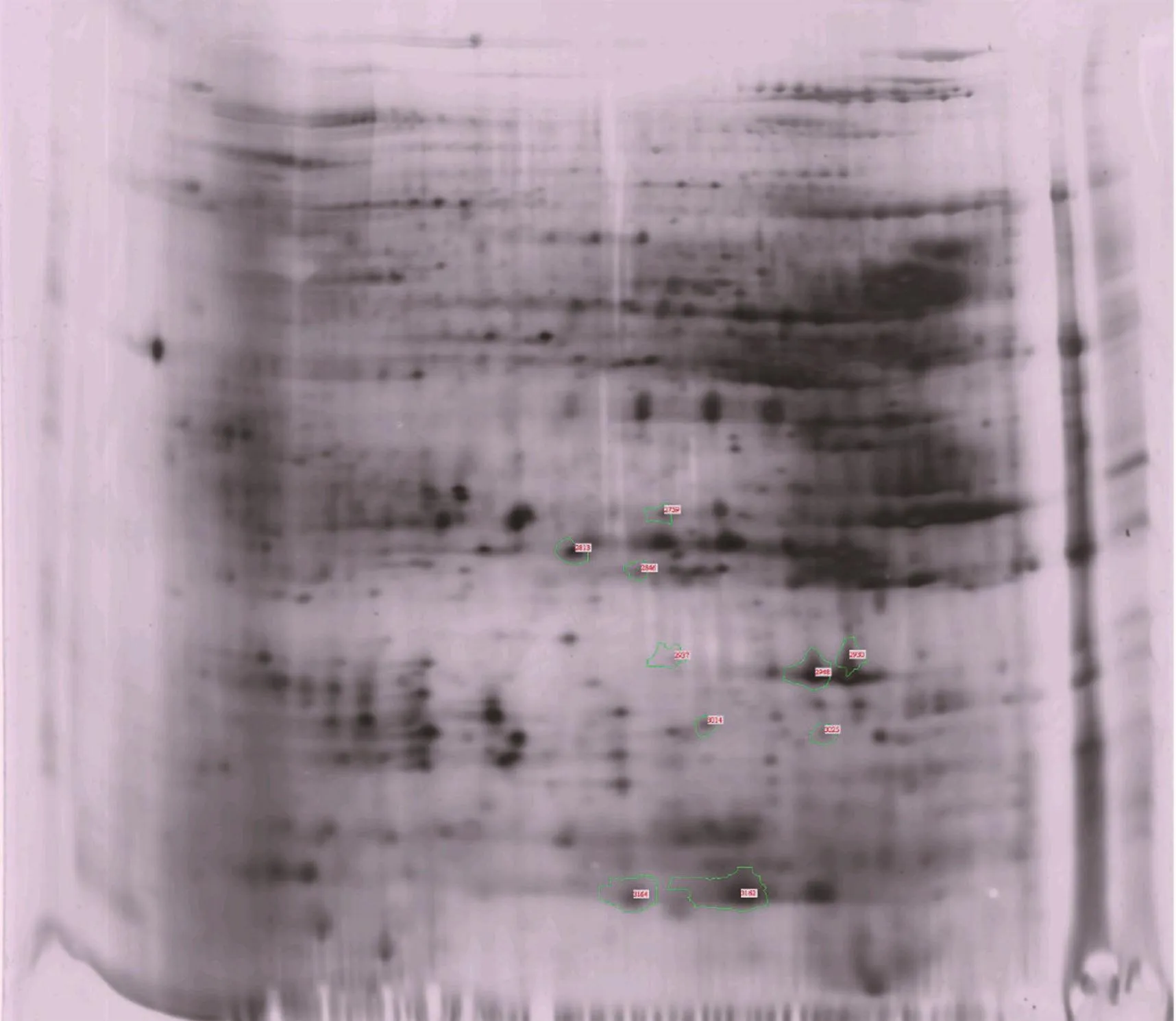
图4 分布在未发酵黄酒糟双向电泳蛋白图上的差异蛋白位点
3 讨论
本研究显示黄酒糟中粗蛋白、多肽以及除脯氨酸外大部分氨基酸含量在发酵后均显著提高。试验所用芽孢菌及酵母菌自身含有丰富的氨基酸[13],而发酵过程中蛋白降解也可能是多肽以及氨基酸含量上升的重要原因。韩坤坤等[14]将一株驯化的芽孢杆菌应用于豆粕固态发酵试验,发现发酵15h后固态基质中多肽含量提高近1倍,增幅比本研究发酵48h后增幅还要大,这可能与发酵基底差异性有关;发酵52h粗蛋白含量提高5.90个百分点,与本研究的结果比较接近。Hu等[15]研究发现鲜酒糟与豆粕相比,其中赖氨酸和蛋氨酸这两种限制氨基酸含量十分有限。而对于泌乳前中期奶牛如果赖氨酸的摄入缺乏,会导致牛奶中综合营养成分尤其是蛋白含量显著降低,从而影响其商品价值[16,17]。除了可以提高奶牛生产性能,赖氨酸在调节自身代谢、增强免疫力等许多方面发挥重要的生理作用[18]。同时,蛋氨酸也与奶牛体内的许多生理生化过程密切相关,如细胞信号转导、核酸和蛋白质的合成、参与多种转甲基反应等[19]。本研究中黄酒糟在固态发酵后氨基酸营养得到全面增强,尤其是蛋氨酸和赖氨酸的含量大幅上升,对奶牛饲喂效果提升有很重要意义。
SDS-PAGE的结果表明黄酒糟在发酵48h后大分子蛋白发生了大量降解,而小分子蛋白、多肽以及氨基酸含量明显上升。前人研究发现芽孢杆菌能分泌多种蛋白酶,在对豆粕进行发酵的试验中得到了验证[20,21]。枯草芽孢杆菌可以将大分子蛋白降解为小分子蛋白、多肽、氨基酸等小分子物质,同时酵母具有合成多肽的能力[13]。因此不同分子量的蛋白占比在发酵前后发生了显著变化。
蛋白质降解是一个复杂的过程,需要包括内肽酶、氨肽酶、羧肽酶等在内的多种蛋白水解酶参与。根据Uniprot数据库的查询结果,编号2930的上调表达蛋白经GO功能注释后存在抑制丝氨酸型内肽酶活性的功能。内肽酶是一类对肽链内部水解具有催化作用的酶,其作用位点不包括肽链末端。在对内肽酶对黄瓜叶片衰老作用的研究中发现,在叶片衰老过程中,内肽酶对叶片内蛋白质降解中起重要作用[22]。由此推测,编号2930的上调表达蛋白在黄酒糟发酵过程中发挥的分子作用是通过减缓二硫键的分解来限肽链降解,从而发挥限制蛋白降解速率的作用。该蛋白表达上调原因有待进一步探究确认。枯草芽孢杆菌中超过95%分泌蛋白均通过Sec途径分泌至胞外,不同蛋白分泌途径可能处于“竞争”状态[23]。因此,同为蛋白质的不同酶之间可能存在互相限制的作用。
编号3014的上调蛋白GO功能注释后与GTP酶活性以及GTP连接相关,可是在Uniprot数据库中未查得其分子途径。GTP是DNA复制时引物RNA和转录mRNA中GMP(鸟嘌呤核苷酸)的提供者。GTP酶能催化GTP分解,GTP在蛋白质合成中起着关键的作用。本试验中有7个差异蛋白无法通过质谱鉴定,不成功因素主要如下:①目标蛋白质的含量过低;②现有蛋白数据库数据量有限,不包含足以解释该蛋白质功能的数据;③发酵样品中所含蛋白质构成较为复杂,选取凝胶点包含多种未分离开的蛋白。当前,有关蛋白降解关键酶以及主要代谢通路仍需要进一步验证,实现蛋白饲料更高效降解利用需要继续深入探究。

