乌头酸对尖孢镰刀菌百合专化型抑制作用分析
王文珠师桂英苏国礼牟晓玲朱 艳杨宏羽李谋强
(1.甘肃农业大学 园艺学院,兰州 730070;2.甘肃农业大学 食品科学与工程学院,兰州 730070;3.临洮县龙门镇农技推广站,甘肃 临洮 730500)
酚酸物质是植物根系分泌物中重要的化感物质,对植物根际土壤微生物生长表现显著的化感作用。尖孢镰刀菌Fusariumoxysporum是引起植物产生枯萎病的典型病原真菌[1]。该病原真菌从植物根部侵入,引起维管束病害,最终植株枯萎死亡[2]。枯萎病属于土传病害,与地上部分病害相比,防治工作相对困难[3]。利用酚酸类物质的化感抑制作用来防控枯萎病已成为近年来的研究热点。
阐明根系酚酸类物质对镰刀菌生长的影响,是化感抑制剂应用研究的基础。该方面已有诸多文献报道。郝文雅等[4]研究表明,香豆酸对西瓜专化型尖孢镰刀菌孢子萌发、产孢能力、菌丝生长表现显著抑制作用;翟子翔等[5]认为,800 μg·m L-1浓度的肉桂酸对香蕉枯萎病尖孢镰刀菌抑制率最强。但是,另一些研究发现,某些酚酸类物质可以促进病原菌的生长,提高枯萎病的发生。王倩等[6]研究表明,苯甲酸和肉桂酸可以提高西瓜幼苗枯萎病的发病率;Tian等[7]发现,兰州百合根系分泌物邻苯二甲酸对枯萎病病原菌侵染能力有促进作用;类似结果在其他研究中也有报道。因此,酚酸物质对植物枯萎病菌的生长表现出促进或抑制作用与酚酸类物质的种类或含量有关[8-9]。
乌头酸(Aconitic acid,C6H6O6),又名丙烯-1,2,3-三羧酸,由于最先在乌头属植物(Aconitum napellus)中发现而得名。乌头酸是笔者所在课题组在兰州百合连作栽培土壤中首次报道的酚酸类化感物质[10]。兰州百合是中国唯一的甜百合。该作物狭域分布,无性繁殖,多年生栽培,主产区枯萎病发生十分严重。笔者所在课题组分离获得主产区枯萎病主要致病镰刀菌类群尖孢镰刀菌(Fusariumoxysporum)[11],证明镰刀菌属真菌的积累是引起兰州百合连作障碍的原因[12];同时,利用HPLC方法,对0~9 a的兰州百合根际土壤进行分析,共检测到的11种酚物质,其中包括乌头酸在内的4种酚酸类物质含量较高(大于1μg·g-1干土),而在这4种物质中,以乌头酸含量在各年份含量较为稳定[10]。已有研究人员在小麦[13]及葡萄[14]根系分别证明乌头酸是重要的根系分泌物,对尖孢镰刀菌具有抑制作用。因此,笔者推测乌头酸可能会对百合尖孢镰刀菌产生化感作用。基于以上背景,本试验选择乌头酸作为外源化感物质,依据该物质在兰州百合栽培土壤中的含量最大值8.9μg·g-1[10],以及孙明等[15]试验结果为参考,按0~1 175 mg·L-1设计浓度梯度,采用体外抑菌试验及分子生物学技术,研究该物质对尖孢镰刀菌的化感效应及其转录水平的分子调控机理,以期阐明该物质对镰刀菌的化感作用效果,为兰州百合枯萎病病原性连作障碍治理提供依据。
1 材料与方法
1.1 供试材料
选用培养基中添加外源化感物质,离体培养微生物的方法。乌头酸,上海中秦化学试剂有限公司生产;尖孢镰刀菌(Fusariumoxysporum),保存于甘肃农业大学园艺学院实验室4.0℃冰箱中,作为病原菌试验材料。
1.2 试验方法
1.2.1 乌头酸对尖孢镰刀菌生长的测定 设计5个不同乌头酸浓度处理,即CK(0 mg·L-1)、T1(1.175 mg·L-1)、T2(11.75 mg·L-1)、T3(117.5 mg·L-1)、T4(1 175 mg·L-1),每处理3次重复。
将尖孢镰刀菌菌饼(d=4 mm)接种于添加不同浓度乌头酸的PDA 培养基上,于28 ℃下恒温培养7 d。测定菌落直径直到第7天,每隔24 h测定1次,绘制菌落生长速率曲线并计算抑菌率。培养第7天后测量产孢量和计算产孢量抑制率。同时,采用载玻片法[16]观察并记录孢子萌发数。每个处理重复3次,按公式计算孢子萌发率和抑制率。
菌落纯生长量=菌落直径-菌饼直径
抑菌率=(对照皿菌落纯生长量-处理皿菌落纯生长量)/对照皿菌落纯生长量×100%
产孢量=(测量所得孢子数/80)×400×10 000×稀释倍数
产孢量抑制率=[(对照菌落产孢量-处理菌落产孢量)/对照菌落产孢量]×100%
孢子萌发率=萌发个数/总孢子个数×100%
孢子萌发抑制率=(对照组萌发率-处理组萌发率)/对照组萌发率×100%
1.2.2 尖孢镰刀菌细胞膜渗透性、可溶性蛋白含量、MDA 含量和SOD、POD 酶活性的测定 取新鲜 菌 饼,加 入PDB 培 养 基,在28 ℃、140 r·min-1恒温摇床振荡培养5 d 后,取出菌丝团,收集菌丝体[17],置于-20 ℃冰箱中保存。取0.2 g菌丝体(湿质量),放入30 m L 不同浓度乌头酸溶液中,每处理重复3 次,分别在0、5、15、30、60、90、120、150、180、240 min 时 用 电 导 仪(DDSJ-308F)测定电导率。
在60 m L含不同浓度乌头酸的PDB 培养基中加入2 g菌丝体,恒温振荡培养,在12、24、48 h后取出菌丝体,准确称取0.5 g,置于已放入少量磷酸盐缓冲液(PBS,p H=7.4)的研钵中,冰浴研磨成匀浆,将匀浆用PBS定容至10 m L,于4 ℃、10 000 r·min-1离心10 min,取上清液用于各生理指标的测定。可溶性蛋白含量采用考马斯亮蓝G250染色法;MDA 含量的测定采用2-硫代巴比妥酸(TBA)法;SOD、POD 活性测定参照方法[18]。
1.2.3 乌头酸对尖孢镰刀菌SOD、POD 酶基因表达量的测定 将已灭菌的玻璃纸平铺在含药培养基后接入4 mm 尖孢镰刀菌菌饼,28 ℃避光培养。无菌水作对照,每个处理3次重复。培养5 d后,刮取玻璃纸表面的菌丝置于无酶离心管中,并快速放入液氮中冷冻,待其充分冷冻后置-80 ℃冰箱中保存,待用。
用真菌RNA 提取试剂盒(Fungal RNA Miniprep Kit)提取不同处理下菌丝体的RNA。利用超氧化物歧化酶合成相关基因特异性引物SODF/R;过氧化物酶合成相关基因特异性引物PODF/R[19];内参基因Actin引物参照齐兴柱等[20]的方法。由上海生工生物工程股份有限公司合成(表1)。反转录试剂盒(Evo M-MLV RT Kit with gDNA Clean,AG,Changsha,China)合成cDNA;定 量PCR 仪(LightCycler96 Real-Time PCR System,Roche,瑞士)和荧光定量试剂盒(SYBR Green Premix ProTaqHS Qpcr Kit,AG,Changsha,China)进行该基因在不同处理下表达量的分析。反应体系为20μL:cDNA 3μL,dd H2O 5μL,上、下游引物各1μL,SYBR 10μL。

表1 PCR 扩增引物Table 1 Primers of PCR
1.3 数据分析
采用Excel 2010 处理数据并作图,采用SPSS 22.0软件进行单因素方差分析(ANOVA)分析,以Duncan’s检验法进行多重比较。
2 结果与分析
2.1 乌头酸对尖孢镰刀菌生长的影响
2.1.1 菌落 乌头酸对尖孢镰刀菌菌落生长有显著的抑制作用(P<0.05),随着乌头酸浓度的增大,其抑制效果增强(图1-A)。从第2天开始,与CK 相比,各处理尖孢镰刀菌菌落的生长速度产生明显差别,T1、T2、T3、T4 处理的菌落生长变小(图1-A,1-C)。T1、T2、T3处理的抑菌率分别比CK 增加29.23%、33.95%和38.09%。T4处理下,抑菌率值达到91.95%,与CK 差异显著(图1-B)。在培养第7 天时,CK 菌落直径为66.34 mm,T4 菌落直径最小,为9.25 mm(图1-C)。
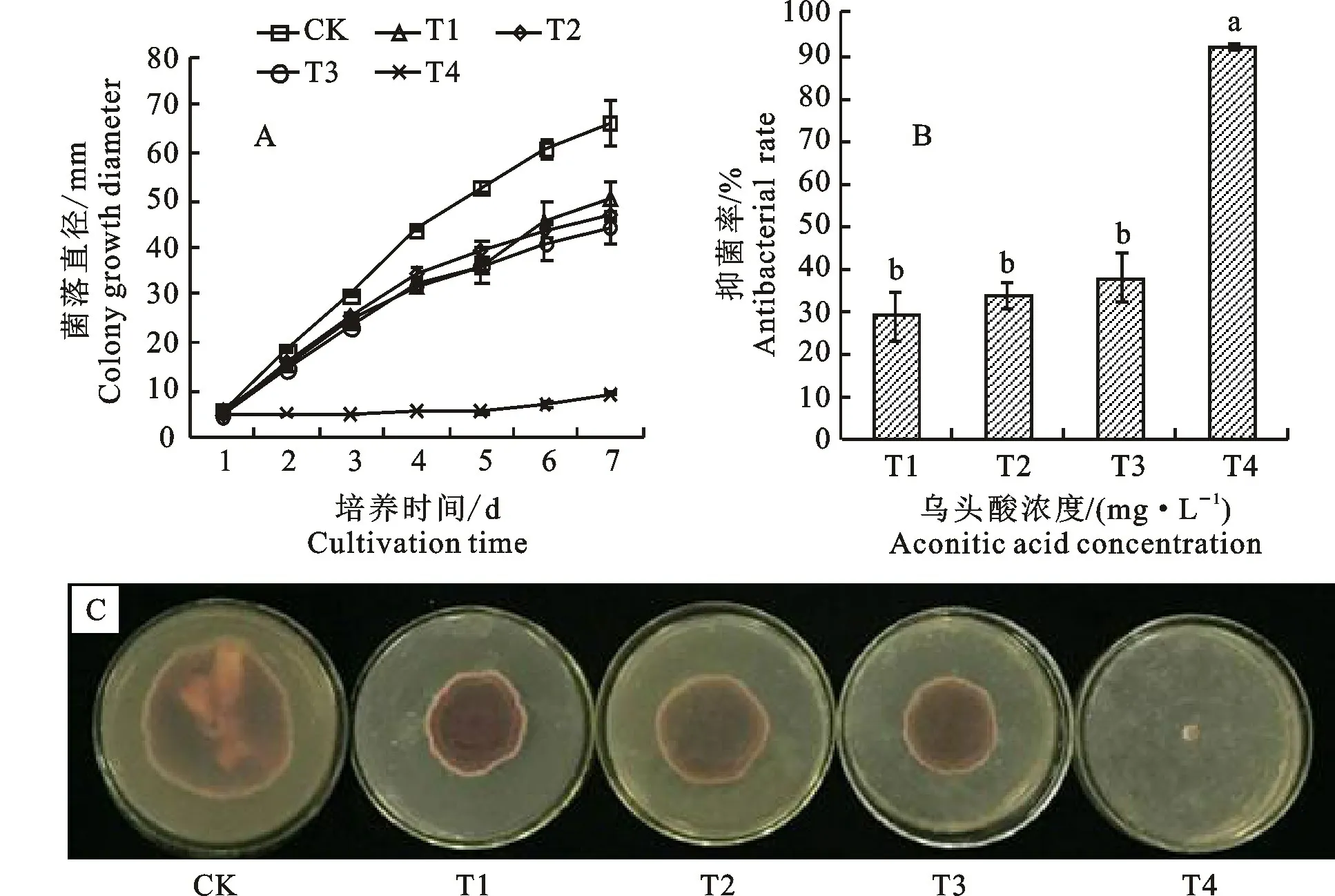
图1 乌头酸处理后尖孢镰刀菌生长情况Fig.1 Growth of Fusarium oxysporum under treatment of aconitic acid
2.1.2 产孢量及孢子萌发率 乌头酸对尖孢镰刀菌的产孢量有显著抑制作用(P<0.05)。随着乌头酸浓度的增加,尖孢镰刀菌的产孢量降低。与CK 相比,各处理产孢量发生变化,T1、T3 处理产孢量较CK 差异不显著,T2和T4处理下产孢量显著降低,分别降低17%和77%(图2-A),且产孢量抑制率分别达到17%与77%(图2-B);与CK 相比,T1~T4 处理孢子萌发率均低于CK,T4处理孢子萌发率、孢子萌发抑制率分别是4%和93%,差异显著(P<0.05)(图2-C,2-D)。随着乌头酸浓度的增大,孢子萌发数量发生改变,且T4 处理下孢子萌发个数明显减少(图2-E~2-H)。
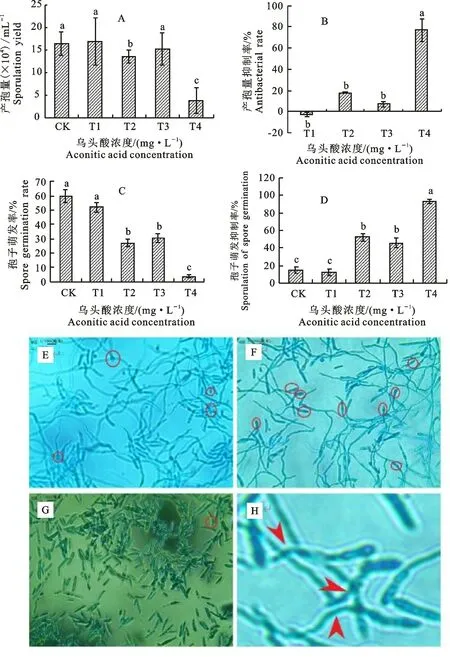
图2 乌头酸处理后尖孢镰刀菌产孢量与孢子萌发率Fig.2 Spore yield and spore germination rate of Fusarium oxysporum under treatment of aconitic acid
2.2 乌头酸对尖孢镰刀菌细胞膜通透性的影响
乌头酸对尖孢镰刀菌菌丝体的细胞膜通透性有一定影响,乌头酸浓度越高,对菌丝体细胞膜破坏越大,菌丝体内电解质外泄越严重(图3)。在240 min时,T4处理下的电导率值最大,为3 590 μS·cm-1,与CK 相较,显著提升98.66%。说明乌头酸浓度越高,对菌丝体的细胞膜破坏越大,增大菌体通透性。

图3 乌头酸处理后尖孢镰刀菌菌丝体细胞膜的透性Fig.3 Cell membrane permeability of Fusarium oxysporum mycelium under treatment of aconitic acid
2.3 乌头酸对尖孢镰刀菌丙二醛含量和可溶性蛋白含量的影响
培养12 h后,与CK 相比,T1、T2、T3、T4菌体MDA 含 量分别是CK 的1.07、2.76、4.12、4.06倍。由此说明,乌头酸处理引起菌体发生膜脂过氧化反应,提高了菌体MDA 含量,导致细胞膜受损,并且具有剂量依赖性(图4-A)。乌头酸处理降低菌体可溶性蛋白含量,与CK 相比,T4处理菌体可溶性蛋白含量较CK 下降41.54%(图4-B)。表明乌头酸浓度越高,对尖孢镰刀菌的损伤越强。

图4 乌头酸处理后尖孢镰刀菌菌丝体内MDA含量(A)和可溶性蛋白含量(B)Fig.4 MDA content(A)and soluble protein content(B)in Fusarium oxysporum mycelium under treatment of aconitic acid
2.4 乌头酸对尖孢镰刀菌POD 和SOD 酶活性的影响
乌头酸处理对尖孢镰刀菌氧化还原酶活性有显著影响。12 h时随乌头酸浓度的增加,各处理SOD 活性均高于CK。24 h时T1、T4处理SOD活性高于CK,但不显著,中间浓度值T2和T3处理活性下降,其中T2处理,与CK 相比,SOD 活性降低0.14%。48 h时,所有处理SOD 活性均下 降,与CK 相 比,T4 处 理SOD 活 性 下 降65.06%。结果表明,随着浓度和培养时间的增加,SOD活性呈先增加后下降趋势(图5-A)。乌头酸对尖孢镰刀菌菌丝体的POD 活性有一定影响,12 h时POD 活性CK~T3处理变化不大,只有T4处理POD 活性达到最大值,24 h时各浓度处理下POD活性均高于CK,与CK相比,T 2和T4处理POD 活性上升3%和2.25%,差异显著。48 h时各浓度处理下POD 活性均低于CK,与CK 相比,T4处理POD 活性显著降低82.77%。结果表明,随着培养时间和浓度的增加,POD 活性呈先增加后降低趋势(图5-B)。
2.5 乌头酸对尖孢镰刀菌菌丝体SOD 与POD酶基因表达量的影响
乌头酸处理使SOD 与POD 酶合成基因表达量发生变化。SOD 酶合成基因在转录水平上下调表达,与CK 相比,T2、T3、T4处理SOD 酶合成基因下调,差异显著,T1处理下酶合成基因表达量高于CK,但不显著。在培养第5 天后T2、T3、T4乌头酸处理下SOD 基因表达量呈现下调,分别是CK 的2.08×10-7、2.50×10-7、0.78倍(图6-A)。POD 酶合成基因在转录水平上下调表达,与CK 相比,T1、T2、T3、T4乌头酸处理下POD 基因表达量均为下调且差异显著,分别是CK 的0.05、0.03、0.06、0.09倍(图6-B)。
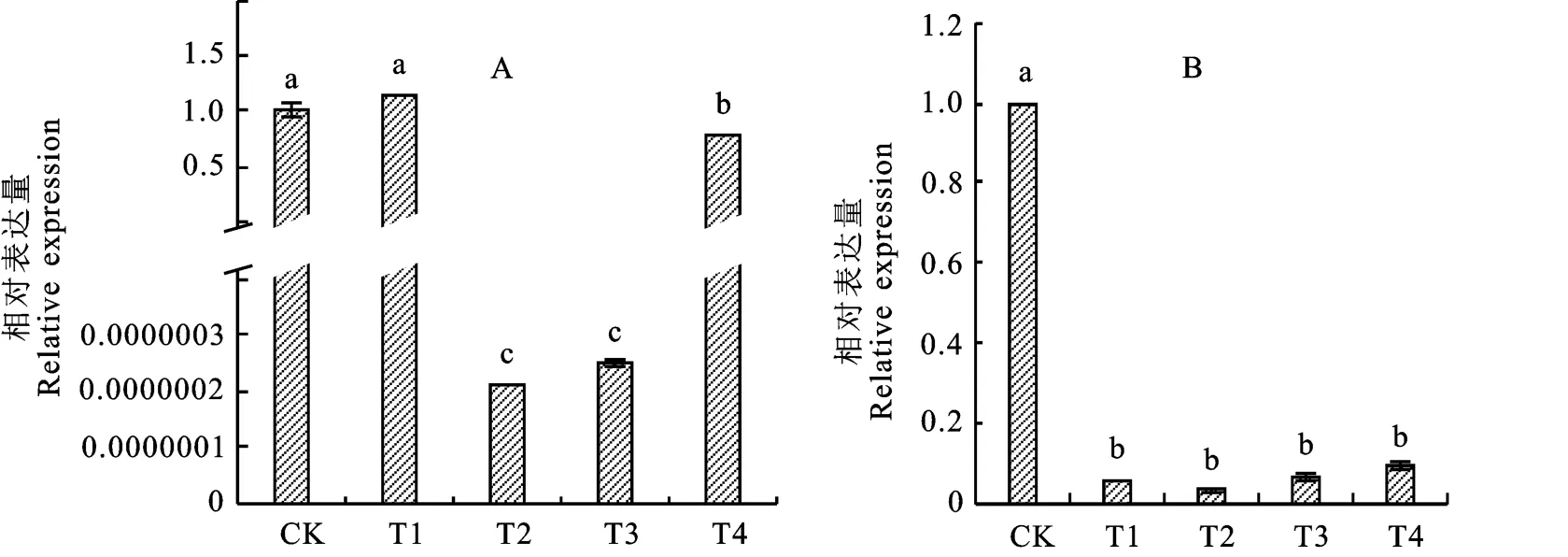
图6 不同浓度乌头酸处理后尖孢镰刀菌SOD(A)与POD(B)酶基因表达量Fig.6 SOD(A)and POD(B)enzyme gene expression of Fusarium oxysporum under different concentrations of aconitic acid
3 讨论
乌头酸是重要的植物根系分泌物,在自然界中存在顺式和反式两种异构体。都萃颖[21]研究发现,高含反式乌头酸TAA 的玉米叶片能显著抑制根结线虫病害且不影响植株正常生长。董艳等[13]研究‘云麦47’和‘绵阳29’两个小麦品种中根系分泌物,检测顺式乌头酸,发现小麦与蚕豆间作降低根际尖孢镰刀菌的数量,抑制蚕豆枯萎病的发生。上述研究均间接证明该物质对病原微生物的化感抑制效应。本研究结果表明:1 175 mg·L-1乌头酸处理对尖孢镰刀菌菌丝生长、孢子产生及萌发均具有显著的抑制作用,可引起菌落生长缓慢,产孢量下降,孢子萌发率降低;1.175~1 175 mg·L-1时,真菌细胞膜通透性增大,MDA 含量增加,可溶性蛋白质含量降低,SOD 与POD 活性呈先增加后下降趋势,乌头酸处理后期,SOD 与POD 酶合成基因在转录水平上下调表达。本研究在离体条件进行试验,为该物质对病原微生物的化感抑制效应提供直接理论支持。
孙鸿强[10]利用HPLC 方法在兰州百合栽培土壤中的测到的乌头酸含量为3.70~8.9 μg·g-1,而且该物质在不同连作栽培年限及不同生育时期的百合栽培土壤中含量均较为稳定。本研究中的T1 处理,其浓度设计为1.175 mg·L-1(与土壤浓度8.9μg·g-1相当),与CK相比,能够抑制尖孢镰刀菌菌丝生长和孢子萌发,但对产孢基本没有影响,总体表现抑制作用。孙明等[15]研究发现,反式乌头酸具有明显的杀南方根结线虫、大豆孢囊线虫的活性。反式乌头酸对南方根结线虫的使用浓度为100~1 000 μg·m L-1,最佳使用浓度为500μg·m L-1,对其死亡率为85.5%;对大豆孢囊线虫的使用浓度为200~1 000μg·m L-1,最佳使用浓度为500 μg·m L-1,对其死亡率为99.2%。上述乌头酸对线虫防控结论,为本研究结果提供了部分支持。本研究结果表明,在1.175~1 175 mg·L-1时,乌头酸对尖孢镰刀菌生长产生完全抑制作用。因此,该浓度为乌头酸进行百合枯萎病(镰刀菌为主要病原)的化感抑制剂防治试验设计提供参考。
本研究在转录水平上揭示乌头酸对菌丝体造成伤害的分子机理。在真菌菌体遭受不同生物或非生物胁迫时[22],导致其孢内大量活性氧积累,引起生物体内POD 与SOD 等氧化还原酶类活性增加;但是,随着胁迫时间增加,氧化还原酶系统平衡遭到破坏,酶活性在后期下降。刘玲等[23]研究发现,随着总黄酮浓度和处理时间的增加,尖孢镰刀菌甜瓜专化型SOD 和CAT 活性总体呈先上升后下降的趋势。与本研究结果类似,随着乌头酸处理浓度和处理时间的增加,尖孢镰刀菌百合专化型SOD 和POD 活性先增加后下降。本研究进一步采用Real-time PCR 技术分析乌头酸对菌丝体SOD 及POD 酶基因表达量的影响,结果表明长时间的乌头酸处理引起真菌SOD 与POD酶基因表达量下调,这与刘畅[24]研究结果一致。由此可知,长时间的乌头酸处理引起真菌SOD 与POD 酶基因表达量下调是SOD 及POD 酶活性下降的原因之一。在本试验中电导率增加、MDA含量上升、可溶性蛋白含量下降,表明乌头酸处理破坏尖孢镰刀菌细胞膜的通透性,抑制兰州百合枯萎病菌生长。这与李珊珊等[25]研究结果类似。由此推论:长时间的乌头酸处理,可引起镰刀菌氧化还原酶等防御酶合成基因在转录水平上的下调表达,进而引起相关酶类合成受阻,酶活性降低,生物体内活性氧代谢失衡,氧化胁迫加剧,最终破坏菌丝体细胞膜完整性,对菌体造成伤害。
在自然或正常的浓度范围内,反式乌头酸具有生物安全性,属食品添加剂。因此,该物质具有生态安全性,具备作为化感抑制剂防治土传病害应用的生态安全基础。近期关于小分子杀线虫毒素反式乌头酸生物合成途径及该毒素应用于植物根结线虫防治的研究也为该物质作为化感抑制剂的应用提供有价值的参考[21]。
4 结论
乌头酸对尖孢镰刀菌的生长具有抑制作用,在1.175~1 175 mg·L-1时,随着浓度增加,抑菌效果明显,1 175 mg·L-1处理下抑菌效果最佳。乌头酸处理引起镰刀菌氧化还原酶类合成基因在转录水平上下调表达,导致菌体氧化胁迫加剧,破坏菌丝体细胞膜完整性,是其抑制镰刀菌生长的分子机制。

