BTH诱导番茄耐番茄斑萎病毒(TSWV)研究
郑家瑞 李云洲
(1 贵州大学农学院,贵州 贵阳 550025;2 中国农业大学植物保护学院, 北京 100193)
番茄斑萎病毒(Tomato Spotted Wilt Orthotospovirus, TSWV)属布尼亚病毒目(Bunyavirales)番茄斑萎病毒科(Tospoviridae)正番茄斑萎病毒属(Orthotospovirus),严重威胁我国番茄的安全生产,造成巨大的经济损失[1-2]。TSWV病毒粒子近球形,基因组包含3条单链RNA(single strand RNA,ssRNA),分别为ssRNA-L(8 897 nt)、ssRNA-M(4 821 nt)、ssRNA-S(2 316 nt)[3]。其中,ssRNA-L编码RNA依赖型RNA聚合酶,该酶参与病毒的复制过程;ssRNA-M编码病毒在细胞间移动所需的非结构蛋白NSm,此外,其编码的糖蛋白Gn-Gc能够与TSWV的传播介体细胞相互识别,促进病毒粒子与传播介体细胞的融合,从而提高传毒效率;ssRNA-S编码非结构蛋白NSs以及N蛋白,NSs可抑制基因沉默,N蛋白与3条基因组紧密交联,组成核糖体核蛋白(ribosomal protein, RNPs)[4-6]。
TSWV侵染番茄植株后,可引起叶柄或茎部出现黑色条纹、叶片产生坏死斑、番茄果实果面出现环斑等症状,最终影响番茄的产量和品质[7]。该病毒主要通过西花蓟马(Frankliniellaoccidentalis)传毒,且西花蓟马(F.occidentalis)获毒后终身传毒[8], 因此TSWV的防治较为困难。目前,防治TSWV的特异性农药尚未被研制开发,生产上主要通过常规杂交育种方式将抗性基因Sw-5、Sw-7渗透到栽培品种中以防治TSWV,这种方法的人工和时间成本较高,且提供的病毒抗性不稳定。虽然通过转基因技术可以快速获得抗病毒材料,但是目前消费者对转基因食品接受度低。因此通过外界因子前处理诱导抗性,为番茄TSWV治理提供了新思路。
诱导抗性(induced resistance,IR)指植物经过外界生物因子、化学物质或物理因子等前处理所激发的植物自身免疫系统,当病原物再次侵染植株所表现出的更加强烈的防御抗性[9]。利用植物诱导抗性提高农作物产量性状具有省时、省力、效果显著等优点[10]。植物诱导抗性属于自身免疫反应,具有非专化性、系统广谱性、持效性、安全性等特点[11]。另外,植物诱导抗性还可以促进植物体内一系列生理代谢活动,有助于植物的生长发育和产量提高,因此利用植物诱导抗性提高农作物抗性的相关研究备受科研工作者关注[12]。
苯并噻二唑(benzothiadiazole, BTH)是最常用的植物诱抗剂之一,具有广谱性强、安全性高等特点[13],目前已在多种农作物上进行研究报道[14-16]。Lopez-Gresa 等[17]研究发现BTH处理可以提高番茄植株对灰霉菌的抗性;Trejo-Saavedra等[18]研究发现BTH处理可以提高辣椒对辣椒金色花叶病毒(pepper golden mosaic virus,PepGMV)的抗性,然而关于BTH是否可以诱导番茄植株抗TSWV的研究甚少。因此,本试验以矮番茄为研究对象,通过检测BTH前处理后,接种TSWV对番茄植株在生理水平和分子水平上的影响,探究BTH前处理诱导植株对TSWV抗性的影响,以期为诱导番茄以及其他蔬菜的抗TSWV病毒研究奠定基础。
1 材料与方法
1.1 试验材料
本试验所用番茄材料为矮番茄[19-20],源自西北农林科技大学园艺学院番茄种质创新实验室,保存于贵州大学农学院植物病理教研室。TSWV毒源来自西北农林科技大学园艺学院番茄种质创新实验室,于-80℃保存备用。苯并噻二唑(BTH)购自上海源叶生物科技有限公司。
1.2 试验方法
1.2.1 试验场所 试验地点为贵州大学农学院农业微生物特色重点实验室和植物病理教研室植物生长气候室。
1.2.2 BTH处理及TSWV接种方法 对5片真叶期的番茄幼苗设置4个处理,分别为:(1)对照(Control);(2)BTH;(3)Control +TSWV;(4)BTH+TSWV。Control 为清水处理;BTH处理浓度为0.1 mmol·L-1, 用BTH溶液进行叶面喷雾,直至液珠均匀分布于叶面上。TSWV接种的时间为BTH处理48 h后,接种方法参考石岩等[21]的方法,每个处理15株,3次重复。

1.2.4 TSWV含量检测方法 在接种TSWV 21 d后,采集第3片真叶提取RNA,每个处理15株,重复3次,同一处理随机选择3~5株等量混合提取总RNA。总RNA提取通过TRIzol法,DNAase祛除DNA后,反转录成cDNA,用于定量检测的模板。通过实时荧光定量PCR(quantitative reverse transcription PCR, qRT-PCR)技术检测TSWV的含量,引物如表1所示。反应体系20.0 μL:SYBR Master Mix(2×)10.0 μL,正、反向引物各0.8 μL,cDNA模板4.0 μL,焦炭酸二乙酯(diethyl pyrocarbo-nate, DEPC)H2O 4.4 μL。扩增程序:95℃预变性10 min;95℃变性15 s,60℃退火15 s,40个循环;95℃变性10 s,65℃退火10 s,95℃延伸5 s。每个样品设置3个生物学重复和3个技术重复。
1.2.5SlMAPK1、SlMAPK2和SlMAPK3表达量测定方法 另选取30株5片真叶期的矮番茄幼苗,分为2组,每组15株,重复3次(采集样品是随机取3~5株等量混合,3次技术重复)。其中一组用0.1 mmol·L-1BTH进行叶面喷雾,另一组用清水处理作为对照。分别于BTH处理后0、0.5、1.0、3.0、6.0、12.0 h取第3片真叶,使用qRT-PCR技术测定SlMAPK1、SlMAPK2和SlMAPK3的表达量,具体方法与检测TSWV含量的方法一致。以SlEF1α为内参基因,引物如表1所示,每个处理设置3个生物学重复和3个技术重复。

表1 所用引物Table 1 Primers in this study
1.2.6 石蜡切片方法 在接种TSWV 21 d后,采集第3片真叶中间包含叶脉的部分(1.0 cm×1.0 cm),在卡诺固定液中进行固定,送往赛维尔生物公司(武汉)进行包埋、切片、制片,使用体式显微镜(M205 FA,德国Leica)进行拍照。
1.2.7 发病严重度检测 在接种21 d后,检测4个处理中各番茄植株的发病情况,发病严重度分级标准如表2所示[21]。
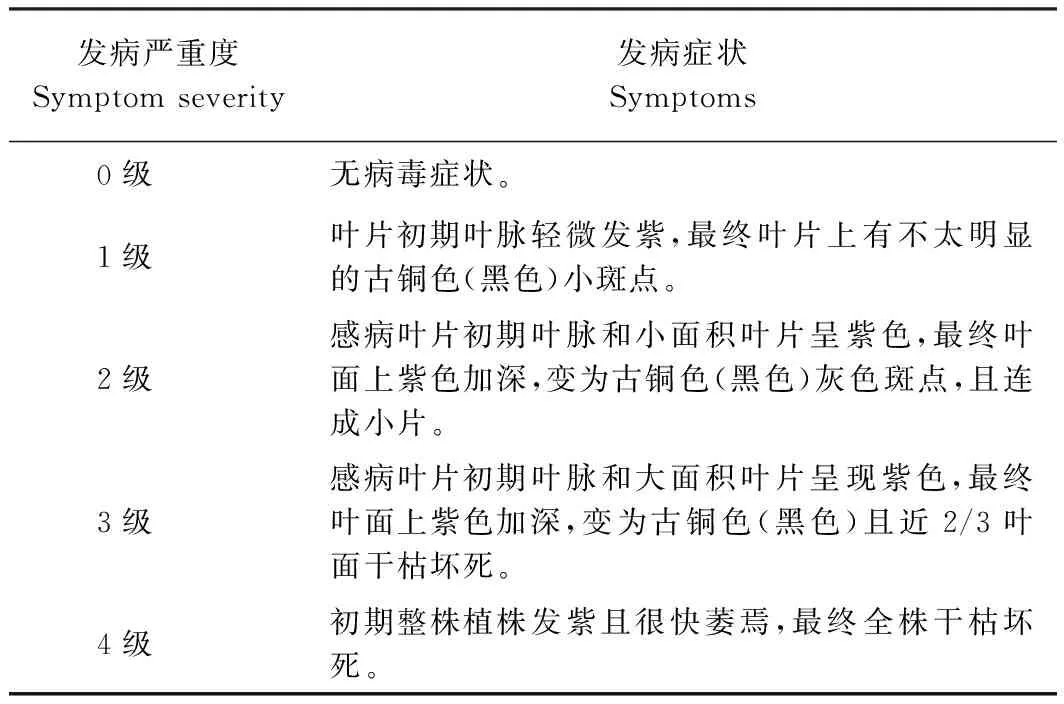
表2 番茄斑萎病毒病发病严重度分级标准Table 2 Grading standard for severity of tomato spotted wilt disease
1.3 数据分析
采用Excel 2017统计数据,SPSS 22.0软件分析显著性差异(P<0.05,Tukey’s test),Origin 9.1软件作图。
2 结果与分析
2.1 BTH前处理对番茄植株发病严重度的影响
如表1所示,在未接种病毒时,番茄植株表现为无症状。在0.1 mmol·L-1BTH前处理的番茄植株上接种TSWV,其发病严重度低于直接接种TSWV的植株,表明BTH前处理能够提高番茄植株对TSWV的抗病性。

表3 番茄植株发病严重度Table 3 The disease severity in tomato plant
2.2 BTH前处理对番茄植株TSWV拷贝数的影响
在接种病毒21 d后,通过qRT-PCR检测TSWV的拷贝数,如图1所示。0.1 mmol·L-1BTH+TSWV处理中TSWV的拷贝数显著低于Control+TSWV处理。表明BTH前处理能够抑制TSWV在番茄植株内的复制,从而提高番茄植株对TSWV的抗性。
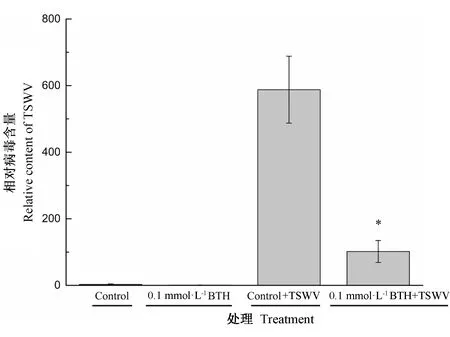
注:*表示差异显著(P<0.05)。下同。Note: * indicates significant difference at 0.05 level. The same as following.图1 番茄叶片TSWV相对含量Fig.1 TSWV relative content in tomato leaves
2.3 抗氧化能力


注:不同小写字母表示处理间差异显著(P<0.05)。下同。Note: Different lowercase letters indicate significant difference among treatments at 0.05 level. The same as following.图2 番茄叶片抗氧化活性Fig.2 Antioxidant activity in leaves of tomato plants
2.4 质膜稳定性
接种TSWV当天(0 d),各处理组植株的离子渗透率与MDA含量无显著差异(图3)。在接种6 d后,BTH+TSWV处理组离子渗透率和MDA含量均显著低于Control+TSWV处理,并保持到接种12 d。接种12 d时BTH+TSWV处理的离子渗透率(32.91%)和MDA含量(8.09 μmol·g-1FW)比Control+TSWV处理的离子渗透率(37.17%)和MDA含量(9.77 μmol·g-1FW)分别低12.90个百分点、20.8%。证明0.1 μmol·g-1BTH前处理能够提高质膜的稳定性,减轻TSWV对质膜的破坏,从而提高番茄对TSWV的抗性。
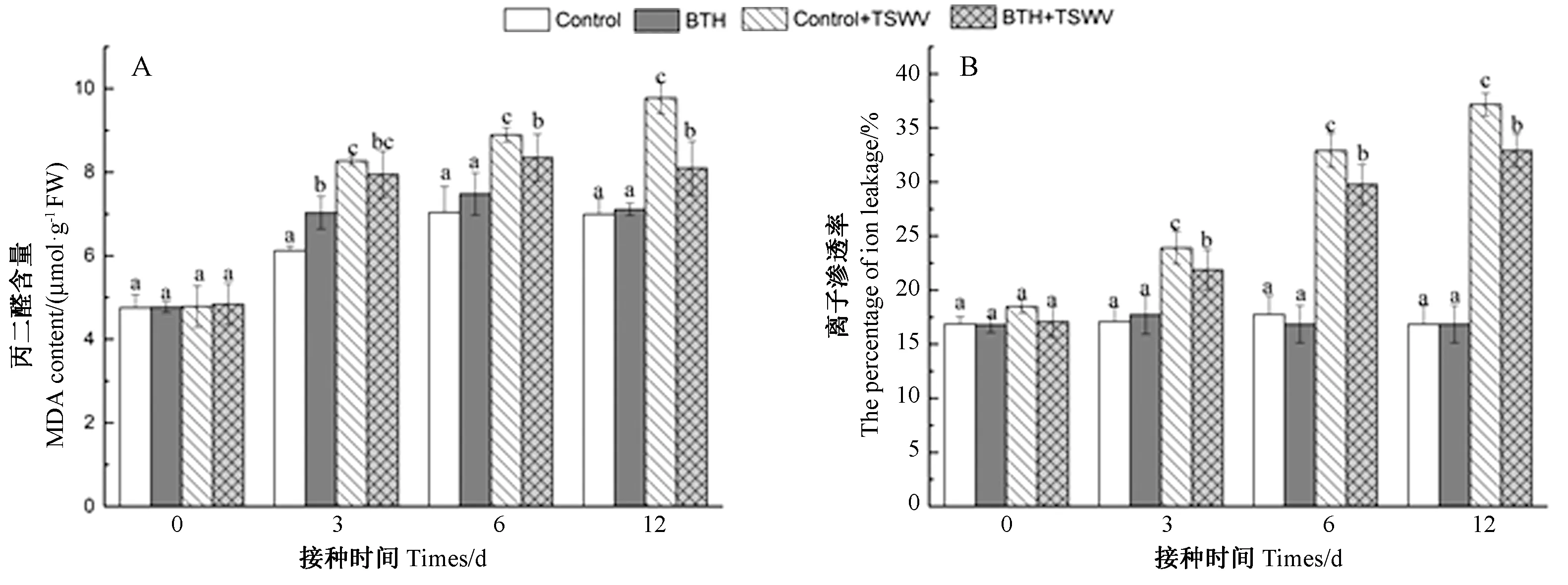
图3 番茄叶片质膜稳定性Fig.3 The stability of plasma membrane in tomato leaves
2.5 BTH抑制TSWV对细胞的解离
在Control+TSWV处理中,观察茎的横向切面可知(图4-B),细胞高度解离,细胞粘液化程度高,大部分细胞解体;观察叶片径向切面可知(图4-F),叶片的栅栏组织与海绵组织分界不明显,细胞解离程度明显高于对照。经BTH+TSWV处理(图4-D、H)的细胞解离程度明显低于Control+TSWV处理。同时BTH处理与Control处理的叶肉细胞的状态无明显差异。上述结果表明,BTH前处理能够明显减轻TSWV对番茄细胞的伤害。

注:A:Control处理组的茎横切面;B:Control+TSWV处理组的茎横切面;C:BTH处理组的茎横切面;D:BTH+TSWV处理组的茎横切面;Control 处理组的叶片纵切面;F:Control+TSWV处理组的叶片纵切面;G:BTH处理组的叶片纵切面;H:BTH+TSWV处理组的叶片纵切面。Note: A: Cross section of stem in Control treatment group. B: Cross section of stem in Control+TSWV treatment group. C: Cross section of stem in BTH treatment group. D: Cross section of stem in BTH+TSWV treatment group. E: Longitudinal section of leaf in Control treatment group. F: Longitudinal section of leaf in Control+TSWV treatment group. G: Longitudinal section of leaf in BTH Treatment group. H: Longitudinal section of leaf in BTH+ TSWV treatment group.图4 TSWV对番茄叶片细胞的破坏程度Fig.4 The damage of TSWV to cells in tomato plant
2.6 BTH前处理诱导的SlMAPK1/2/3表达
如图5所示,0.1 mmol·L-1BTH处理0.5 h后,SlMAPK1、SlMAPK2、SlMAPK3的表达量均显著高于对照。在BTH处理后的0.5~12.0 h之内,SlMAPK3的表达量均显著高于对照,而SlMAPK1、SlMAPK2的表达量变化趋势大致相同,均为先升后降,表达量仅在个别时间段显著高于对照。上述结果证明0.1 mmol·L-1BTH处理能够激发丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)级联通路。

图5 BTH前处理诱导的SlMAPK1/2/3的表达Fig.5 Expression of SlMAPK1/2/3 induced by BTH pretreatment
3 讨论
本研究通过施用诱抗物质BTH提高了番茄植株的抗氧化能力、降低了病毒含量,从而降低病毒对叶片细胞的破坏、提高植株对TSWV的耐性,表明诱导植物抗性可以用于防治植物病毒,这与于力等[25]报道发现BTH可以提高番茄植株对番茄黄化曲叶病毒(tomato yellow leaf curl virus, TYLCV)的抗性表现一致。但是TSWV属于RNA病毒,而TYLCV属于DNA病毒,因此推断BTH诱导的植物抗性不仅可以耐DNA病毒而且可以耐RNA病毒。另外,BTH诱导的植物抗性可以防御植原体,如Damelio等[26]研究发现BTH可以减轻黄化植原体(chrysanthemum yellows phytoplasma, CYP)对菊花的损伤、提高菊花对CYP的抗性。因此推断BTH诱导的植物抗性属于广谱性抗性。
本研究还发现BTH可以提高植物体内抗氧化防御酶活性,这与李江文等[27]的研究一致。随后也有研究发现诱抗剂,如BTH和壳聚糖,可以提高植株叶片POD、PPO与PAL活性和植株的抗病性,从而推断防御酶主要参与调控木质素与抗菌物质的合成。另外,防御酶可以清除活性氧(reactive oxygen species, ROS),降低ROS对细胞膜的损害,从而降低细胞的解离和破坏[28-30]。而Jiang等[31]与马晖玲等[32]报道BTH可以诱导马铃薯采后伤口ROS累积,有助于伤口愈合,这一结果与本试验相反,可能原因是病毒侵染和薯块伤口愈合的生理调节过程有所不同,更重要的是前者理样品为薯块,而本试验为植株的叶片,导致不同植株部位对BTH处理反应有所不同。MDA是膜脂过氧化的产物,能够改变质膜透性,破坏质膜的结构和功能[33]。本试验通过检测MDA含量反应细胞膜的完整性,表明BTH可以缓减病毒对细胞的裂解与破坏,这与国淑梅等[34]研究结果一致。另外,本研究在实验室环境中进行,而田间环境相对复杂、不可控因素较多,因此植物诱导抗性抗病毒的效果有待进一步研究。
丝裂原活化蛋白激酶(MAPK)级联信号在植物诱导抗性中发挥重要作用,在MAPK级联通路中,MAPKKK最先被胞外信号磷酸化激活,并通过磷酸化作用,将信号逐级传递到MAPKK和MAPK[35]。本试验发现BTH可以诱导番茄MAPK级联相关基因SlMAPK1、SlMAPK2、SlMAPK3的表达,而前人研究发现拟南芥中AtMAPK3和AtMAPK6对于诱导抗性至关重要,且SlMAPK3和AtMAPK3同源,SlMAPK1/2和AtMAPK6同源[20],因此推测番茄MAPK级联信号系统可能同样参与BTH诱导的番茄抗病毒防御。MAPK级联信号不仅在植物抗病方面发挥重要作用,在植物抗逆方面同样重要[36]。Lv等[37]研究发现,SlMAPK1/2与一氧化氮(nitric oxide,NO)在番茄抗低温信号系统中存在联系。此外在番茄抗低温研究中SlMAPK1/2和活性氧H2O2信号之间也存在交叉[38],至于在番茄抗TSWV中SlMAPK1/2与H2O2之间的交叉关系,仍需进一步研究。
BTH前处理能够诱导MAPK级联通路和水杨酸(salicylic acid, SA)、茉莉酸(jasmonic acid, JA)通路相关基因的表达[20,39-41],MAPK被激活后,能够磷酸化不同的效应蛋白以表现出不同的功能,并且可以进入细胞核,作用于转录因子从而调控基因的表达[36],番茄SlMAPK1/2/3下游磷酸化靶标底物是什么,以及BTH诱导的番茄耐TSWV是否是由MAPK级联信号介导的SA信号通路等,仍需进一步研究。
4 结论
本研究结果表明,0.1 mmol·L-1BTH前处理能够激发番茄MAPK级联通路关键基因SlMAPK1、SlMAPK2、SlMAPK3的表达,降低TSWV对番茄叶片质膜稳定性和抗氧化能力的破坏程度,降低病毒对番茄叶片细胞的解离与破坏程度,降低病毒在番茄叶片内的含量,增强番茄植株对TSWV的耐性,诱导植物抗病性以抵御植物病毒侵染。

