发酵鲭鱼中一株组胺降解菌的系统发育分析及特性研究
吴彩叶 汤海青 欧昌荣
(1 浙江医药高等专科学校食品学院,浙江 宁波 315500;2 宁波大学食品与药学学院,浙江 宁波 315800)
鱼类因富含蛋白质、脂肪、矿物质和维生素而营养丰富,是人类饮食中动物性蛋白质的重要来源之一。但鱼类及其制品在加工及贮藏期间极易发生腐败,且鱼体或环境中具有氨基酸脱羧酶活性的微生物可能将氨基酸脱羧形成生物胺[1],增加生物胺中毒的风险。生物胺是一类具有生物活性的小分子量含氮化合物,适量的生物胺对人体的生理功能具有有益作用,但摄入过量可能引起多种不适[2-4]。近年来,生物胺中毒事件主要集中在因食用青皮红肉鱼而引起的组胺中毒。由于生物胺的过量产生意味着食品品质降低和安全性问题,因此食品中组胺及酪胺等生物胺的含量也被作为评价食品安全的重要指标[5]。
在食品加工及贮藏过程中对潜在的组胺超标风险进行控制,降低组胺含量,对于保证食品品质具有重要意义。根据组胺产生机理,可从两个方面进行:1)控制食品中的产胺菌,抑制菌体生长和产胺,从而减少组胺的生成;2)对食品中已产生的组胺进行降解处理。目前,在加工及贮藏过程中,通常使用物理手段抑制产胺菌,如低温贮藏、臭氧处理、辐照杀菌、超高压灭菌、气调控制等[6-10]。这些方法需专用设备且耗能较大,虽在一定程度上减少了生物胺的产生,但不能消除已产生的生物胺。与上述方法比较,生物控制方法,如添加特定微生物或酶,可降解生物胺,从而降低食品中的生物胺含量。已有研究表明在腌渍鱼[11]、鱼露[12]和鱼酱[8]中接种组胺降解菌,通过其生长产酶,降解了原料中本身存在的及加工贮藏中产生的组胺,同时减弱了鱼腥味、氨味、腐臭味,提高了感官品质,具有一定的应用价值。因此,生物胺降解菌的底物多样性、降解效率和安全性等研究,成为开发生物胺控制技术的热点问题。
目前,国内外针对传统发酵鲭鱼中强化接种降解生物胺的研究鲜有文献报道。基于此,本试验从传统发酵鲭鱼中筛选分离出具有组胺降解活性的微生物,对其进行系统发育分析,确定分类地位,考察该菌的生长和降解特性,初步分析其产组胺降解酶的粗酶特性,并将该菌接种至传统发酵产品,研究其在发酵中对组胺等生物胺的影响,以期为水产食品的生物胺控制提供理论基础。
1 材料与方法
1.1 材料与试剂
鲭鱼(Scomberjaponicus),每尾重350±35 g,购自宁波M6生鲜超市,置于无菌保鲜袋内并用冰块保存,立即运送至实验室进行发酵鱼的制备。散装酒酿,原辅料包括水、糯米和酒曲,未杀菌,购自宁波三江购物超市。
组胺、组胺盐酸盐,均为分析纯,上海国药集团化学试剂有限公司;精胺、亚精胺、腐胺、尸胺、组胺、2-苯乙胺、酪胺和色胺等8种生物胺混合标准品(≥98%),1,7-二氨基庚烷(≥98%),美国Sigma公司;乙腈、乙醇、正己烷、二氯甲烷、乙酸、七氟丁酸,均为色谱纯,德国Merck公司;乳酸细菌(man rogosa sharpe,MRS)培养基,结晶紫中性红胆盐葡萄糖琼脂(violet red bile dextrose agar,VRBDA)培养基,2216E琼脂培养基,营养肉汤培养基和营养琼脂培养基,青岛海博生物技术有限公司;其他试剂均为国产分析纯;水为超纯水。
1.2 仪器与设备
5804R冷冻离心机,德国艾本德股份公司;BSA224S电子天平,北京赛多利斯科学仪器有限公司;KS-600E I型超声清洗器,宁波署科仪器有限公司;HWS 智能型恒温培养箱,宁波江南仪器厂;SW CJ-1D 超净工作台,河南天驰仪器设备有限公司;Alliance e2695/Xevo TQ MS液相色谱-三重四极杆串联质谱联用仪、色谱柱ACQUITY HSS T3(100 mm ×2.1 mm, 1.8 μm),美国Waters公司;IKA T18 ULTRA-TURRAX匀浆机,艾卡(广州)仪器设备有限公司;T6紫外可见分光光度计,北京普析通用仪器责任有限公司。
1.3 试验方法
1.3.1 传统发酵鱼制备 将新鲜的鲭鱼洗净,去头、尾和内脏,切成3 cm×4 cm的小块,按10∶1(鱼/盐质量比,w/w)加入食盐,均匀涂抹,4℃下腌制48 h,沥干。经热风干燥12 h至含水量为45%±5%,装瓶,按1∶1(鱼/酒酿质量比,w/w)加入酒酿,压实并密封,于30℃培养箱进行发酵。
1.3.2 菌株筛选分离 分别以MRS、VRBDA和2216E琼脂做为分离培养基。取25 g发酵鱼样品,加入225 mL无菌生理盐水,在均质袋内匀浆。经10倍梯度稀释后,选取10-3、10-4、10-5稀释度涂布于分离培养基平板,30℃培养48 h。结合菌落特点挑取单菌落接入营养肉汤培养基中,30℃培养48 h,测定组胺浓度和酶活力。筛选不产组胺且组胺降解活力较高的菌株,经平板划线分离纯化后,于营养琼脂斜面4℃保藏备用。
1.3.3 组胺含量及组胺降解酶活力的测定 菌体培养物中组胺含量及酶活力的测定依据Okayama等[13]的方法并稍作修改。取2 mL菌体培养物,4℃、10 000 r·min-1条件下离心10 min。取上清液0.5 mL测定组胺含量。另取上清液0.5 mL于10 mL玻璃试管中,加入0.5 mL酶反应混合液[包括0.1 mol·L-1磷酸钾缓冲液(pH值7.4)、1 000 μg·mL-1组胺、0.1 mmol·L-1氨基胍],37℃反应20 min,结束时加入0.5 mol·L-1盐酸终止反应,于分光光度计中在波长460 nm下测定吸光值OD460值。对照组加入上清液和酶反应混合液后,立即加入0.5 mol·L-1盐酸终止反应。酶活单位定义为:每mL样液使反应体系在1 min 内组胺减少1 μg所含的酶量为一个酶活单位(enzyme activity, EA,U·mL-1)。
1.3.4 菌种鉴定 对组胺降解菌进行形态观察、革兰氏染色、氧化酶和过氧化氢酶试验,并进一步使用16S rRNA基因序列分析进行菌种鉴定。将纯化的菌株交于苏州泓讯生物有限公司进行DNA提取、PCR扩增和测序,选用引物为通用引物(27F和1492R)。将得到的16S rRNA序列提交到基因库(GenBank),用BLAST软件与已知序列进行对比,使用邻接法(Neighbour-Joining)进行系统发育及分子进化分析并绘制系统发育树,确定所测菌株的系统发育地位。
1.3.5 生长条件对菌株的生长和产酶的影响 将新鲜培养的菌株接种到装有50 mL营养肉汤培养基的250 mL 三角瓶中,改变培养基和培养条件的参数:培养温度(4、20、25、30、35、40、45℃);pH值(4、5、6、7、8、9);NaCl浓度(0.5%、1.5%、2.5%、3.5%、4.5%、5.5%、6.5%、7.5%、8.5%)。摇瓶转速160 r·min-1,培养24 h。分别测定菌体培养物的OD600值和酶活力。
1.3.6 酶学性质的初步研究 将菌体培养物上清液在不同温度(20、25、30、35、40、45℃)和不同pH缓冲体系(pH值3~8的磷酸氢二钠-柠檬酸缓冲液;pH值8~10的甘氨酸-氢氧化钠缓冲液)条件下进行酶促反应,通过测定酶活力以确定其反应的最适温度和最适pH值。将酶液在30℃下不同pH值(5、6、7、8、9、10)的缓冲液中保存1 h,调节至最适pH值测定酶活力,以确定酶的pH值稳定性,在不同温度(20、25、30、35、40、45℃)下置于pH值7的缓冲体系中反应,测酶活力确定其热稳定性。通过向酶反应体系中分别加入金属离子Na+、Cu2+、Mn2+、Ca2+、Mg2+、 K+和Fe3+以及乙二胺四乙酸(ethylene diamine tetraaceticacid, EDTA)的溶液,使其在反应体系中的终浓度均达到5 mmol·L-1,测定酶活力。
1.3.7 发酵鱼的人工接种 将筛选得到的菌株接种于营养肉汤培养基中,30℃培养48 h,于4℃、10 000 r·min-1离心10 min,用0.85%无菌生理盐水将菌体重悬后,离心重复上述操作1次,制备107CFU·mL-1菌悬液,置于4℃冰箱备用。按1.3.1分别制备发酵鲭鱼对照组和接种组。接种组在装瓶前,采用喷洒方式将菌悬液接种到腌制并干燥的鱼体中,接种量5%(每100 g鱼体接种5 mL菌悬液),按1∶1(鱼/酒酿质量比)加入酒酿。置于30℃恒温箱发酵16 d,每4 d取样测定生物胺含量。
1.3.8 发酵鱼生物胺含量的测定 使用液相色谱-质谱法(high performance liquid chromatography-mass spectrometry,HPLC-MS)进行发酵鱼中生物胺含量的测定。具体过程如下:取2 g发酵鱼样品,加入20 mL水后,用匀浆机进行均质。匀浆结束后,分别加入20 mL乙腈、3 mL乙醇、5 mL正己烷,混匀,于4℃、5 000 r·min-1条件下离心5 min,取下层液体,加入2 mL二氯甲烷混匀。再次用离心机在相同条件下离心5 min,弃上清液后再加入1 mL二氯甲烷,混匀后离心取上清液,用0.22 μm膜过滤后上机。色谱柱:ACQUITY HSS T3 (100 mm × 2.1 mm,1.8 μm);流动相:2 mmol·L-1乙酸铵(A)-含0.1%甲酸的甲醇(B);梯度洗脱:0~0.1 min,95%A;0.1~9.85 min,95%~0%A;9.85~11.4 min,0%A;11.4~11.5 min,0%~95%A;11.5~14 min,95%A;柱温:30℃;流速:0.2 mL·min-1;进样量:5 μL。质谱条件包括:ESI离子源(正离子模式);离子喷雾电压(3 500 V);锥孔电压(15 V);脱溶剂温度(500℃);脱溶剂流量(1 100 L·h-1);锥孔气流量(100 L·h-1);碰撞气流量(0.15 mL·min-1)。
1.4 数据处理与分析
采用Origin 2018软件进行作图,使用SPSS 19.0软件进行Duncan差异显著性检验和Person相关性分析,所有试验重复3次。
2 结果与分析
2.1 筛选和鉴定
经平板分离、酶活力和组胺测定以及菌种鉴定,得到多株具有组胺降解能力的革兰氏阴性菌(表1),部分菌株同时具有产组胺能力。其中,使用2216E培养基分离的菌株V-TB-2-5的组胺降解能力较高,且不产组胺。该菌株于30℃在2216E培养基上培养48 h后,菌落呈枚红色,圆形,边缘整齐光滑。经镜检为革兰氏阴性菌,短杆状,菌体大小为0.8 μm×0.3 μm。
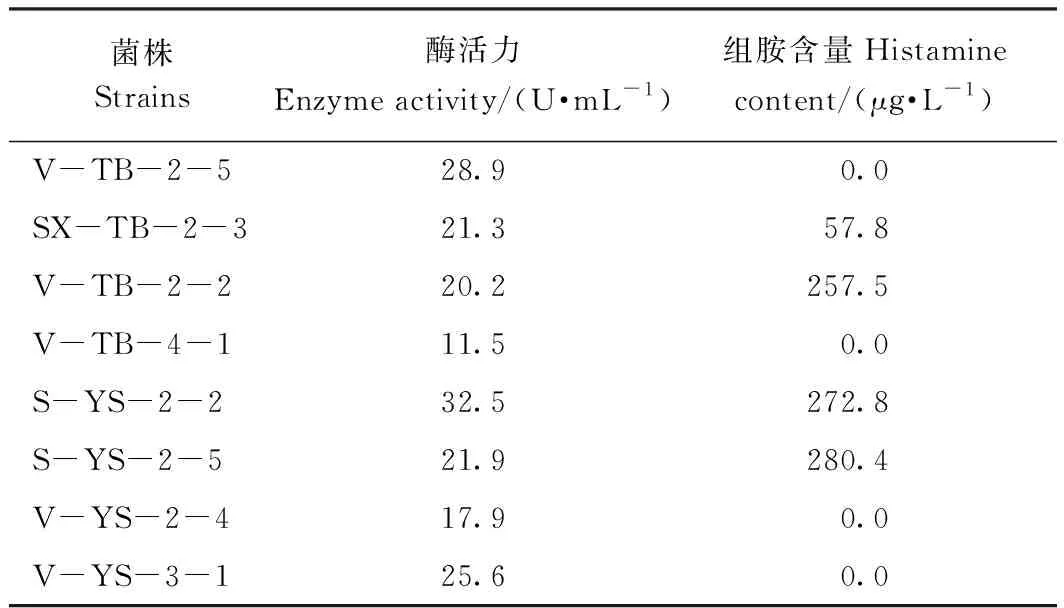
表1 部分菌株产组胺降解酶和产组胺能力的比较Table 1 Comparison of histamine-degrading enzyme and histamine production by bacterial strains
对菌株V-TB-2-5的16S rRNA进行PCR扩增,PCR产物测序得到1 381 nt核苷酸序列,在GenBank中提交并与模式菌株进行同源性比较,绘制系统发育树(图1)。在系统发育树中,分离菌株V-TB-2-5与产氮假单胞菌Pseudomonasazotoformansstrain WXCDD51聚类在一个分支,亲缘关系最近,16S rRNA序列的一致性高达99%。结合菌株的形态学,可基本确定分离菌株为一种产氮假单胞菌,命名为Pseudomonasazotoformansstrain V-TB-2-5。与图1中显示的亲缘关系较近的雪松假单胞菌(Pseudomonascedrella)和边缘假单胞菌(Pseudomonasmarginalis)同属于假单胞属rRNAI群荧光DNA同源组。
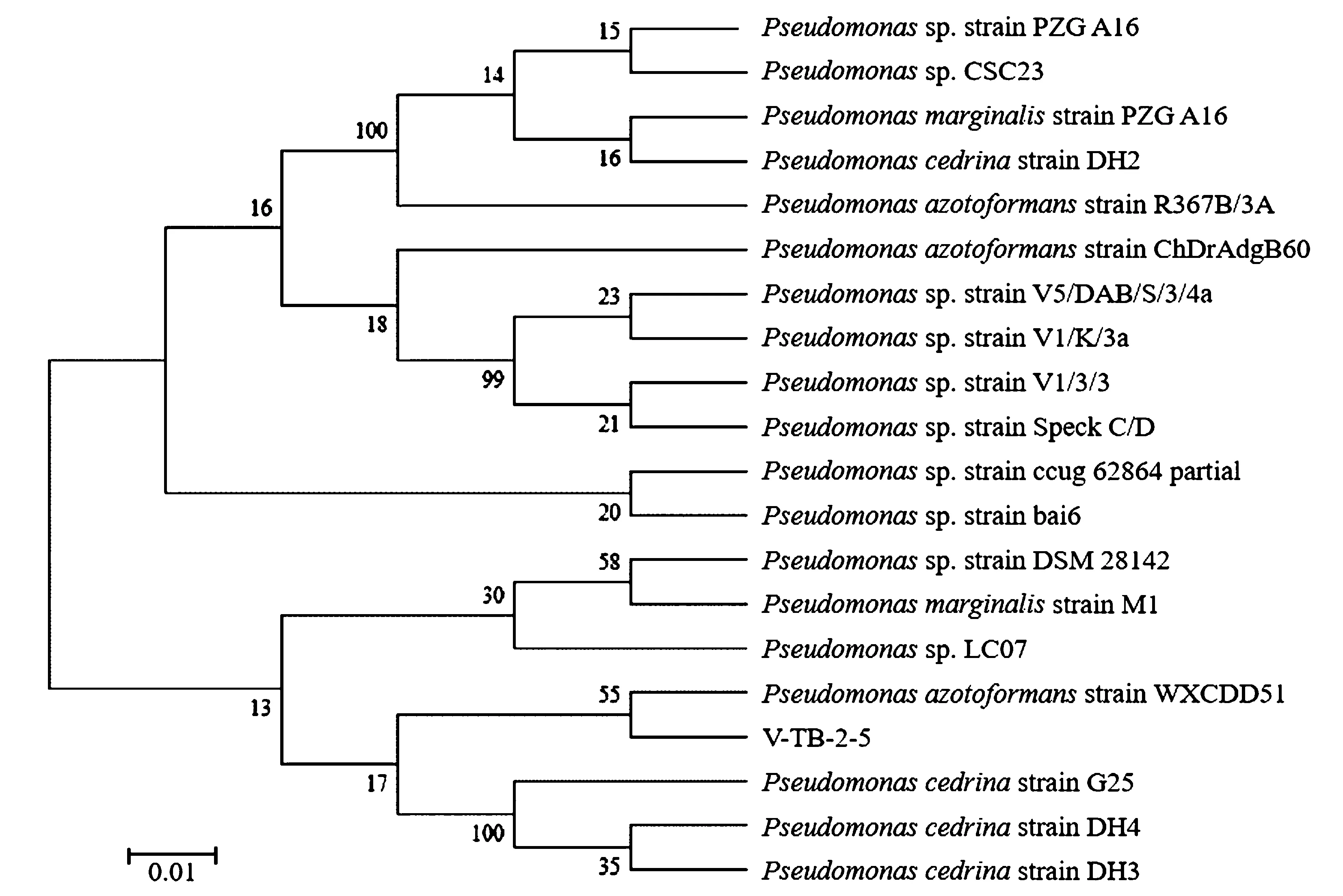
图1 菌株V-TB-2-5的基因序列系统发育树Fig.1 Phylogenetic tree of strain V-TB-2-5 and other reference species based on 16S rRNA gene sequence
2.2 生长条件对菌株生长和产酶的影响
菌株V-TB-2-5在营养肉汤培养基中生长,组胺降解酶的生成和菌株生长基本同步,主要来源于菌的初级代谢(图2-A)。20~40℃为该菌适宜的生长和产酶温度范围,并在30℃达到峰值,为典型的中温菌(图2-B)。在pH值5~8的范围内,该菌能够保持良好的生长和产酶能力,适合中性偏酸的生长环境,过酸和过碱的条件均会抑制其生长和产酶活力 (图2-C)。该菌在1.5%的NaCl发酵液中生长良好,且保持较高的酶活力,但随着NaCl浓度增大,对菌株的抑制作用也越明显;当NaCl浓度达到3.5%以上,菌株的生长和产酶活力被抑制(图2-D)。

图2 生长条件对菌株生长和产酶的影响Fig.2 Effect of growth conditions on growth and enzyme production of strain
2.3 酶学特性研究
对发酵液中组胺降解酶的酶学性质研究表明,该酶的反应最适pH值为7,且在pH值3~9范围内均可达到50%以上的相对酶活力(图3-A)。将酶在不同ph值的缓冲液中保存1 h后测定酶活力,考察pH值稳定性。该酶的pH值稳定范围为5~7,酶活力保持在90%以上,随着pH值的升高,酶活力的损失程度也随之增加(图3-B)。酶反应的最适温度为30~35℃,在20~45℃的范围内可保持60%以上的酶活力(图3-C),酶的稳定性随保存时间延长而逐渐降低(图3-D)。说明该酶的工作pH值和温度范围以及酶的稳定性适中,符合本研究鲭鱼发酵的工作条件。由表2可知,在Mn2+、Mg2+和K+等离子存在时,酶活力增加;而当Fe3+离子存在时,酶活力下降;并且在EDTA存在下酶活力完全丧失,说明该酶的正常功能与某些金属离子有关,为金属酶。
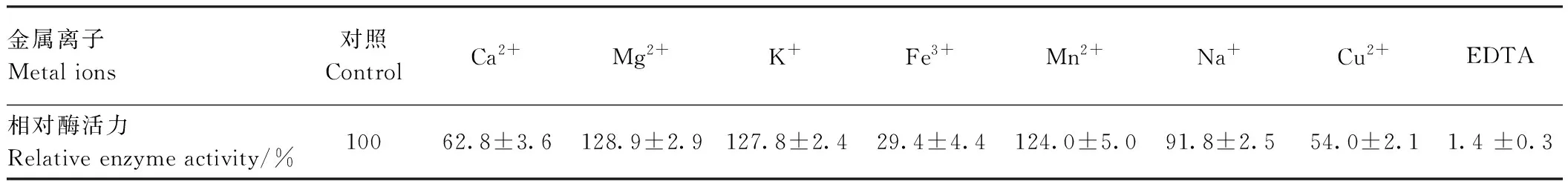
表2 金属离子对组胺降解酶活力的影响Table 2 Effects of metal ions on histamine-degrading enzyme activity
2.4 组胺降解菌降解特性的研究
应用菌株V-TB-2-5强化接种发酵鲭鱼,考察其在实际发酵环境中对组胺及其他生物胺的降解能力。发酵鲭鱼产品的成熟时间为12 d,取样至16 d。在鲭鱼对照组的发酵过程中,常见的8种生物胺随时间的延长,不断的积累或消耗(图4),组胺、酪胺、亚精胺和色胺发生了积累,精胺和腐胺含量先升高后降低,尸胺和苯乙胺含量在发酵过程中整体呈下降趋势。其中,组胺、亚精胺、尸胺和精胺的含量相对丰富,最高量分别达到1 142.8 μg·kg-1(12 d,对照组)、1 137.6 μg·kg-1(16 d,对照组)、692.9 μg·kg-1(0 d,对照组)、1 089.9 μg·kg-1(12 d,接种组)。接种后,3种生物胺的含量出现明显下降(P<0.05),尸胺含量在不同时间的降解率为13.1%~19.6%,组胺为18.2%~40.7%,亚精胺为95.8%~97.2%。同时,观察到人工接种组的精胺含量在8~16 d增加了49.4%~113.6%。

注:不同小写字母表示差异显著(P<0.05)。Note: Difference lowercase letters indicate significant differences at 0.05 level.图4 菌株V-TB-2-5发酵鱼中生物胺的降解情况Fig.4 Degradation of biogenic amines in fermented fish inoculated by strain V-TB-2-5
3 讨论
从鱼露、发酵鱼及香肠等传统发酵食品中筛选分离微生物,是获得组胺生成菌和降解菌的主要途径[14]。本试验从传统发酵鲭鱼中筛选得到的组胺降解菌中,若干菌株能够在发酵过程中同时产生组胺,这与其他从发酵食品中分离组胺相关菌的研究结果相似[15-16]。
本试验分离得到的产氮假单胞菌属于假单胞菌属荧光假单胞菌组。假单胞菌属(Pseudomonadaceaesp.)多分布于土壤、水及各种植物体中,具有极强的分解有机物的能力[17]。已报道的产氮假单胞菌分布于深海沉积物、植物根系及畜产品等[18-19],被用于改善土质、抗植物病害、增强植物生长或提高产量等[20]。根据文献,鲜见该菌具有组胺降解能力的报道。菌株V-TB-2-5发酵产酶的生物合成模式是生长关联型,在不同培养条件下,生长和发酵液酶活的趋势均保持一致,并在相同时间出现高峰。说明该菌株在发酵初期将组胺降解酶分泌到胞外,从而对组胺进行代谢并获得菌体生长所需的营养和能量。一般来说,不同来源的组胺降解菌和降解酶对环境条件的耐受程度不同。Murooka等[21]发现细菌的组胺降解酶是内源性酶,培养基pH值过酸或过碱可能使细胞活力丧失,从而影响组胺降解活性。此外,从嗜盐性分析,菌株生长的适宜氯化钠浓度为0~3.5%,说明对氯化钠的耐受性一般,可能不适合应用于其他高盐的发酵水产品,如鱼露等。
该酶的最适温度范围为30~35℃、最适pH值7,与菌株生长条件相似,符合生长关联型的特征。各酶学性质参数基本符合部分组胺降解酶的相关报道,如最适pH值为中性以及金属酶特性[22]。由于来源和菌种不同,组胺降解酶的酶学性质也存在一定差异。如Xu等[23]分离的汕头盐单胞菌(HalomonasshantousisSWA25)在30~40℃时生物胺降解活性最高,与本研究相似;而Tapingkae等[24]分离到的1株组胺降解菌N.gari在40~55℃时活性最高,Sekiguchi等[25]分离到的组胺氧化酶在60℃时仍能保持较好的活性。此外,本研究发现该酶对温度和pH值的敏感性均较高,与Heo等[22]的报道一致。综合来看,菌株的生长条件与酶学性质各项指标均符合发酵鲭鱼的生产条件,具备实际应用的可能性。
不同细菌的生物胺代谢能力差别很大,大部分菌株只能代谢1~2种生物胺,部分菌株可同时产生或降解多种生物胺,如Ben-Gigirey等[26]从冷冻金枪鱼中分离的嗜麦芽寡养单胞菌(Stenotrophomonasmaltophilia)可同时产生组胺和精胺,Jiang等[27]从鱼酱油中筛选的汕头盐单胞菌(HalomonasshantousisSWA25)可同时高效降解8种生物胺。本试验通过强化接种菌株V-TB-2-5,对发酵鲭鱼中3种生物胺有降低作用,降解率>10%。组胺是毒性最强的生物胺,接种后降解率达到40.7%,说明在实验室条件下可对发酵鲭鱼中的组胺进行有效降解。不同细菌对组胺的降解能力有所差异,并受到环境条件和微生物群落等因素的影响,Lee等[28]在盐渍鱼发酵中接种多粘芽孢杆菌(BacilluspolymyxaD05-1),组胺降解率为34%;蓝翔等[29]在鱼露发酵中接种降胺菌M.farinoseA3和E.faeciumR7,80 d时组胺降解率最高,达到54.75%;Zaman等[30]从鱼酱油中分离的肉糖葡萄球菌(StaphylococcuscarnosusFS19),其组胺降解率受NaCl浓度的影响,在18%NaCl的鱼酱油中,降解率为15.1%,在NaCl浓度为21%时降低至13.8%。另外,本试验中发酵鲭鱼的原料采购和加工过程均严格遵守卫生标准,生物胺水平远低于各国水产品的安全限值[31]。但在贮藏和发酵条件不当时,青皮红肉鱼及相关产品易被摩根菌属及发光细菌等组胺产生菌污染,造成组胺含量超标[32],从而引起食品安全风险。
除组胺外,菌株V-TB-2-5对尸胺、亚精胺和精胺含量有明显的调节作用,且亚精胺和精胺之间存在显著的负相关(P<0.05)。许女等[33]在青鱼鱼肉发酵香肠中接种乳酸菌发酵剂后,亚精胺下降极显著,但其对照组和接种组均未检测到精胺。从生物胺的形成途径来看,亚精胺是精胺的前体物质,因此推测菌株V-TB-2-5可能在发酵过程中同时产生了精胺合成酶。发酵食品中生物胺的降解机制复杂,与发酵剂的种类和添加量、发酵体系的成分及环境条件等有关[14],如Leuschner等[34]发现M.variansLTH 1540 菌株具有降解酪胺活性,但其酶活性在pH低于5时受到强烈的抑制。与对照组比较,本试验接种组中未发现对其他生物胺的降解作用,可能是由于该菌株在发酵环境中缺乏其他生物胺氧化酶,也可能是由于酶活性受到了发酵环境因素的限制,需进一步研究。
4 结论
本研究从传统发酵鲭鱼中分离鉴定了1株组胺降解菌Pseudomonasazotoformansstrain V-TB-2-5,该菌为中温菌,适合在中性偏酸、NaCl<3%的环境中生长。通过对粗酶液酶学性质的研究,确定该酶为金属酶,最适温度和pH值分别为30℃和7。对鲭鱼进行强化接种并发酵,组胺降解率可达40.7%,该菌具备在水产品中降低组胺的应用前景。可见,在传统发酵鲭鱼中增加具有组胺降解能力的产氮假单胞菌,可以有效地降低其组胺含量,对于提高发酵水产品的食用安全性有重要应用价值。后续将进一步研究产氮假单胞菌的安全毒理学评估以及其对发酵水产品的感官、理化性质及微生物群落的影响。

