水稻雄性不育突变体dtp1的细胞学分析与基因定位
沈亚琦 蒋文翔 项圆圆 王联红 张秋云 刘家林 贺浩华 胡丽芳
(江西农业大学农学院/作物生理生态与遗传育种教育部重点实验室/江西省超级稻工程技术研究中心/双季稻现代化生产协同中心,江西 南昌 330045)
植物的雄性不育现象广泛存在于自然界中,对植物杂种优势的利用具有重要作用。花药作为水稻(OryzasativaL.)重要的生殖器官,研究水稻花药发育的相关过程对阐明其雄性生殖发育机制及调控途径具有重要的理论意义与应用价值[1]。水稻花药发育起始于花芽中的雄蕊原基顶端,首先由花药原表皮下方四个角隅处分化出孢原细胞,孢原细胞随后经过一系列发育过程分化为由表皮、内皮层、中层和绒毡层组成的四层壁细胞和小孢子[2]。绒毡层和花粉壁的正常发育对花药的形成至关重要,参与其发育过程的基因一直是水稻花药发育的研究重点[3-4]。
目前分离出参与水稻花药绒毡层发育过程的基因包括TDR(TapetumDegenerationRetardation)[5]、TIP2(TDRInteractingProtein2)[6]、TIP3(TDRInteractingProtein3)[7]、OsAGO2(ARGONAUTE2)[8]、EDT1(EarlierDegradedTapetum1)[9]和DTC1(DefectiveTapetumCellDeath1)[10]等。tdr突变体中绒毡层降解迟缓,小孢子无法正常发育;tip2突变体绒毡层细胞程序性死亡(programmed cell death, PCD)中断;tip3突变体中绒毡层程序性死亡延迟,导致无成熟花粉粒形成;rms2突变体花药绒毡层降解延迟;OsAGO2基因的敲除导致活性氧的过度积累并引起绒毡层细胞程序化死亡提前发生。分离出的参与花粉外壁发育相关的基因包括CYP703A3[11]、CYP704B2[12]、Wda1(Wax-deficientanther1)[13]、PDA1(Post-meioticDeficientAnther1)[14-15]和OsGPAT3(Glycerol-3-PhosphateAcyltransferase3)[16]和DPW3(defectivepollenwall3)[17]等。细胞色素P450基因家族成员CYP703A3和CYP704B2基因的突变植株都会表现出发育缺陷的花药表面角质层和花粉外壁;wda1突变体无法形成花药角质层的蜡质,花粉外壁的形成有缺陷;pda1突变体花药内表面的乌氏体减少,表面的蜡质明显降低;osgpat3突变体表现出明显的花药角质层缺陷和花粉外壁缺陷。分离出的一些参与其他花药发育过程相关的基因,如PAIR2[18]和PAIR3[19]基因的缺失或突变使得同源染色体在减数分类过程中不能正常配对,AID1(antherindehiscence1)[20]和OsFTIP7(FT-INTERACTINGPROTEIN7)[21]基因突变导致水稻花药不开裂。
水稻花药的发育是一个极其复杂的过程,尽管目前已克隆了一系列相关基因,但相关分子机制及调控网络仍有待研究,大量未知新基因有待进一步挖掘。本研究通过辐射诱导松香早粳种子获得一个稳定遗传的雄性不育突变体dtp1,并对此材料进行初步的表型鉴定、细胞学观察和基因定位,旨在为进一步完善水稻的花药发育分子机制及创制新的水稻不育系提供理论依据。
1 材料与方法
1.1 试验材料
本研究所用水稻材料松香早粳和日本晴为江西农业大学作物生理生态与遗传育种教育部重点实验室保存品种,利用60Co-γ射线对粳稻松香早梗种子进行辐射诱变,在其后代中获得一个稳定遗传的雄性不育突变体dtp1材料。松香早粳属早熟常规粳稻,全生育期113~115 d,于每年5月25日前后播种。
1.2 试验方法
1.2.1 突变体表型观察及花粉育性鉴定 植株与花药均取自2020年江西农业大学南昌科技园实验基地,随机选取野生型(wild type, WT)与突变体成熟时期植株进行拍照观察。田间随机选取野生型和突变体的成熟颖花,在解剖镜下观察雌雄蕊的数量与形态并拍照。于适宜气候的颖花开花时间,随机选取野生型和突变体颖花各8~10穗,取花药放置于载玻片上,用镊子捣碎压片,然后用1% I2-KI溶液对其进行染色,选取合适的视野观察花粉粒的形态和染色情况。
1.2.2 石蜡切片 在实验基地选取松香早粳野生型和dtp1突变体材料不同时期的小穗,根据颖花的长度将小花划分为不同的发育时期的花药,于FAA固定液(V50%乙醇∶V冰乙酸∶V40%甲醛=90∶5∶5)中固定保存,用切片机将材料切成厚度为8.0 μm的薄片,选取符合要求的切片用甲苯胺蓝染色,利用中性树胶封固后用光学显微镜观察拍照。
1.2.3 遗传分析 2019年夏季种植于江西农业大学科技园试验基地,用dtp1突变体做母本,松香早粳做父本进行杂交得到F1;同年冬季在江西农业大学海南南繁育种基地种植,收获成熟种子;2020年夏季于科技园试验基地种植亲本和F2群体,观察统计F1的育性、F2可育株与不育株分离比并进行统计分析。
1.2.4 基因定位 用CTAB法提取野生型、dtp1突变体以及F2群体中突变型单株的DNA。利用江西农业大学作物生理生态与遗传育种教育部重点实验室保存的简单重复序列(simple sequence repeats,SSR)标记筛选松香早粳和日本晴之间的多态性,选取平均分布于水稻12条染色体上的152对多态引物进行染色体连锁分析,进一步利用72个突变性单株进行突变位点初步定位。根据重测序的松香早粳和日本晴的全基因组序列,对初定位区间内的基因组序列进行对比,利用Primer premier 5.0软件设计新的InDel(insertion-deletion)分子标记,对突变基因进行精细定位,利用mapmaker 3.0软件对分离群体的标记进行连锁分析。
2 结果与分析
2.1 表型观察
通过不同时期的田间观察发现,营养生殖期间dtp1突变体植株整体及抽穗情况与正常植株无明显差异,表1为2019—2020年松香早粳与dtp1突变体相关性状的详细数据,进一步对小花解剖观察发现,dtp1突变体具有发育完全的雌蕊和数目正常的雄蕊。野生型花药长势饱满呈黄色,野生型花药饱满呈现正常的黄色,而突变体的花丝伸长,花药瘦小颜色浅黄(图1)。

注:A:野生型(左)和dtp1突变体(右)的植株;B:野生型的花;C: dtp1突变体的花。比例尺为2 mm。Note: A: Plants with wild-type (left) and dtp1 mutant (right). B: Flowers of wild type plants. C: Flowers of a dtp1 mutant. Bars=2 mm.图1 野生型和dtp1突变体表型比较Fig.1 Comparison of wild type and dtp1 mutant
2.2 花粉育性
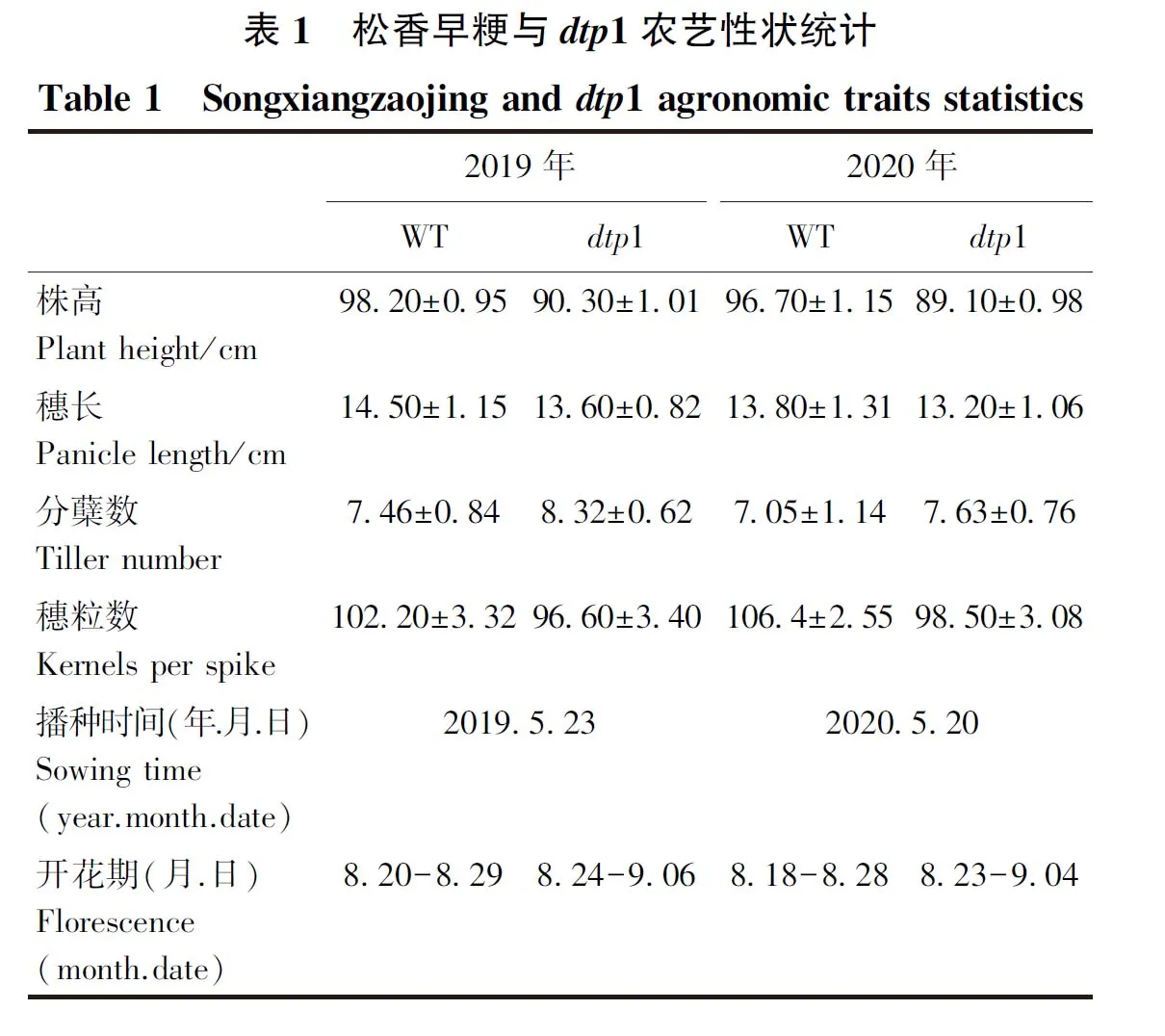
为进一步了解dtp1突变体花药的育性情况,进行碘染试验。取突变体与野生型的成熟花药分别置于载玻片上,1% I2-KI溶液染色后在显微镜下观察,发现野生型花药内大量的饱满圆形正常成熟花粉粒被染成深黑色,而突变体花药中未发现花粉粒(图2),表明dtp1突变体属于无花粉型雄性不育突变体。
图2 野生型(A)和dtp1突变体(B)花药碘染Fig.2 Wild type(A) and dtp1 mutant(B) pollen grains stained by I2-KI
2.3 石蜡切片
通过观察野生型和突变体水稻不同发育时期花药的石蜡切片,进一步了解dtp1突变体不育性产生的细胞学差异。水稻花药的发育时期参照冯九焕等[22]划分的8个时期,通过观察分析发现,突变体花药发育过程中小孢子母细胞能正常进入减数分裂时期(图3-A、G),绒毡层细胞开始发育,胞质浓缩,花粉母细胞进行减数分裂(图3-B、C、H、I);进入小孢子时期,野生型释放出近圆球形的小孢子,绒毡层浓缩且染色加深,但dtp1突变体花药绒毡层染色浅,开始降解,小孢子形状不规则(图3-D、J);在花药发育的液泡化时期,野生型花药中小孢子已形成大液泡,体积增大,绒毡层继续退化,此时dtp1突变体的绒毡层膨大凸起,小孢子发育异常(图3-E、K);在成熟时期,野生型中的花粉颗粒已经形成,绒毡层完全降解,但dtp1突变体中小孢子细胞降解仅剩空腔(图3-F、L)。
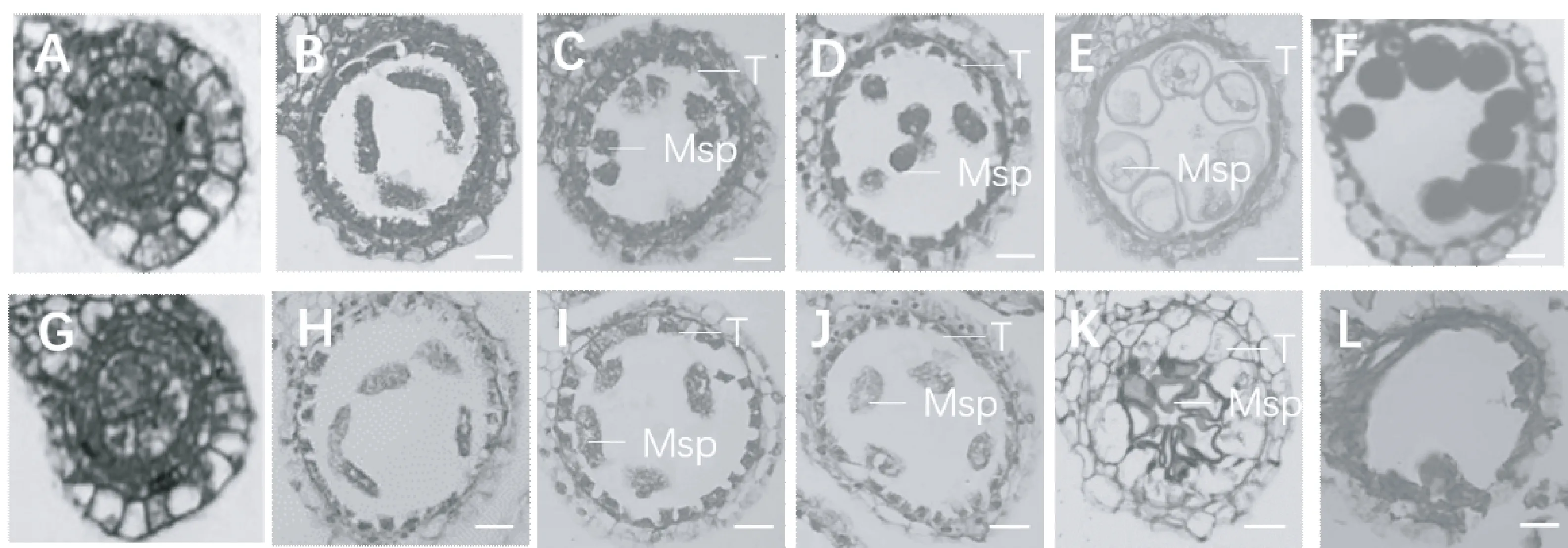
注:A~F:野生型花药石蜡切片;G~L:dtp1突变体花药石蜡切片;A和B:小孢子母细胞时期;B、C和H、I:减数分裂时期;D和J:小孢子时期;E和K:液泡化时期;F和L:花粉成熟时期。T:绒毡层;Msp:小孢子;图中比例尺为10 μm。Note: A-F: The paraffin sections of anthers wild type. G-L: The paraffin sections of anthers dtp1 mutant. A and B:Microspore mother cell stage. B,C,H and I: The meiotic period. D and J: Microspore stage. E and K: Vacuolation. F and L: Pollen maturity stage. T: Tapetum. Msp: Microspore. Bars=10 μm.图3 野生型与dtp1突变体花药的石蜡切片Fig.3 Paraffin sections from anthers of wild type and dtp1 mutants
2.4 遗传分析
松香早粳经60Co-γ辐射诱变获得的1个性状稳定的雄性不育突变体dtp1,以dtp1突变体作为母本与松香早粳回交,调查F1群体发现所有种植的F1植株表型性状均与野生型松香早粳一致,但在F1自交获得的F2群体中出现育性性状的分离,表明育性性状受核基因控制,不育性状为隐性性状。在获得的F2群体中,正常植株和突变植株育性性状的分离符合3∶1的分离规律(表2),表明该不育性状为单个核基因控制的隐性突变。

表2 突变体性状的在群体中的分离Table 2 Isolation of mutant traits in populations
2.5 基因定位
为定位控制dtp1突变体无花粉性状的雄性不育基因,以雄性不育突变体dtp1和日本晴杂交的F2群体为定位群体(表2)。用均匀分布在水稻12条染色体上的360对SSR引物对亲本松香早粳和日本晴DNA进行多态性筛选(图4),利用筛选出的152对具有多态性SSR引物对亲本松香早粳和日本晴以及F2单株的DNA进行扩增,染色体连锁分析发现位于水稻第7染色体上的两个SSR标记7-2d和7-3h与目的基因存在连锁关系(图5)。为了在初定位结果上进一步实现目的基因的精细定位,根据重测序结果中亲本松香早粳品种和日本晴品种之间的基因组序列差异性,在初定位结果上进一步利用Primer premier 5.0软件设计了10对新的引物,其中5对引物具有多态性(表3),最终将不育目的基因定位在SYrbC7-2680809和SYrbC7-2832575标记之间(图6),染色体区间的物理距离151.7 kb(图7)。

表3 引物列表Table 3 List of primers
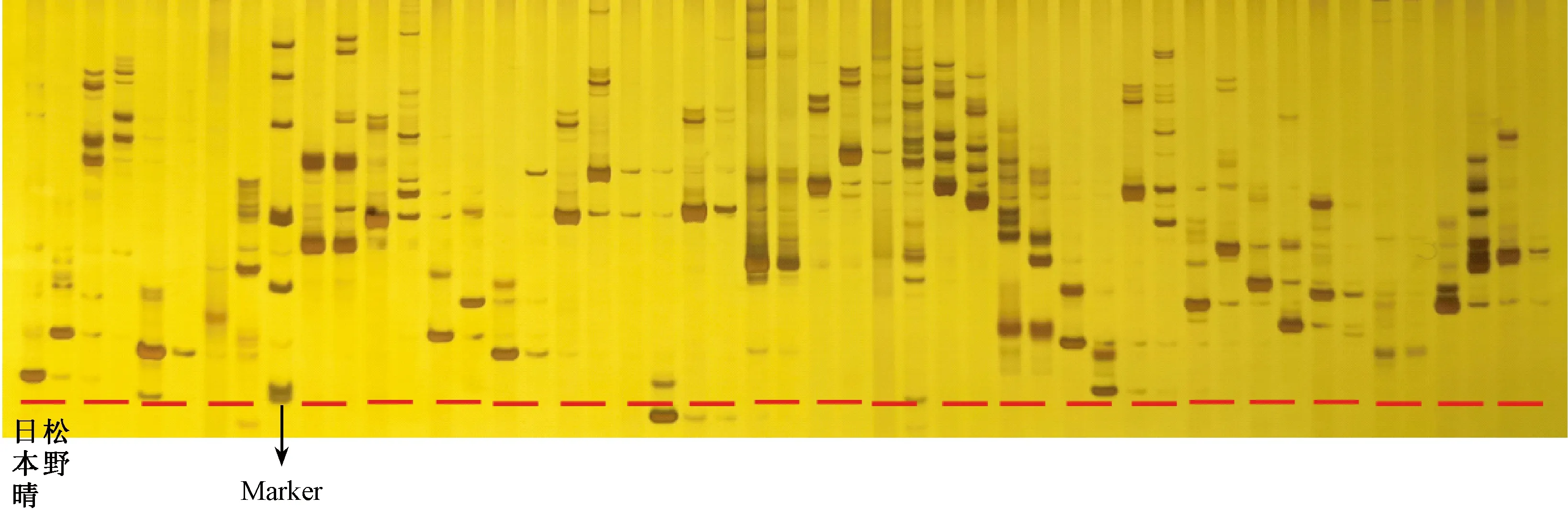
注:自左至右每2个孔道对应一个引物,左为日本晴,右为松香早粳。Note:From left to right, each 2 channels corresponds to a primer, the left is Nipponicum, the right is Songxiangzaojing.图4 亲本多态筛选Fig.4 Seed-parent polymorphic screening
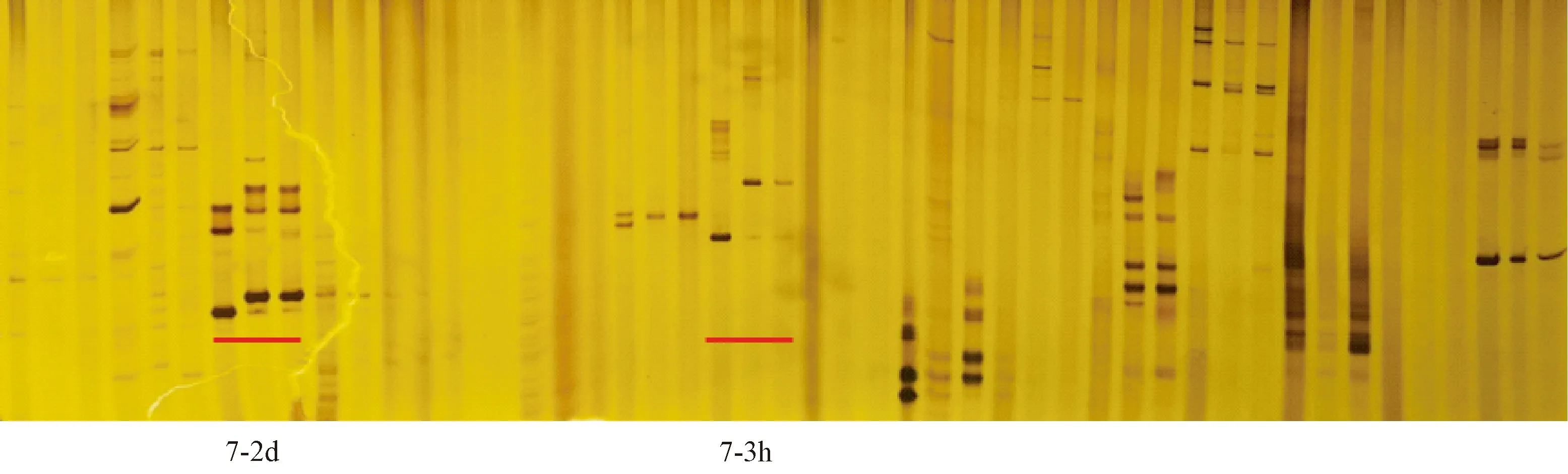
注:每3个孔道对应一个引物,自左至右分别对应为日本晴,松香早粳,F2群体混池。Note:There is a primer for every 3 pores,from left to right,correspond to Nipponicum, Songxiangzaojing and F2 population mixing pool respectively.图5 BSA混池筛选Fig.5 BSA pooling screening

图6 部分单株扩增结果Fig.6 Partial amplified results of single plant
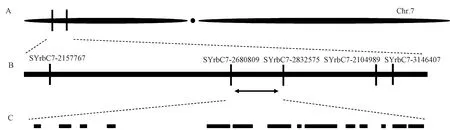
图7 突变基因定位及预测基因预测Fig.7 Mutant gene localization and prediction gene prediction
根据NCBI(https://www.ncbi.nlm.nih.gov/)和国家水稻数据中心(https://www.ricedata.cn/)提供的水稻基因注释信息,共包括14个注释基因(表4),其中LOC_Os07g05720参与活性氧代谢途径、LOC_Os07g05740编码RPK2(receptor-like protein kinase 2)前体、LOC_Os07g05800编码谷胱甘肽S-转移酶(glutathione S-transferase,GST)以及LOC_Os07g05750编码推测的Ty3-gypsy亚类逆转录转座子蛋白,其余10个基因功能未知。

表4 预测基因列表Table 4 Predictive genes list
3 讨论
水稻雄性生殖发生是一个复杂的生物学过程,其中花药是研究雄性不育的良好对象。目前,参与花药发育过程的一系列表达调控基因相继被发现和鉴定[23-24],但仍有大量未知的基因尚未被分离和克隆[25]。雄性不育突变体是研究水稻花药生理功能、代谢途径以及基因调控途径的重要试验材料[1]。
绒毡层作为花药壁最内层细胞,是向花粉母细胞运输物质的枢纽,可分泌胼胝降解酶释放小孢子,为小孢子发育提供营养,合成花粉壁所需的孢粉素以及花粉外壳的沉淀物,上述功能均对花粉母细胞和小孢子的正常发育至关重要。因此,绒毡层PCD的提前或延迟均会导致雄性不育[26-27]。本研究通过形态学分析发现,dtp1突变体花丝伸长,花药瘦小呈浅黄色,碘染实验表明dtp1突变体属于无花粉型雄性不育突变体。遗传分析发现,控制dtp1突变体产生不育的性状由单个核基因控制的隐性突变所引起。切片观察发现,与野生型相比,dtp1突变体花药最异常的表现发生在液泡化时期,绒毡层异常膨大且提前降解,同时小孢子与野生型的圆形相比呈现出不规则的现象,推测小孢子的异常发育可能是受到绒毡层发育的影响,DTP1是一个新的调控减数分裂后绒毡层和小孢子发育的重要基因。目前已报道的控制减数分裂后绒毡层和小孢子发育相关的突变体有dtc1、osago2和edt1等,与dtp1突变体的表型具有相似性。后期可通过转录组分析、代谢组分析以及酵母双杂交等方法来研究DTP1与DTC1、OsAGO2和EDT1等基因之间可能的调控网络。
DTP1基因定位于水稻第7染色体的2个标记SYrbC7-2680809和SYrbC7-2832575之间151.7 kb的物理区间,共包括14个基因,包括LOC_Os07g05720(编码TPC转录因子)和LOC_Os07g05800(编码谷胱甘肽S-转移酶)。相关研究表明,TPC转录因子在茉莉酸(jasmonic acid, JA)信号途径调节中起作用[28-29],而JA可与赤霉素(gibberellic acid, GA)相互作用来调控花药的发育过程。GA通过抑制DELLA蛋白,调节JA生物合成基因来调控雄蕊发育相关的转录因子的活性[30]。已报道的OsGAMYB(gibberellic acid myb)编码1个赤霉素转录因子,gamyb-4植株的花药绒毡层发育异常,花粉败育[31]。
谷胱甘肽S-转移酶作为重要的抗氧化酶参与活性氧(reactive oxygen species, ROS)的稳态调控[32-33]。已有研究表明,ROS的过度积累和花药发育异常会导致绒毡层程序性细胞死亡(programmed cell death, PCD)的提前启动和花粉败育,同时ROS是绒毡层PCD正常发生的重要信号分子[11-13]。OsAGO2通过调节OsHXK1启动子区的DNA甲基化修饰来表观调控花药发育,osago2敲除突变体会导致活性氧的过度积累和花药发育异常,绒毡层程序性细胞死亡的提前启动和花粉败育。过表达OsHXK1也导致ROS的过度积累,从而过早启动PCD和花粉败育。DTC1是绒毡层PCD的关键调控因子,可抑制金属硫蛋白MT2b的ROS清除活性。野生型植物在花药发育的小孢子时期积累了大量的ROS,而在dtc1突变体花药发育的各个阶段,其ROS含量一直维持在较低的水平。鉴于此,推测LOC_Os07g05720和LOC_Os07g05800为可能的候选基因。
为了进一步明确DTP1在水稻花药发育中的功能和分子机制。设计后期第一步研究确定dtp1突变体中候选基因的变异位点,以及突变位点对基因功能影响,然后在克隆DTP1基因的基础上,通过透射电镜(transmission electron microscope, TEM)、扫描电镜(scanning electron microscope, SEM)及TUNEL(TdT-mediated dUTP Nick-End labeling)来分析绒毡层及花药壁的发育情况,同时通过原位杂交、亚细胞定位、转录本及代谢本的研究来分析分子机理,以期为随后的遗传改良提供新的基因资源和理论依据。
4 结论
本研究通过60Co-γ射线处理松香早梗种子获得1个雄性不育突变体dtp1。与野生型相比,dtp1突变体花丝伸长,花药瘦小呈浅黄色;碘染试验表明dtp1突变体属于无花粉型雄性不育突变体。遗传分析发现,dtp1突变体是单个核基因控制的隐性突变体。石蜡切片结果发现dtp1突变体在液泡化时期,绒毡层异常膨大且提前降解,同时小孢子呈现出不规则的现象。DTP1是一个新的调控减数分裂后绒毡层和小孢子发育的重要基因,通过图位克隆的方法已将其定位于第7号染色体SYrbC7-2680809和SYrbC7-2832575标记间151.7 kb的物理区间内,共包括14个基因,其中LOC_Os07g05720(编码TPC转录因子)和LOC_Os07g05800(编码谷胱甘肽S-转移酶)为可能的候选基因。

