[苄基-14C]-毒氟磷在大豆中的残留分布和代谢产物动态变化
闻樊婷 郑若楠 邵思遥 骆沛文 张素芬 余志扬 程 曦 叶庆富
(浙江大学原子核农业科学研究所/农业农村部和浙江省核农学重点实验室,浙江 杭州 310058)
植物病毒是一类在寄主活体细胞内进行核酸和蛋白质外壳复制的病原物,素有“植物癌症”之称。植物病毒病会降低粮食作物的产量和品质,严重危害我国乃至世界的粮食安全,造成极大的经济损失[1-3]。毒氟磷(Dufulin,N-[2-(4-甲基苯并噻唑基)]-2-氨基-2-氟代苯基-O,O-二乙基膦酸酯)是我国自主创制的新型植物抗病毒剂,具有高效、低毒和低残留等特点[4],在烟草[5]、黄瓜[6]、番茄[7]以及南方水稻[8]等作物的病害防治中应用广泛,市场前景良好。
近年来,关于毒氟磷母体环境行为的研究已有较多报道[9-10],樊玲娥[11]优化了提取净化毒氟磷残留的方法并对其水化学降解进行了研究,发现自然水体中毒氟磷的水解半衰期为12.58~21.19 d。Wang等[12]采用高效液相色谱法研究了毒氟磷母体在土壤中的生物和非生物降解,发现水分和温度的升高能加速毒氟磷母体在土壤中的降解,土壤中的微生物和酶能加快毒氟磷母体的降解,毒氟磷在Eutric Gleysols中降解最快,半衰期为17.59 d。前人采用超高液相色谱法分别研究了毒氟磷母体在水稻[13]、番茄[14]和西瓜[15]中的残留消解规律,由半衰期看出毒氟磷母体在作物-土壤体系中降解较快。上述研究均表明毒氟磷在环境中容易发生降解,且以母体及其代谢产物的形式存在。然而目前国内外对毒氟磷在植物体内代谢的相关研究尚为鲜见。且有研究表明,农药在降解过程中生成的代谢产物的毒性可能高于母体,如刘莉[16]发现低毒高效的有机磷杀虫剂乙酰甲胺磷在蔬菜中易代谢为甲胺磷,其毒性比母体高30多倍。因此,研究毒氟磷在植物中的代谢规律对其安全性评价及残留定义具有重要的现实意义。
本试验选择油料类作物大豆(Glycinemax)作为试验对象,以[苄基-14C]-毒氟磷为示踪剂,借助放射性追踪溯源和精准痕量的特征,有针对性地取舍放射性目标代谢产物和非放射性杂质,消除复杂体系带来的不良影响,快速确定农药的代谢组分[17]。通过模拟田间喷雾施药的方式研究14C-毒氟磷在大豆中的残留分布特征和代谢动态规律,以期为客观评价毒氟磷的安全性提供数据支持,并为毒氟磷的科学合理使用提供技术指导。
1 材料与方法
1.1 试验材料
1.1.1 供试标记化合物 [苄基-14C]-毒氟磷:浙江大学与上海启甄环境科技有限公司合作制备,方法参考[18-19],放射化学纯度大于97%,化学纯度大于98%,比活度为1.804×106Bq·mg-1(19.919 mCi·mmol-1),结构式如图1所示。

注:“*”表示14C 标记位置。Note: ‘*’ represents the position of 14C labeling.图1 [苄基-14C]-毒氟磷结构式Fig.1 Structure of [benzyl-14C]-Dufulin
1.1.2 供试大豆 供试大豆品种为天隆一号,由浙江大学农业与生物技术学院唐桂香教授课题组提供。试验栽培用土取自浙江省杭州市浙江大学紫金港校区农业试验田内,泥炭购自德国维特集团公司,土壤和泥炭混合比为1∶1。
1.2 试验设计
1.2.1 毒氟磷混合液的配制 按照毒氟磷田间推荐使用剂量300~500 g a.i.·hm-2,浓度为0.3 g·kg-1,并结合引入放射性活度需求,本试验的施药浓度为推荐施药浓度的三分之二,即200.0 mg a.i.·L-1。准确量取245 mL超纯水、2.5 mL乙二醇乙醚、2.5 mL吐温80加入试剂瓶中,超声混合5 min,得到1%的溶媒水溶液。称取20.0±0.1 mg[苄基-14C]-毒氟磷、46.7±0.1 mg由硅藻土、木质素磺酸钠和LS洗净剂组成的空白粉剂(m∶m∶m=12∶1∶1),用5 mL甲醇溶解,再用1%溶媒水溶液定容至100 mL,配成浓度为200.0 mg·L-1的毒氟磷混合溶液。
1.2.2 大豆的栽培与药液喷施 将发芽的大豆种子播于装有4.5 kg土壤的塑料盆中(直径30 cm×高35 cm),每盆播种5~6粒,共36盆。试验模拟田间条件培养,在开花期施药,用2 mL-K专用连续喷雾注射器(江西正略公司)均匀喷洒毒氟磷混合液,每盆植株约2.7 mL。待液滴自然风干后进行首次采样(施药后2 h),随后于第2、第5、第10、第15和第20天各采样一次,每个采样点设置6个重复。将大豆植株分为根、茎、叶、豆荚和豆子五部分,其中根部用去离子水洗净。上述样品分别用液氮冷冻粉碎,置于-18℃保存备用。
1.3 测定项目与方法
1.3.1 放射性残留量测定 称取叶、茎和豆荚各200 mg,根和豆子各300 mg置于燃烧舟中,待HTC-501生物氧化燃烧仪(太仓华利达公司)燃烧室温度达到900℃,催化室温度达到680℃时,燃烧4 min,用10 mL闪烁液B收集放射性物质氧化燃烧后产生的14C-CO2,采用Tricarb-4910TR型液体闪烁计数器(美国PerkinElmer公司)测量其放射性活度并计算毒氟磷残留在各部位中的含量,每组样品设置3个平行,残留浓度以毒氟磷母体计,计算公式为:
(1)
式中,C为14C-毒氟磷残留浓度,mg·kg-1;Ai为鲜样中的放射性活度,Bq;η为燃烧回收率;a为标记毒氟磷的放射性比活度,Bq·mg-1;m为样品质量,kg。
1.3.2 毒氟磷母体及其代谢产物的提取纯化 分别取各采样点豆叶样品约1.00±0.01 g于100 mL离心管中,依次采用30 mL乙腈和30 mL乙腈-水混合液(v:v=2∶1)进行提取,提取方法为:首先进行1 min涡旋震荡,而后进行超声提取20 min和摇床震荡30 min;提取后样品于-4℃、10 000 r·min-1条件下离心20 min,收集上清液。上述提取步骤分别重复2次。上清液经PES-0.45 μm针筒式滤膜过滤后,于35℃旋转蒸发至全干,用5 mL甲醇溶液复溶。浓缩提取液用ProElut Carb/PSA小柱(500 mg/6 mL,Dikma)萃取除杂,流出液经氮吹定容至1 mL,转至样品瓶中供液相色谱分析。
取25.00±0.01 g喷药后第20天的豆子样品于100 mL离心管中;浓缩提取液用ProElut Carb小柱(500 mg/6 mL,Dikma)萃取除杂,其余处理步骤同豆叶。

注:M1:N-[2-(4-羟基甲基苯并噻唑基)]-2-氨基-2-氟代苯基-O,O-二乙基甲基磷酸酯;M2:N-[2-(4-甲基-6-羟基苯并噻唑基)]-2-氨基-2-氟代苯基-O,O-二乙基甲基磷酸酯;M3:N-[2-(4-甲基-6-葡萄糖基苯并噻唑基)]-2-氨基-2-氟代苯基-O,O-二乙基甲基磷酸酯;M4:N-[2-(4-甲基-6-葡萄糖丙二酸酯基苯并噻唑基)]-2-氨基-2-氟代苯基-O,O-二乙基甲基磷酸酯。Note: M1: [(2-Fluoro-phenyl)-(4-methanol-benzothiazol-2-ylamino)-methyl]-phosphonic acid diethyl ester.M2: [(2-Fluoro-phenyl)-(4-methyl-6-hydroxy-benzothiazol-2-ylamino)-methyl]-phosphonic acid diethyl ester.M3: [(2-Fluoro-phenyl)-(4-methyl-6-glucosyl-benzothiazol-2-ylamino)-methyl]-phosphonic acid diethyl ester.M4: [(2-Fluoro-phenyl)-(4-methyl-6-malonylglucoside-benzothiazol-2-ylamino)-methyl]-phosphonic acid diethyl ester.图2 毒氟磷各代谢产物结构式Fig.2 Structure of Dufulin metabolites
1.3.3 豆叶及豆子中毒氟磷母体及其代谢产物的定量分析 将纯化后的豆叶和豆子样品,利用Alliance 2695E高效液相色谱(美国WATERS公司)和Tricarb-4910TR型液体闪烁计数器(美国PerkinElmer公司)联用进行分离和放射性定量。进样体积10 μL,柱温30℃,二极管阵列检测器检测。用流动相A(水+0.1%甲酸,色谱纯)和流动相B(乙腈+0.1%甲酸,色谱纯)以0.8 mL·min-1的流速洗脱,洗脱梯度时间分别为0、8、12、20、23和37 min时,流动相B体积分数分别为10%、30%、35%、35%、55%和100%。分别收集具放射性的洗脱液,保留时间为33.5~34.5 min(毒氟磷母体)、18.3~19.8 min(M3)、20.8~22.0 min(M4)、27.2~27.6 min(M1)和28.1~28.9 min(M2),每个收集瓶中加入10 mL闪烁液A,用液体闪烁计数器测量其放射性活度。根据比活度、分子量、样品的放射性活度和质量,计算毒氟磷母体及其各代谢产物的残留浓度。
1.4 数据分析
采用SPSS 20.0、Origin 9.0对试验数据进行统计处理与分析,采用单因素方差分析(One-way ANOVA)检验差异的显著性(P<0.05)。数据均以平均值±标准差表示。
根据公式计算毒氟磷母体在豆叶中的半衰期[20]:
Ct=C0×e-kt
(2)
DT50=ln2/k
(3)
式中,Ct为t时刻毒氟磷母体的残留浓度,mg·kg-1; C0为毒氟磷母体在首次取样的残留浓度,mg·kg-1;k为降解速率常数,t为施药后时间,d;DT50为毒氟磷母体在豆叶中的半衰期,d。
2 结果与分析
2.1 [苄基-14C]-毒氟磷在大豆不可食部位中的残留分布规律
大豆叶、茎、根、豆荚中的14C-毒氟磷残留分布及动态变化如图3所示。施药初期到收获期,叶中放射性残留量占整株总放射性比值为84.647%~89.889%,茎中为6.366%~9.702%,豆荚中为1.675%~5.546%,根中为0.081%~0.291%。这表明14C-毒氟磷主要残留在叶片上,转入其他部位的量较少;施药后整个试验过程,残留分配比均呈现叶>茎>豆荚>根的规律。

图3 [苄基-14C]-毒氟磷在大豆叶、茎、豆荚、根中的的残留分布Fig.3 The residual distribution of [benzly-14C]-Dufulin in leaves, stems, shells and roots of soybeans
大豆各部位中[苄基-14C]-毒氟磷(母体及其代谢产物)总残留浓度随时间变化如表1所示,在大豆植株各部位中14C-毒氟磷的总残留浓度均呈现为:叶>茎>豆荚>根。与施药初期相比,收获期叶和茎中残留浓度均显著下降,而根中的残留浓度则显著上升,豆荚的残留浓度无显著变化。

表1 不同取样时间点下大豆各部位中[苄基-14C]-毒氟磷的残留浓度Table 1 The residual concentration of [benzyl-14C]-Dufulin in soybeans’ parts at different time points /(mg·kg-1)
2.2 大豆叶中[苄基-14C]-毒氟磷主要代谢产物的动态变化
大豆叶中[苄基-14C]-毒氟磷母体及其代谢产物占可提取残留比例及残留浓度的动态变化规律如图4和表2所示。结果表明,随着施药后培养时间的推移母体占可提取残留比例及其残留浓度均逐渐降低,而(M1+M2)、M3、M4占可提取残留比例及对应的残留浓度则呈递增趋势。

表2 不同取样时间点下大豆叶中毒氟磷母体及其代谢产物的残留浓度Table 2 The residual concentration of Dufulin parent and metabolites in leaves at different time points /(mg·kg-1)
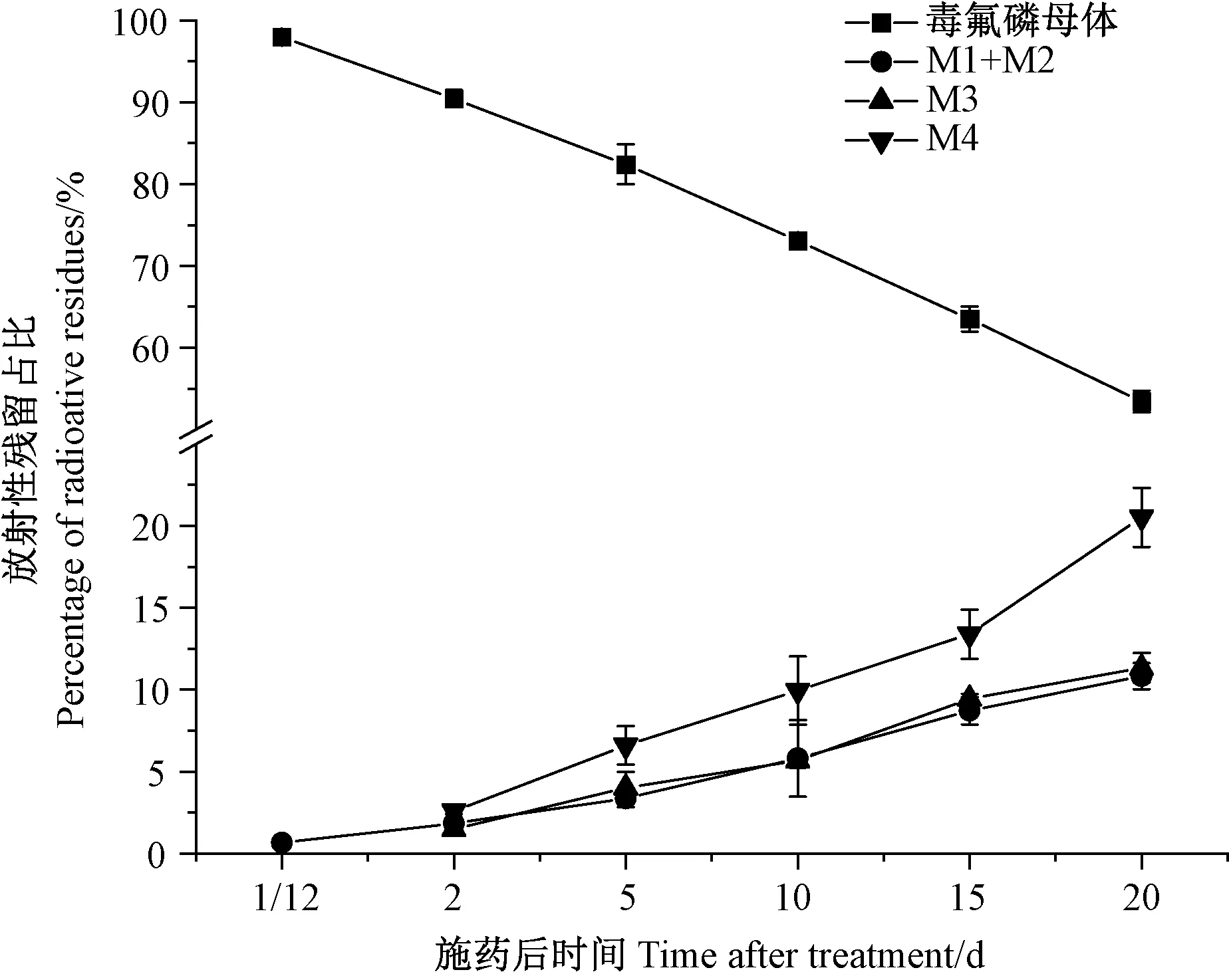
图4 大豆叶中毒氟磷母体及其四种代谢产物相对含量动态变化Fig.4 The dynamics of Dufulin parent and metabolites in leaves of soybeans
在施药初期,叶中放射性残留物组成为毒氟磷母体、M1和M2,其中母体相对含量占可提取残留比例为97.990%,残留浓度为21.675 mg·kg-1;(M1+M2)相对含量之和占可提取残留比例仅为0.648%,残留浓度为0.149 mg·kg-1。收获时,叶中放射性残留物组成发生变化,新增了M3和M4这2个产物。其中M4占比为20.526%,残留浓度为3.838 mg·kg-1;M3占比为11.333%,残留浓度为2.431 mg·kg-1;(M1+M2)占比为10.822%,残留浓度为1.464 mg·kg-1;此时母体占比下降至53.443%,残留浓度仅为6.960 mg·kg-1。总体上看,施药后整个培养时期,叶中残留物含量以母体最高,M4次之,M3和(M1+M2)相近且二者间无显著差异(P>0.05)。收获期时,叶中残留物浓度呈现为:母体>M4>M3>(M1+M2)。
2.3 [苄基-14C]-毒氟磷母体及其代谢产物在可食豆子中的残留
豆子中的[苄基-14C]-毒氟磷残留物含量占比及残留浓度动态变化如表3所示,在施药后初期豆子中的毒氟磷残留物含量仅占0.003%,随着时间的推移,豆子中14C-毒氟磷残留物含量占比逐渐增加,至收获时达到最大值,占比为0.211%,此时残留浓度(按母体折算)为0.059 mg·kg-1。

表3 豆子中14C残留占植株总放射性残留含量占比及残留浓度变化Table 3 The content proportion and residual concentration of [benzyl-14C]-Dufulin in soybean beans
收获期时豆子中[苄基-14C]-毒氟磷母体及其代谢产物占可提取残留比例及残留浓度见表4。结果表明,收获时,豆中放射性残留物组成主要为毒氟磷母体、M1、M2、M3和M4。其中母体含量最高,占比51.932%,残留浓度为0.021 6 mg·kg-1;而M4占比为20.301%,残留浓度为0.013 9 mg·kg-1;M3占比为15.979%,残留浓度为0.009 5 mg·kg-1;(M1+M2)占比为11.788%,残留浓度为0.005 1 mg·kg-1。

3 讨论
3.1 [苄基-14C]-毒氟磷母体在豆叶中的降解与转化
本试验结果表明,毒氟磷母体在豆叶的降解过程符合一级动力学反应指数方程,根据不同时间点毒氟磷母体在豆叶中的残留浓度得出动力学方程为Ct=16.578e-0.045t(R2为0.932 0),半衰期为15.32 d。Zhang等[13]和Zhu等[14]研究表明,毒氟磷在不同地点、不同年份半衰期不一致,在水稻中降解半衰期范围为7.7~11.3 d,在番茄降解半衰期范围为2.8~9.0 d。本试验得到毒氟磷在大豆中的半衰期比这些作物的半衰期长,可能是由作物种类、栽培条件、气候因素(温度及湿度、降水量)等复杂因素不同导致。本试验采用模拟田间试验的方式并结合放射性同位素示踪技术,灵敏度高、检测结果直观准确,更具说服力和可信性。
在豆叶中,除毒氟磷母体外还有4种代谢产物,根据图2代谢产物的结构信息和表2代谢产物的残留浓度,初步推断毒氟磷在豆叶中有2条代谢途径(图5)。其中代谢产物M1、M2的形成归结为毒氟磷的Ⅰ相代谢,主要发生了氧化反应,毒氟磷母体噻唑基苯环甲基上的C-H键和噻唑苯环甲基间位C-H键可能分别在细胞色素P450s酶系作用下氧化形成羟基[21]。Ⅰ相代谢改变农药母体结构,增加其极性,一般形成毒性更低的化合物;但某些特殊情况则可能形成毒性高于母体的物质。如除草剂甲草胺通过P450s酶系催化的羟基化反应以及其他酶系作用下形成的主要代谢产物二烷基醌亚胺,具有致癌作用[22-24]。因此,M1和M2的毒性可能高于母体,后续需进行毒理学试验确证。代谢产物M3和M4的形成归为毒氟磷的Ⅱ相代谢,主要是经Ⅰ相代谢产物的-OH基团与葡萄糖、丙二酸等内源物质发生轭合反应而形成[25-26]。M2可能先在UDP-O-糖基转移酶(UDP-O-glycosyltransferases,UGTs)催化下与葡萄糖轭合形成产物M3,再通过丙二酰基转移酶(malonyltransferases,MTs)进一步与丙二酸结合形成产物M4;M2也可能在UGTs催化下直接与丙二酸葡萄糖结合形成代谢产物M4。Ⅱ相代谢形成的轭合物水溶性通常比母体更强,毒性更低[27]。因此,一般情况下M3、M4的毒性低于母体。

图5 毒氟磷在豆叶中可能的代谢途径Fig.5 Potential metabolic pathways of Dufulin in soybean leaves
3.2 [苄基-14C]-毒氟磷在豆叶和豆子中的残留定义
目前国内外均未对大豆中毒氟磷的最大残留限量(maximum residue limit,MRL)值作出相关规定。对于未作出最大残留限量规定的农药,欧盟、日本和新西兰等国家一般将最大残留量定为0.01 mg·kg-1。本试验结果表明,收获期时,不可食豆叶中残留物相对含量均大于可提态残留的10%,且毒氟磷母体及其代谢产物M3、M4的残留浓度均大于0.01 mg·kg-1; 在可食豆子中毒氟磷母体及其代谢产物M4的相对含量均大于可提态残留的10%,且二者的残留浓度均大于0.01 mg·kg-1。 因此,毒氟磷在不可食豆叶中的残留主要为母体、M3(N-[2-(4-甲基-6-葡萄糖基苯并噻唑基)]-2-氨基-2-氟代苯基-O,O-二乙基甲基磷酸酯)和M4(N-[2-(4-甲基-6-葡萄糖丙二酸酯基苯并噻唑基)]-2-氨基-2-氟代苯基-O,O-二乙基甲基磷酸酯);在可食豆子中的残留主要为母体和M4。
根据我国《NY/T 3096-2017农作物中农药代谢试验准则》[28]、经济合作与发展组织(Organization for Economic Co-operation and Development,OECD)[29]和美国环保局(U.S. Environmental Protection Agency,EPA)[30]农药代谢试验导则,将相对含量超过10%和残留浓度大于0.05 mg·kg-1的代谢产物纳入毒氟磷在豆叶和豆子中的残留定义。在豆叶中的残留定义为毒氟磷母体、M3和M4;而豆子中母体及其代谢产物残留浓度均小于0.025 mg·kg-1,因此不纳入残留定义。
4 结论
本研究采用模拟田间试验的方式研究[苄基-14C]-毒氟磷在大豆中的残留分布和代谢产物动态变化。在整个试验过程中,毒氟磷在大豆中的转运能力非常有限,大部分毒氟磷残留物集中在叶上,只有整株总放射性的0.502%最终转移到未施药部位根和豆子中。毒氟磷在豆叶和收获期豆子中存在4种相同的代谢产物,通过产物结构和相对含量信息,推断了毒氟磷在豆叶和豆子中可能的代谢途径,得出毒氟磷在可食豆子中的残留主要为母体和M4。

