基于液质联用技术的坛紫菜甘油-3-磷酸胁迫响应分析
唐欣怡 赵佳丽 陈娟娟,* 骆其君 陈海敏 杨 锐 张 鹏
(1 宁波大学,农产品质量安全危害因子与风险防控国家重点实验室, 浙江 宁波 315211;2 浙江省海洋水产养殖研究所, 浙江 温州 325005)
坛紫菜(Pyropiahaitanensis)是中国东南部具有经济价值的大型藻类之一,有很高的食用和药用价值。坛紫菜不仅是一类富含多种维生素和微量元素的海洋蔬菜,还富含可作为化工原料的藻胶等多种生理活性物质[1-3]。坛紫菜生长在环境条件变化多端的潮间带,温度、盐度和光照强度急剧变化,随着潮水的涨落每天经历周期性的干出与浸没交替过程[4]。因此,为了适应复杂多变的环境,坛紫菜进化出一系列的抗逆防御方式。
研究证实甘油-3-磷酸是植物防御信号转导途径中的一个新的调控因子或信号分子[5-6],是糖代谢和卡尔文循环代谢的重要中间物[7-8]。夏菲[9]发现甘油-3-磷酸参与了拟南芥非生物胁迫响应,通过自身主动调节甘油-3-磷酸合成水平,经一系列酶作用转化成甘油-3-磷酸,增强拟南芥对盐及干旱的耐受性。此外,Qian等[10]发现坛紫菜在干出胁迫后,藻体内红藻糖苷含量显著升高,以保护细胞免受脱水损伤的影响,同时其前体物质甘油-3-磷酸合成相关的甘油激酶(NHO1)和3-磷酸甘油脱氢酶(GPDH)基因表达上调,表明甘油-3-磷酸可能参与了防御反应。这一现象在坛紫菜经鞭毛蛋白肽flg22和35℃高温刺激试验中得到了证实,即甘油-3-磷酸的含量在胁迫中显著升高,参与了防御响应。由此可知,甘油-3-磷酸作为红藻糖苷的合成前体,在处于复杂环境的坛紫菜抗逆机制中发挥着重要作用[11-13]。
目前甘油-3-磷酸的下游物质红藻糖苷的抗逆作用已有较多研究[14-15],而甘油-3-磷酸的合成积累与红藻糖苷的含量变化密切相关。因此推测,其他不同胁迫条件可能均会引起甘油-3-磷酸的响应,且甘油-3-磷酸在不同逆境下的不同响应或许是红藻糖苷差异性响应的原因之一。然而,针对温度、盐度以及干出胁迫下,叶状体内甘油-3-磷酸含量变化以及和红藻糖苷异构体的含量变化关系还未被探讨。基于此,本研究利用高效液相色谱-质谱联用(ultra performance liquid chromatography coupled with mass spectrometry,UPLC-MS)技术,建立起甘油-3-磷酸的定量方法,探究温度、盐度和干出胁迫条件下坛紫菜中甘油-3-磷酸的防御响应变化规律,旨在为进一步探究坛紫菜抗逆机制提供基础试验数据。
1 材料与方法
1.1 材料与试剂
甘油-3-磷酸标准品(纯度98%),北京翰隆达科技发展有限公司;甲醇(分析纯),上海国药化工有限公司;甲醇和乙酸铵(色谱纯),美国Sigma-Aldrich公司;0.22 μm孔径有机相针式滤膜,上海安谱实验科技股份有限公司。
1.2 仪器与设备
Xevo TQ-S超高效液相色谱-三重串联四极杆质谱联用分析系统、C18色谱柱(2.1 mm×100 mm,1.7 μm),美国Waters公司;FreeZone冷冻干燥机,美国Labconco公司;Cascada II超纯水系统,美国Pall公司;Precellys 24 Dual均质仪,法国Bertin公司;GXZ-380智能光照培养箱,宁波江南仪器厂;旋转蒸发仪,浙江优纳特科学仪器有限公司。
1.3 坛紫菜胁迫处理
对照组培养条件:将叶状体置于盐度25‰、温度20℃、光照强度20 μmol·m-2·s-1、光暗比L∶D =12 h∶12 h的环境中培养24 h。温度胁迫组培养条件:将100 mg湿重的叶状体放置于盐度为25‰的灭菌海水(自然海水煮沸)中,分别放入温度为12、18、23、25、28℃,光照强度为20 μmol·m-2·s-1的培养箱中培养1 h,其中28℃条件下分别培养1、6、12、24、36、48、60和72 h。盐度胁迫组培养条件:将100 mg湿重的叶状体分别放置于盐度为15‰、20‰、30‰、35‰、40‰、45‰、50‰、60‰、70‰、80‰的灭菌海水(使用海水晶NaCl调节盐度)中,放入温度为20℃、光照强度为20 μmol·m-2·s-1的培养箱中分别培养0.5、1和3 h。干出胁迫组培养条件:用滤纸轻轻吸干100 mg湿重叶状体的表面水分,将其平铺于灭菌培养皿中,放入温度为20℃、光照强度为20 μmol·m-2·s-1的培养箱中分别培养1、2、3、4、5、6、8、10和12 h。恢复组培养条件:待温度、盐度及干出胁迫后,将坛紫菜置于盐度为25‰的灭菌海水中,放入温度为20℃、光照强度为20 μmol·m-2·s-1的培养箱内分别恢复1和3 h。
1.4 甘油-3-磷酸的提取
准确称取湿重100 mg的坛紫菜叶状体,置于2 mL匀浆管中,然后加入1 mL 80%甲醇与直径为0.5 mm和3 mm的破碎珠,于均质仪中提取(5 000 r·min-1, 30 s×3,10个循环)。在完全破碎后进行离心(5 000 r·min-1, 10 min),取上清液,利用旋转蒸发仪去除溶剂,得到甘油-3-磷酸提取物。
1.5 UPLC-MS条件
采用C18柱(2.1 mm×100 mm,1.7 μm)作为固定相;以甲醇作为有机相(A),纯水作为水相(B),洗脱梯度为:0~2 min,10%~30%A;2~4 min,30%~50%A;4~6 min,50%~70%A;6~8 min,70%~90%A;8~10 min,90%A。流速0.4 mL·min-1,进样量10 μL,柱温30℃。
采用电喷雾离子电源的负离子电离模式,毛细管电压3 kV,锥孔电压6V,脱溶剂气温度为450℃,脱溶剂气流量为600 L·h-1,锥孔气流量为50 L·h-1,碰撞气采用氩气(Ar),碰撞气流量0.15 mL·min-1。扫描采用多反应监测(multiple reaction monitoring,MRM)模式。甘油-3-磷酸离子通道和碰撞能量分别为m/z 171→m/z 96 (16 eV) 和m/z 171→m/z 78 (12 eV)。
1.6 数据分析
所有的液质数据处理、获取和分析均由Masslynx (Waters,美国)软件处理。差异性分析中,数据以平均值±标准差(mean ± SD,n=3)表示。利用SPSS11.5软件进行单因素方差分析,组与组之间差异P<0.05时定义为差异显著,P<0.01时定义为差异极显著。
2 结果与分析
2.1 甘油-3-磷酸的定量方法建立
准确称取2 mg甘油-3-磷酸标准品溶解于2 mL 50%(v/v)甲醇,过0.22 μm滤膜后,得到浓度为1 mg·mL-1的甘油-3-磷酸母液。将母液稀释至1 μg·mL-1, 采用直接进样的方式将其注入电喷雾离子源(ESI)中,分别在正、负离子电离模式下进行一级全扫描,选择离子响应最强的负离子检测模式进行后续试验。以该离子峰为母离子,施加碰撞能量进行二级质谱扫描,得到碎片离子信息,然后优化碰撞能量,当定性离子和定量离子的离子峰强度达到最大值时即为最佳碰撞能量。此外,改变色谱柱、流动相种类和梯度比例等液相色谱条件,比较分离度、保留时间和峰形确定最终色谱条件。甘油-3-磷酸的总离子流图如图1所示。

图1 甘油-3-磷酸的总离子流图Fig.1 The total ionization chromatograms of glycerol-3-phosphate
2.2 方法评估
2.2.1 线性曲线 将浓度为1 mg·mL-1的甘油-3-磷酸标准溶液分别稀释至浓度0.05、0.1、0.2、0.5、1、2 μg·mL-1, 平行进样3次,记录峰面积与浓度,绘制标准曲线,如图2所示。结果显示,甘油-3-磷酸的标准曲线为y=1 674.7x+11 992,R2=0.998 5,如表1所示。
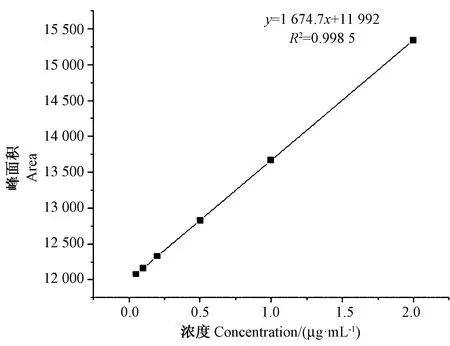
图2 甘油-3-磷酸的标准曲线图Fig.2 The standard curve of glycerol-3-phosphate
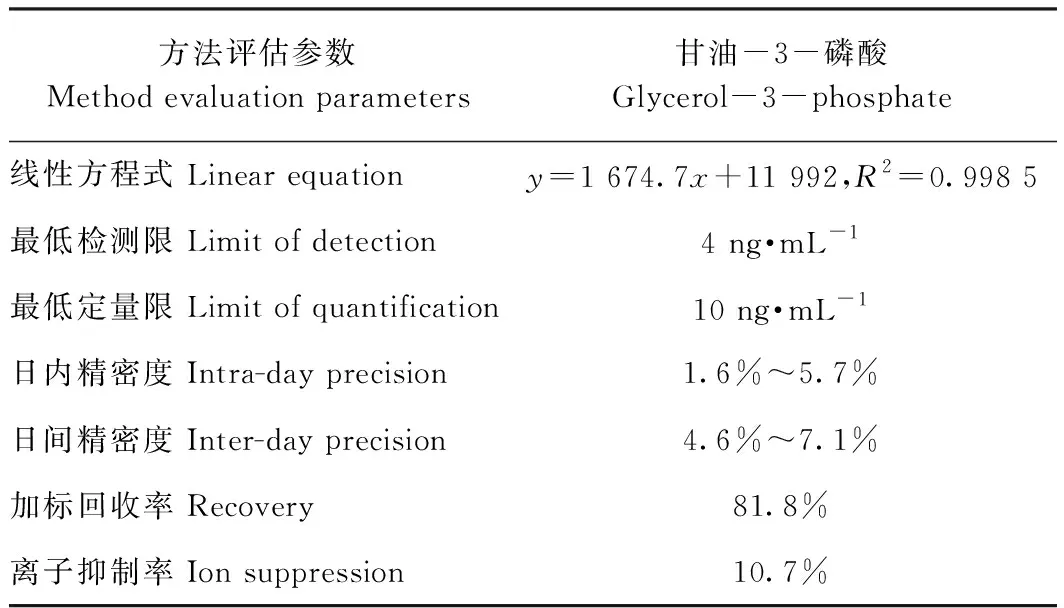
表1 甘油-3-磷酸的日内精密度和日间精密度Table 1 The day precision and inter-day precision of glycerol-3-phosphate
2.2.2 最低检测限和最低定量限 将浓度为1 mg·mL-1的母液不断稀释后进样。当色谱峰峰高与基线高之比即信噪比(S/N)为3和9时,对应的浓度为最低检出限和定量限。结果显示,当S/N=3时,最低检测限为4 ng·mL-1;当S/N=9时,最低定量限为10 ng·mL-1, 表明本方法灵敏度较高。
2.2.3 稳定性 为了验证仪器的稳定性,采用日间精密度和日内精密度进行稳定性检测。结果显示,高、中、低浓度的甘油-3-磷酸标准溶液(0.04、0.2和2 μg·mL-1)的日内精密度相对标准偏差值在1.6%~5.7%范围内,日间精密度在4.6%~7.1%范围内,表明本方法精密度良好。
2.2.4 回收率 为了验证试验过程的准确度,进行了加标回收率的计算。准确称取100 mg新鲜坛紫菜,加入1 mg甘油-3-磷酸标准品作为加标样品,以不添加标准溶液的100 mg坛紫菜为空白样品,各设3个平行。然后根据试验步骤1.4的提取方法进行甘油-3-磷酸的提取,将最终提取物溶解于1 mL 50%(v/v)甲醇,过滤膜后注入样品瓶,上机检测含量并计算回收率。回收率计算公式如下所示: 加标回收率=(加标样品测定值-空白样品测定值)/加标量×100%。结果显示,坛紫菜中甘油-3-磷酸的加标回收率为81.8%。
2.2.5 离子抑制率 为了考察复杂基质对甘油-3-磷酸在质谱中的离子化能力的影响,进行了离子抑制率的计算。准确称取100 mg新鲜坛紫菜,根据1.4的方法提取甘油-3-磷酸后,溶解于1 mL 50%(v/v)甲醇。取800 μL复溶液,将其分为等体积的2份,在其中1份中加入1 mg甘油-3-磷酸作为加标样品,以不添加标准品的复溶液为空白样品。过滤膜后注入样品瓶,上机检测甘油-3-磷酸含量并计算离子抑制率。离子抑制率的计算公式如下所示:离子抑制率=[1- (加标样品测定值-空白样品测定值)/0.04]×100%。结果显示,坛紫菜中甘油-3-磷酸离子抑制率为10.7%,说明基质对甘油-3-磷酸的离子抑制影响可以忽略。
综上所述,该提取和检测方法较全面地满足了坛紫菜样品中甘油-3-磷酸含量的测定要求。
2.3 胁迫条件对坛紫菜中甘油-3-磷酸含量影响
坛紫菜叶状体经12、18、23、25和28℃ 5个不同温度胁迫1 h后,其甘油-3-磷酸含量的变化趋势如图3所示。相比于最佳培养温度20℃,18℃培养下叶状体内甘油-3-磷酸含量无明显变化,但是在培养温度降至12℃时,甘油-3-磷酸含量显著下降,为对照组的0.67倍(P<0.05)。在23、25和28℃温度下培养,其含量分别为对照组的1.17倍、1.63倍和1.90倍(P<0.05)。随着胁迫温度从12℃增加至28℃,甘油-3-磷酸的含量持续增加。在不同温度胁迫1 h后,将坛紫菜叶状体重新置于20℃的正常培养条件进行恢复培养1 h和3 h。结果显示,12℃刺激后的叶状体在恢复1 h内其甘油-3-磷酸含量下降,为对照组的0.43倍(P<0.05),但在恢复3 h后含量开始回升,但仍低于对照组水平,为对照组的0.68倍(P<0.05)。而高温刺激后的叶状体中甘油-3-磷酸含量在恢复培养过程中不断下降,渐渐趋于对照组水平。
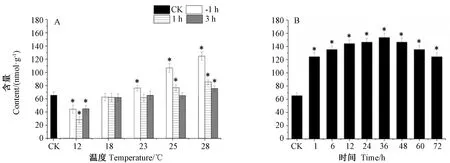
注:A:不同温度胁迫和恢复条件下甘油-3-磷酸含量变化; B:28℃胁迫不同时间条件下甘油-3-磷酸含量变化; CK:对照组; -1 h: 胁迫1 h组;1 h: 胁迫后恢复1 h组;3 h: 胁迫后恢复3 h组;* 表示不同温度和恢复时间下的差异显著(P<0.05)。下同。Note: A: The contents of glycerol-3-phosphate under different temperature stress and recovery process. B: The contents of glycerol-3-phosphate under 28℃ for different time. CK: Control group. -1 h: Stress for 1 h. 1 h: Recovery culture for 1 h after stress. 3 h: Recovery culture for 3 h after stress.* mean significant difference at 0.05 level. The same as following.图3 温度胁迫后的坛紫菜叶状体内甘油-3-磷酸的含量变化Fig.3 The contents of glycerol-3-phosphase in thallus of P. haitanensis under different temperature stress
在28℃胁迫不同时间的试验中发现叶状体内甘油-3-磷酸含量随着胁迫时间的延长先增加后减少,在胁迫36 h时,含量达到最大值,为对照组的2.35倍(P<0.05),继续延长胁迫时间(36~72 h),甘油-3-磷酸含量略有下降,但仍显著高于对照组。
图4为叶状体在盐胁迫下的甘油-3-磷酸含量变化情况。结果表明,当盐度在15‰~80‰范围内,叶状体中甘油-3-磷酸含量均上升。当盐度为15‰时,胁迫3 h, 甘油-3-磷酸含量积累幅度最小,为对照组的1.09倍。当盐度高于30‰,甘油-3-磷酸含量显著升高,且保持高水平的平稳状态;其中在盐度为40‰时,胁迫3 h,甘油-3-磷酸含量达到最大值,为对照组的1.74倍。而后将其置于正常盐度(25‰)下进行恢复培养,结果显示叶状体内甘油-3-磷酸的含量均下降,逐步恢复到近对照组水平。其中,低盐胁迫(15‰和20‰)组的叶状体在恢复培养1 h后的甘油-3-磷酸含量下降至对照组水平,而高盐胁迫组(30~80‰)叶状体在恢复培养3 h后的甘油-3-磷酸含量依然明显高于对照组水平。总体而言,甘油-3-磷酸含量在高低盐胁迫下均上升,且高盐下的积累量大于低盐。此外,与胁迫组相比,恢复1 h组和3 h组的甘油-3-磷酸含量整体呈下降趋势,其中盐度30‰~45‰胁迫组,恢复3 h组的甘油-3-磷酸含量略高于恢复1 h组,但仍低于对应的胁迫组,这可能是组别差异造成的。总之,胁迫盐度越高,叶状体在恢复期的甘油-3-磷酸含量下降得越快,逐渐接近于对照组水平。
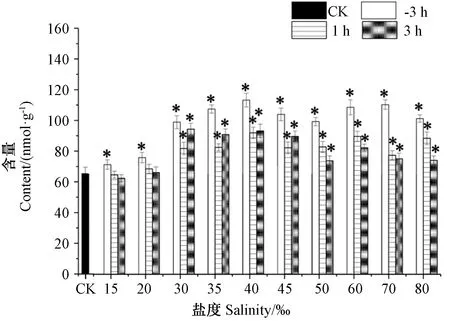
注:CK:对照组; -3 h: 不同盐度胁迫3 h组;1 h: 不同盐度胁迫后进行恢复1 h组;3 h: 不同盐度胁迫后进行3 h组。Note: CK: Control group. -3 h: Different salinity stresses for 3 h. 1 h: Recovery culture for 1 h after salinity stress. 3 h: Recovery culture for 3 h after salinity stress.图4 盐度胁迫后坛紫菜叶状体内甘油-3-磷酸含量Fig.4 The contents of glycerol-3-phosphate in thallus of P. haitanensis under salinity stress
干出胁迫下,叶状体内甘油-3-磷酸的含量变化如图5-A所示,短时间1 h的干出刺激后甘油-3-磷酸含量显著上升,为对照组的1.19倍。随着干出时间继续增加,甘油-3-磷酸含量总体呈现下降趋势,在干出6 h时,甘油-3-磷酸含量为对照组的0.89倍,而后趋于稳定。将干出6 h后的叶状体置于海水中进行恢复培养(图5-B),结果显示,甘油-3-磷酸含量在恢复1 h时显著增加,达到对照组的1.23倍;而在恢复3 h时,其含量基本下降至对照组水平。

注:A: 不同干出胁迫时间下的甘油-3-磷酸含量变化; B: 干出胁迫6 h后恢复培养1 h和3 h后的甘油-3-磷酸含量变化。Note: A: The content changes of glycerol-3-phosphate under different desiccate time. B: The content changes of G3P under recovery culture for 1 and 3 h after 6 h desiccation stress.图5 干出胁迫后坛紫菜叶状体内甘油-3-磷酸的含量Fig.5 The contents of glycerol-3-phosphate in thallus of P. haitanensis under desiccation stress
3 讨论
甘油-3-磷酸已被证实是植物防御信号转导途径中的一个新的调控因子或信号分子,在病原等生物胁迫防御中,甘油-3-磷酸是植物广谱免疫的重要诱导物,是触发免疫应答的关键物质。已有研究在拟南芥和大豆作物中发现甘油-3-磷酸可引发植物系统获得性抗性,且效应与甘油-3-磷酸传输到植物末端组织的时间相关[14-15]。在非生物胁迫防御方面,Adler等[18]、陆信曜等[19]、Konte等[20]陆续进行盐胁迫下的酵母胞内信号转导机制研究,发现可通过高渗透压甘油(high osmolarity glycerol,HOG)途径实现甘油调节酵母菌渗透压的重要作用,促使渗透压稳定。甘油作为甘油-3-磷酸的代谢产物,在体内通过甘油磷酸酶的水解作用而产生。因此,可通过对甘油-3-磷酸的调控来调节甘油水平,以应对外界渗透压的变化[6]。此外,甘油与尿苷二磷酸半乳糖(uridine diphosphate galactose,UDP-Gal)在红藻糖苷合成酶和红藻糖苷磷酸酶的作用下可生成红藻糖苷异构体,作为小分子化合物发挥调节渗透压和抗氧化损伤等作用[21-22]。
坛紫菜处于水温剧烈变化的环境中,20℃为其最适生长温度。而坛紫菜叶状体在18℃条件下其甘油-3-磷酸含量无明显变化,说明18℃仍是坛紫菜的适应温度。陈伟洲等[23]也发现在17℃培养温度下,坛紫菜的生长速率、光合色素及超氧化物岐化酶(superoxide dismutase,SOD)活性均未受到影响,说明叶状体完全能适应18℃条件。高温引起细胞膜破坏和胞质外流,导致细胞内渗透压失衡[24],甚至细胞壁损坏,而红藻糖苷可作为渗透压调节物和细胞壁合成物提高细胞的抗高温胁迫能力[14]。文献报道显示坛紫菜在35℃高温胁迫30 min下红藻糖苷含量略下降,而在恢复过程中逐渐升高至对照组近2倍[15]。Sun等[12]也发现35℃高温胁迫30 min后,红藻糖苷合成酶基因表达显著上调,由此证明高温胁迫下坛紫菜急需大量红藻糖苷参与防御。甘油-3-磷酸是红藻糖苷异构体的合成前体之一,甘油相关合成基因Phnho1和Phgpdh的表达量在35℃高温胁迫下显著升高,与本研究结果中甘油-3-磷酸出现上调现象相一致,即甘油-3-磷酸含量与温度、时间呈正相关,该现象可以解释为,温度胁迫后坛紫菜迅速合成前体物甘油-3-磷酸,以促进红藻糖苷的大量合成。而培养温度低于18℃则无法激活甚至抑制藻体的甘油-3-磷酸合成途径,因此藻体内原有的甘油-3-磷酸迅速被消耗,用于合成异红藻糖苷。
盐度胁迫中也发现红藻糖苷合成酶活性直线升高,水解酶α-半乳糖甘酶活性降低,使得作为相溶性物质的红藻糖苷大量累积,其目的是调节渗透压并保护细胞内大分子和细胞膜[25-27]。Sun等[12]研究发现红藻糖苷合成酶基因PhTPS在1 400 mmol·L-1NaCl胁迫下显著升高2倍以上,同时红藻糖苷异构体含量增加。在低盐12‰和22‰胁迫下,红藻糖苷含量分别降低8倍和2.5倍[28-30]。本试验中也有所发现,甘油-3-磷酸作为红藻糖苷的前体物质,其在坛紫菜体内的含量随着盐度(15‰~80‰)的增加而显著上升,最高达到对照组的1.74倍;且当盐度高于30‰时,甘油-3-磷酸累积量大于在低盐胁迫条件下的累积量。这可能是由于坛紫菜为了发挥在盐度胁迫下的渗透压调节作用,可溶性糖红藻糖苷会出现不同程度的水解;为了满足红藻糖苷的含量需求,坛紫菜需要快速合成其前体物甘油-3-磷酸;而当盐度增高时,坛紫菜为加速调节藻体内部渗透压,叶状体急需大量的红藻糖苷或甘油调节渗透压,从而对前体物甘油-3-磷酸的需求也急剧增加。
Sun等[12]报道显示,坛紫菜经干出1 h胁迫后,藻体中的红藻糖苷合成酶表达量增加30倍以上,且随着干出时间的增加而逐渐降低,但仍为对照组的5~12倍。此外,也有报道发现坛紫菜中红藻糖苷含量在干出2 h后才出现显著上升现象[10]。而本试验中,为了合成红藻糖苷,甘油-3-磷酸含量在1 h内显著上升,这可能是由于甘油-3-磷酸作为信号分子,促进藻体开始激活红藻糖苷异构体的响应通路,但随着干出时间增加,红藻糖苷的需求量开始减少,因此其前体物质甘油-3-磷酸的含量也开始下降,但仍被用于合成为藻体所需的红藻糖苷异构体进行防御。
4 结论
本研究建立起基于超高效液相色谱-质谱联用技术的甘油-3-磷酸定量方法,分析非生物胁迫下坛紫菜中甘油-3-磷酸的响应变化规律。结果显示,甘油-3-磷酸含量与温度和盐度胁迫程度呈正比;不同干出时间胁迫造成坛紫菜中甘油-3-磷酸含量略上升后,整体呈下降趋势。由此可知,作为红藻糖苷的合成前体物,坛紫菜藻体内甘油-3-磷酸水平可快速响应环境胁迫,温度和盐度胁迫导致甘油-3-磷酸的合成,并作为信号分子促进了藻体开始激活红藻糖苷异构体的响应通路,从而促进红藻糖苷的生成,以参与藻类抗逆应答过程。而干出造成甘油-3-磷酸被逐渐消耗合成更多红藻糖苷进行防御。

