西兰花表皮特异硫蛋白基因的克隆与表达分析
蒋 明 苗立祥 朱 晏 吴嘉婧 吴 倩 张慧娟,*
(1 台州学院生命科学学院,浙江 椒江 318000;2 浙江省农业科学研究院园艺研究所,浙江 杭州 310021)
硫代葡萄糖苷(glucosinolate,GLS)又名芥子油苷、硫苷等,主要存在于十字花目(Brassicales)植物中,是一类重要的生物活性物质[1]。硫代葡萄糖苷由β-D-吡喃葡萄糖、磺酸盐醛肟基团和氨基酸R侧链组成,根据R侧链的不同,可将硫代葡萄糖苷分为脂肪族硫苷(aliphatic GLS)、芳香族硫苷(aromatic GLS)和吲哚族硫苷(indolic GLS)三大类,目前已有超过120种硫代葡萄糖苷得以鉴定[1-3]。硫代葡萄糖苷广泛分布于芸薹属(Brassica)蔬菜中,包括西兰花(B.oleraceavar.italica)、花椰菜(B.oleraceavar.botrytis)、甘蓝(B.oleraceavar.capitata)、芥蓝(B.alboglabra)、芥菜(B.juncea)和结球白菜(B.rapassp.pekinensis)等。但不同芸薹属蔬菜中,硫代葡萄糖苷的含量和种类的差异赋予了蔬菜不同的风味[4-5]。
西兰花又名青花菜、绿花菜、木立花椰菜等,是一种富含硫代葡萄糖苷的十字花科(Brassicaceae)植物,其花球和花茎为主要食用部位,味道鲜美、营养丰富、风味独特,已成为一种深受人们喜爱的保健蔬菜[6]。近年来在调查浙江省西兰花产地病虫害发生情况时发现,黑腐病(black rot)的发生十分严重,已成为该蔬菜的重要病害,并有逐年加重的趋势。西兰花黑腐病发病初期叶片边缘出现“V”字型病斑,后期枯黄坏死,影响植株的生长发育和花球产量。黑腐病由野油菜黄单胞菌(Xanthomonascampestrispv.campestris,Xcc)引起,为细菌性病害,每年因该病原菌造成的经济损失巨大[7]。硫代葡萄糖苷的水解产物十分丰富,主要有腈类化合物、环腈类化合物[8]、异硫氰酸酯、硫氰酸酯[9]和恶唑烷硫酮[10]等,这类物质在抗癌、抗菌和抗虫方面起着重要作用。已有研究表明,硫代葡萄糖苷的水解产物对灰霉菌(Botrytiscinerea)[11]、软腐欧氏杆菌(Erwiniacarotovora)[12]、摩西球囊霉(Glomusmosseae)[13]和芸苔链格孢(Alternariabrassicae)[14]等具有一定的抑制效果。在硫代葡萄糖苷水解调控过程中,表皮特异硫蛋白(epithiospecifier,EPS)起着重要作用。EPS是一类小分子量蛋白质,能将异硫氰酸酯催化生成环腈类和腈类物质[15]。目前,EPS在黑腐病抗性反应中的功能鲜见报道。本研究以西兰花为材料,在克隆表皮特异硫蛋白基因BoiEPS的基础上进行序列分析,并明确其在野油菜黄单胞菌侵染下的表达情况,旨在为后续开展西兰花-黑腐病抗性机理研究奠定基础。
1 材料与方法
1.1 试验材料
西兰花材料Bo0202(来自台州学院分子生物学实验室)栽植于人工气候箱中,光周期为16 h光照/8 h黑暗,培养温度28℃。于四叶一心期时采用喷雾法接种野油菜黄单胞菌,菌液浓度为1 × 108CFU·mL-1,采集接种0、24、48、72和96 h时的叶片,用于RNA的提取,同时采集健康叶片用于DNA的提取。
1.2 试验方法
1.2.1 DNA与RNA的提取、cDNA的合成 取约0.5 g 叶片,加适量液氮研磨成粉末,采用DNA快速提取试剂盒(北京鼎国昌盛生物技术有限责任公司)提取DNA,根据说明书进行操作;RNA的提取采用TRIzol法,cDNA合成采用试剂盒法(TaKaRa公司,美国),按说明书进行操作。
1.2.2 基因的克隆 根据NCBI数据库甘蓝型油菜(B.napus)的EPS基因(登录号:NM_001316057.1)设计PCR引物,两条引物的序列分别为BoP1:5′-C C C A A G C T T A T G G C T C C G A G T GT-3′和BoP2:5′-T G C T C T A G A T T A C G C G G A A T T A A C T GC-3′。分别以DNA和cDNA为模板进行PCR扩增,体系20 μL:10×缓冲液2 μL、10 mmol·L-1dNTPs 0.5 μL、20 μmol·L-1上游/下游引物各0.3 μL、模板2 μL、0.8 U的TaqDNA聚合酶0.4 μL,最后加无菌ddH2O至终体积。PCR反应程序:94℃预变性5 min;94℃变性30 s,55.4℃退火45 s,72℃延伸2 min,33个循环;72℃终延伸10 min。
1.2.3 PCR产物的回收、连接、转化 PCR产物经电泳后,利用北京鼎国的DNA凝胶回收试剂盒回收基因片段。pGEM-T easy(Promega,美国)用于连接反应,在10 μL体系中,依次加入5 μL 2 ×缓冲液、1 μL载体DNA、3 μL回收产物和1 μL T4 DNA连接酶。4℃连接过夜后,利用热激法将连接产物转入DH5α大肠杆菌感受态细胞(北京全式金生物技术有限公司)。经涂布培养、单菌落挑取和菌液PCR检测,取3份阳性菌液测序。
1.2.4 基因表达分析 根据测序结果,设计一对实时荧光定量PCR引物,引物名称和序列分别为BoP3:5′-G C C G C G A C G A G A A T A A A A A G TTC-3′ 和BoP4:5′-G C C G C G A C G A G A A T A A A A A GT TC-3′; 以肌动蛋白基因为内标,上游和下游引物分别为BoACT1:5′-T C T C G A T G G A A G A G C T G GT T-3′和BoACT2:5′-G A T C C T T A C C G A G G G A G G TT-3′。反应在罗氏LightCycler 96实时荧光定量PCR仪(Roche,瑞典)上进行,反应体系20 μL:2 × Master Mix 10 μL、上下游引物(20 μmol·L-1)各0.2 μL、模板cDNA 1 μL和ddH2O 8.6 μL。PCR程序:95℃预变性10 min;95℃变性15 s,56℃退火15 s,72℃延伸30 s,共40个循环,3次生物学重复,相对表达量采用2-△△Ct法[16]计算。
1.2.5 序列分析 BoiEPS的同源蛋白序列下载自NCBI,分别来自拟南芥(Arabidopsisthaliana,登录号:AF416786)、甘蓝型油菜(XP_013640463)、芜菁(XP_009147556)、 黄花葶苈(Drabaaurea,AFP47623)、锥果葶苈(D.lanceolata,AFP47624)、菘蓝(Isatistinctoria,AFP47625)和白芥(Sinapisalba,KAF8081838)等。利用在线工具ProtParam预测蛋白质的分子量、等电点、原子组成和总平均亲水性系数;DNAMAN用于蛋白质的翻译;用SMART在线工具预测编码蛋白的结构域;用Mega 3.1构建系统发育树,方法为邻接法,经1 000次自举检测。
1.2.6 遗传转化 利用XbaI和HindⅢ切割pFGC5941空载体及带同样酶切位点的PCR回收产物,利用T4 DNA连接酶连接,经转化、涂布和测序验证,获得过量表达载体pFGC5941-BoiEPS,最后利用本实验室(台州学院分子生物学实验室)构建的方法[17]进行遗传转化。在四叶一心期,利用喷雾法对野生型(wild type, WT)和3个过表达株系接种野油菜黄单胞菌,抗病性的鉴定采用姚星伟等[18]的方法,每个株系6个单株;基因表达分析采用1.2.4中的方法和引物;病原菌的计数采用Poplawsky等[19]的方法,4 d时切取叶盘,每个叶盘直径为5 mm,每个单株切取5个叶盘,共设置3次生物学重复。病程相关蛋白基因BoPR1的表达采用BoPR1UP和BoPR1DN,引物序列分别为5′-A A A G C T A C G C C G A C C G A C T A C G AG-3′和5′-C C A G A A A A G T C G G C G C T A C T C CA-3′,以叶片cDNA为模板,采用1.2.4的PCR反应体系和程序进行表达量检测,相对表达量采用2-△△Ct法计算。
2 结果与分析
2.1 BoiEPS基因的序列分析
分别以DNA和cDNA为模板,利用BoP1/BoP2引物克隆到BoiEPS基因。测序结果表明,BoiEPS基因全长1 270 bp,具有1个长度为238 bp的内含子,内含子符合GT-AG规则;BoiEPS的编码区全长1 032 bp,编码343个氨基酸;编码蛋白具有2个Kelch结构域,分别含52和59个氨基酸残基(图1)。BoiEPS的理论等电点为5.71,分子量37 745 Da,分子式为C1707H2553N451O514S4;总平均亲水性系数为-0.558,说明BoiEPS是一种亲水蛋白。

注:阴影部分为Kelch结构域。Note: The Kelch domains are shaded.图1 西兰花BoiEPS的编码区及推导的氨基酸序列Fig.1 Coding sequence and the deduced amino acid sequence of BoiEPS from broccoli
2.2 系统发育分析
利用Mega软件构建BoiEPS及同源蛋白序列的系统发生树,结果如图2所示。8种植物的EPS在系统发生树上可分为5组,芸薹属的西兰花与芜菁处于同一分支,支持率为99%,同时与甘蓝型油菜聚于组I,支持率达99%。葶苈属的黄花葶苈和锥果葶苈聚于组Ⅴ,支持率达100%,而菘蓝、白芥和拟南芥各自单独成组(Ⅱ~Ⅳ)。

图2 BoiEPS及同源序列的系统发育树Fig.2 Phylogenetic tree of BoiEPS and its homologous sequences
2.3 基因表达分析
利用引物对BoP3/BoP4进行实时荧光定量PCR分析,结果表明,BoiEPS的表达受野油菜黄单胞菌的诱导,表达量呈先上升后下降的趋势。基因表达量在接种24 h时达到最高,为0 h的2.39倍,之后逐渐降低,接种48和72 h时的基因表达量分别是0 h的2.06和1.43倍,接种96 h时的表达量与0 h之间无显著差异(图3)。
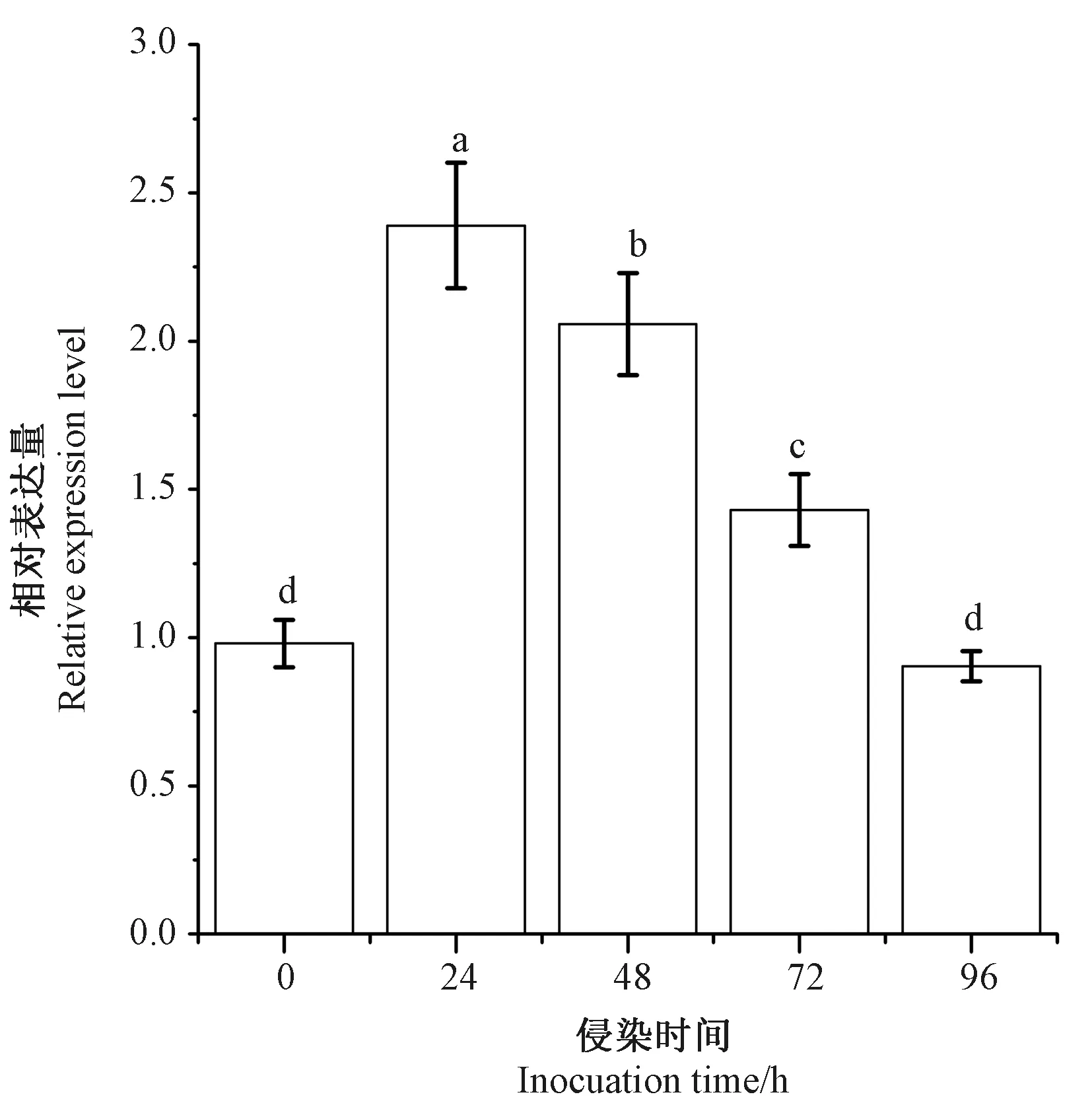
注:不同小写字母表示不同处理间差异显著(P< 0.05)。Note: Different lowercase letters indicate significant differences among treatments at 0.05 level.图3 BoiEPS基因在野油菜黄单胞菌侵染下的表达Fig.3 Expression of BoiEPS gene challenged by Pseudomonas syringae pv. tomato
2.4 遗传转化结果分析
通过遗传转化得到3个过量表达株系,分别命名为OE-1、OE-2和OE-3。野油菜黄单胞菌侵染5 d时,WT叶片上出现病斑,叶色略黄,而3个过表达株系未出现明显的病斑,但OE-1和OE-2的叶片轻微发黄,叶色与WT相近,OE-3的叶色较深,边缘有轻微的发黄现象(图4)。基因表达分析结果表明,OE-1、OE-2和OE-3的表达量显著增加,分别为WT的6.04、6.87和9.59倍(图5)。病原菌计数结果表明,3个过量表达株系与WT之间存在显著差异,WT中检测到的病原菌数量最多(9.77个),而OE-3中最少,仅5.17个(图6)。利用实时荧光定量PCR研究病程相关蛋白PR1基因的表达,结果表明,3个过量表达株系BoPR1基因的表达量均显著高于WT,OE-1、OE-2和OE-3的相对表达量分别为WT的3.88、4.58和6.63倍(图7)。

注:WT:野生型;OE-1、OE-2和OE-3:过量表达株系。Note: WT: Wild type. OE-1、OE-2 and OE-3: Over-expressing lines.图4 西兰花的不同株系Fig.4 Different broccoli lines
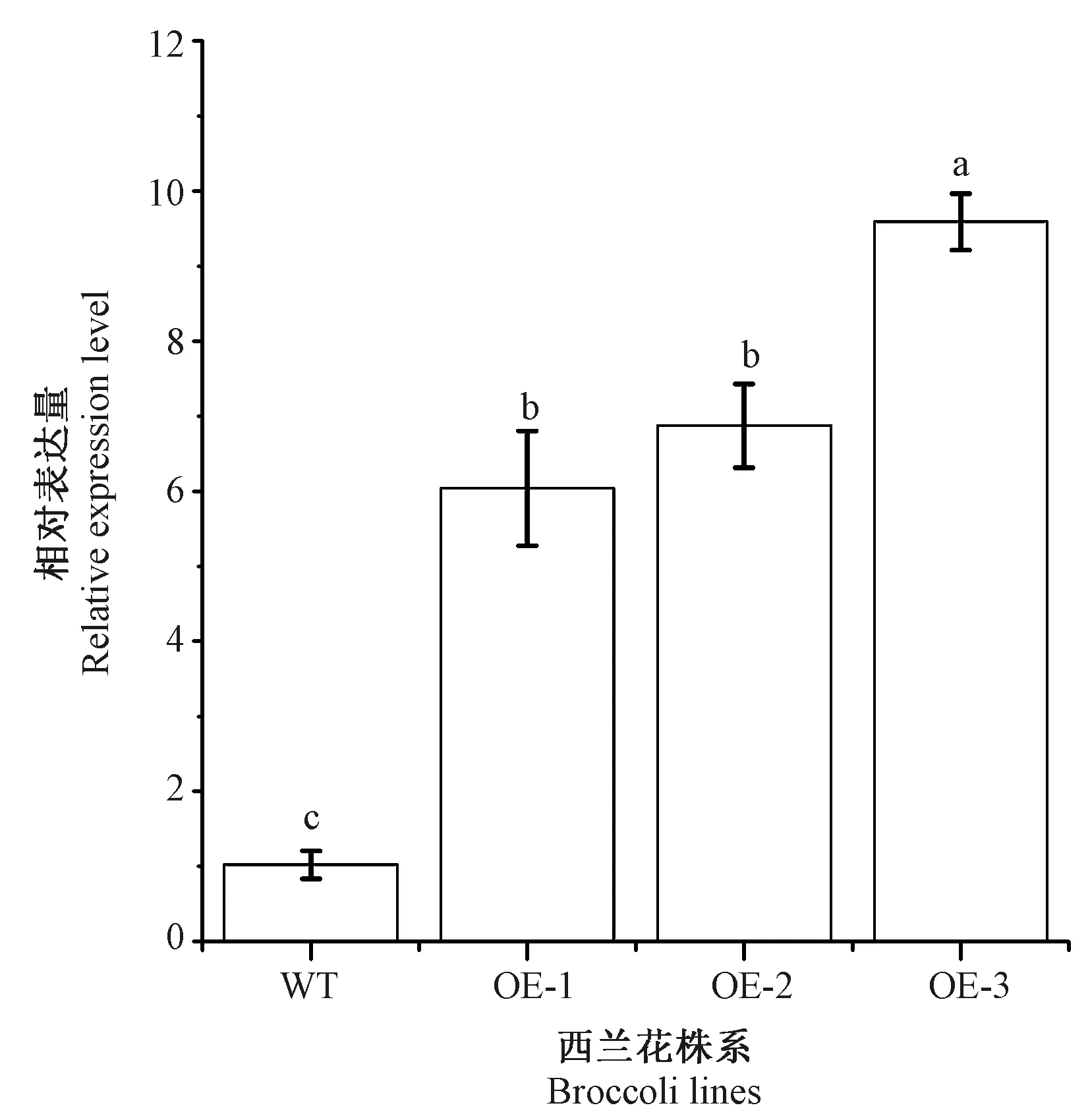
注:不同小写字母表示不同株系间差异显著(P< 0.05)。下同。Note: Different lowercase letters indicate significant differences among lines at 0.05 level. The same as following.图5 BoiEPS基因在西兰花不同株系中的表达Fig.5 Expression of BoiEPS gene in different broccoli lines

图6 不同西兰花株系中菌落的数量Fig.6 The number of clony-forming units in different broccoli lines
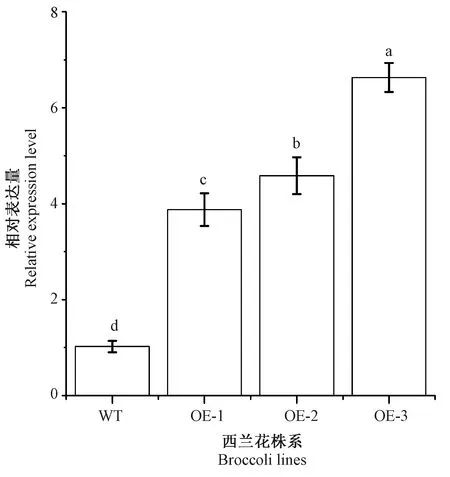
图7 BoPR1在不同西兰花株系的表达Fig.7 Expression of BoPR1 in different broccoli lines
3 讨论
十字花科植物富含硫代葡萄糖苷,该物质通过黑芥子酶(myrosinase)、表皮硫特异蛋白及其修饰蛋白(epithiospecifier modifier protein,EMP)等的作用生成异硫氰酸酯、硫氰酸盐、腈类化合物和上皮硫烷烃等[1]。硫代葡萄糖苷的含量与环境条件相关,利用高浓度的葡萄糖处理小白菜(B.campestrisssp.chinensisvar.communis),可显著提高脂肪族硫代葡萄糖苷的含量[20]。在正常情况下,黑芥子酶与硫代葡萄糖苷彼此分离,在植物受伤或细胞受损时,两者发生混合,生成葡萄糖、氢离子和糖苷配基[21];表皮硫特异蛋白则催化异硫氰酸酯生成环腈类和腈类物质,在拟南芥中,表皮硫特异蛋白的修饰蛋白基因位于3号染色体,它与表皮硫蛋白共同作用,影响腈类物质的合成[22]。
表皮硫蛋白最早从海甘蓝(Crambeabyssinica)中分离得到,当硫代葡萄糖苷和黑芥子酶同时存在时,可催化环硫腈的生成[22-25]。近年来,研究人员已从拟南芥、甘蓝型油菜中克隆到了EPS基因,并对它们的功能进行了初步研究[26-27],在菘蓝中也有该基因克隆的报道[28]。本研究从西兰花中克隆到1个EPS基因,该基因具有2个外显子和1个内含子,外显子和内含子数量与拟南芥[26]、菘蓝[28]相同,但序列大小差异较大,拟南芥、菘蓝的内含子大小分别为1 865 bp和391 bp,而西兰花的内含子仅238 bp。Kelch结构域大约由50个氨基酸组成,含该结构域的蛋白功能多样,在硫代葡萄糖苷代谢过程中,Kelch能与黑芥子酶结合,并水解生成特殊的腈类化合物[29]。本研究中,BoiEPS有2个Kelch结构域,氨基酸残基数量分别为52和59。拟南芥表皮硫特异蛋白基因的表达受丁香假单胞菌番茄变种(Pseudomonassyringaepv.tomato)的诱导,过量表达可提高拟南芥对该病原菌的抗性,而其突变体对丁香假单胞菌番茄变种的抗性减弱[29]。本研究中,西兰花BoiEPS的表达受野油菜黄单胞菌的诱导,其过量表达显著提高了西兰花对黑腐病的抗性,叶片中病原菌的数量明显减少。PR1是一种重要的病程相关蛋白,具有抗菌活性,并与水杨酸介导的信号传导相关[30]。本研究发现,病程相关蛋白BoPR1在BoiEPS过表达植株中的表达量显著提高,表明BoiEPS具有抗黑腐病的功能。
4 结论
本研究从西兰花中克隆到1个表皮特异硫蛋白基因,命名为BoiEPS,该基因的基因组DNA全长为1 270 bp, 具有1个内含子,编码区全长1 032 bp,编码343个氨基酸,编码蛋白含有2个Kelch结构域。系统发育分析结果表明,BoiEPS与来自芸薹属植物的EPS聚为一组。基因的表达受野油菜黄单胞菌的诱导,在24 h的表达量最大,且该基因的过量表达可显著提高西兰花对黑腐病的抗性。

