基于CRISPR/Cas9技术对水稻细胞质分裂关键基因OsMAP65-3s的编辑
林小丽 姜志树 贺 榕 胡嘉敏 朱昌兰 周大虎 贺浩华 徐 杰
(江西农业大学农学院/作物生理生态与遗传育种教育部重点实验室/江西省超级稻工程技术研究中心/双季稻现代化生产协同中心,江西 南昌 330045)
细胞分裂是植物发育中重要的生理过程,细胞在该阶段由一个分裂成两个子细胞。细胞分裂既调控植物器官的大小,也为植物适应多种环境提供可塑性。细胞质分裂发生在减数分裂或有丝分裂的后期至末期,此过程是细胞一分为二形成子细胞的关键,也是高等植物和动物正常生长发育以及繁衍后代的重要环节[1]。细胞分裂后期,纺锤丝将染色体拉向细胞两极,然后子核开始形成,两个子核之间增加了许多短的纺锤丝,形成一个密集着纺锤丝的桶状区域,称为成膜体。成膜体是体细胞中有丝分裂细胞的一个反平行微管阵列,反映动态微管网络最显著的特征之一[2]。当细胞进入到分裂末期,桶状成膜体外围的微管聚合,而中间的微管发生解聚,成膜体围绕着生长的细胞板向外呈放射状扩张,变成环状结构[3-4]。
成膜体微管呈现了非常不稳定的动态,这也是成膜体膨胀、细胞板合成所必需的。成膜体微管的排列组装还需要许多具有特定能力(如微管成核、聚合、成束等)的调节因子参与,而微管成束过程由微管交联蛋白MAP65家族二聚化介导[5-6]。植物MAP65蛋白最早纯化自烟草BY-2细胞,大小为65 kD,该蛋白具有微管结合活性,在整个细胞周期中与BY-2细胞中的微管共定位[7]。Chan等[8]从胡萝卜细胞骨架中纯化出两种MAP65蛋白,均对细胞微管有修饰作用。在拟南芥基因组中存在9个MAP65家族成员,通过蛋白序列比对,表明上述蛋白的氨基酸水平与烟草MAP65蛋白有28%~79%的同源性[9]。拟南芥(Arabidopsisthaliana)所有MAP65家族成员都可作为微管成束因子,但家族成员的表达模式、细胞定位和靶标微管都存在差异,表明其在细胞内的功能可能不一样[10-11]。MAP65-1和MAP65-2组成型表达于所有被检测的细胞[12],而AtMAP65-4定位于分裂后期的纺锤丝中间以及成膜体中,Damme等[13]研究观察根尖分生组织的分裂过程,发现该蛋白于早前期带(preprophase band,PPB)时期开始表达,并一直持续到细胞质分裂完成。AtMAP65-6定位于线粒体,可能参与细胞器与微管之间的互作[14]。MAP65-3是细胞质分裂特异的MAP65家族成员,与其他家族成员不同,AtMAP65-3只与成膜体微管结合,并集中于微管的正极,即位于成膜体中线区域[11,15],是调节植物胞质分裂的重要因子。atmap65-3突变体植株矮小,生长发育受到严重影响,进一步通过细胞学观察,发现突变体成膜体中间区域变得更宽,微管束排列松散,且高达40%细胞的细胞质分裂出现问题,突变体根系发育受到影响[15-16]。
水稻(OryzasativaL.)是我国最重要的粮食作物之一,也是单子叶模式植物。系统研究水稻细胞分裂不仅可以补充和丰富植物有丝分裂的分子调控机制,也可以为调控水稻发育提供新的思路。但是,由于细胞分裂对植物发育的重要性(突变易致死)以及家族成员功能冗余(突变无表型),导致水稻细胞分裂突变体难以获得,相关的研究无法开展。目前,水稻细胞分裂的相关研究较少,尤其是胞质分裂过程的相关研究几乎空白。由于MAP65-3是调控细胞板的合成及细胞质分裂的关键因子,因此水稻中MAP65-3同源蛋白是开展水稻细胞分裂工作的突破口。水稻中包含11个MAP65成员[17],其中LOC_Os01g49200和LOC_Os05g47970与AtMAP65-3同源性最高,其氨基酸同源性分别高达55%和53%,分别命名为OsMAP65-3.1和OsMAP65-3.2。江西农业大学作物生理生态与遗传育种实验室前期通过首创的烟草叶片瞬时分裂系统,发现OsMAP65-3.1和OsMAP65-3.2定位于成膜体中线区域,表明水稻中的2个基因可能与拟南芥AtMAP65-3基因功能相似,在胞质分裂中通过调控成膜体微管动态参与水稻生长发育。因此,创制和获得水稻MAP65-3基因突变体是开展功能研究的首要任务,对阐明水稻细胞分裂和胞质分裂调控机理十分必要。
本研究采用CRISPR/Cas9技术对水稻OsMAP65-3.1 和OsMAP65-3.2进行同时编辑,高效、快速、特异地创制单基因突变体和双基因突变体。分别针对2个基因设计特异性靶位点,构建至同一个载体,用农杆菌介导的遗传转化获得转基因植株,测序分析靶位点序列,筛选编辑植株和突变体,旨在为探讨OsMAP65-3基因的功能和水稻细胞分裂调控机制奠定基础。
1 材料与方法
1.1 试验材料及田间管理
大肠杆菌DH5α,感受态采用CaCl2法,参照《基因工程》[18]的方法制备。农杆菌EHA105,感受态采用Milani等[19]的方法制备。
植物材料为粳稻品种日本晴(Nipponbare),转基因材料均种于人工气候室,培养条件如下:28℃光照培养12 h,25℃黑暗培养12 h,光照强度为10 000 lx。
1.2 sgRNA设计
参考CRISPRdirect数据库(http://crispr.dbcls.jp/)设计OsMAP65-3s的特异靶位点。对OsMAP65-3.1 与OsMAP65-3.2的编码区序列进行扫描分析,以原间隔子邻近序列(protospacer adjacent motifs,PAM)前20碱基作为候选位点,日本晴全基因组为参考序列,选择特异性高的序列为靶位点,靶位点选择靠近目标基因5′端,旨在提高无功能蛋白的发生概率从而实现目标基因敲除。
1.3 载体构建
以pENTR-sg4作为入门载体(图1-A),pUbi-Cas9作为目标载体(图1-B),使用Gateway重组系统构建OsMAP65-3.1与OsMAP65-3.2双基因敲除载体。首先,针对每一个设计的靶位点,合成两条反向互补核苷酸单链,分别在5′端添加TGTT和AAAC(pENTR-sg4载体BtgZ I消化形成的突出末端)或GTGT和AAAC(pENTR-sg4载体BsaI消化形成的突出末端),退火复性形成带粘性末端的靶位点双链片段;其次,用BtgZ I线性化pENTR-sg4入门载体,使用DNA连接酶将第一个基因靶位点片段整合,热激法转化大肠杆菌,PCR检测后测序;然后,用BsaI线性化中间载体(已插入第一个基因靶位点的入门载体),通过连接插入第二个基因靶位点片段,转化大肠杆菌,PCR检测后测序;最后,利用LR重组酶,将插入2个基因靶位点片段入门载体与pUbi-Cas9目标载体进行重组,转化大肠杆菌,PCR检测后测序。
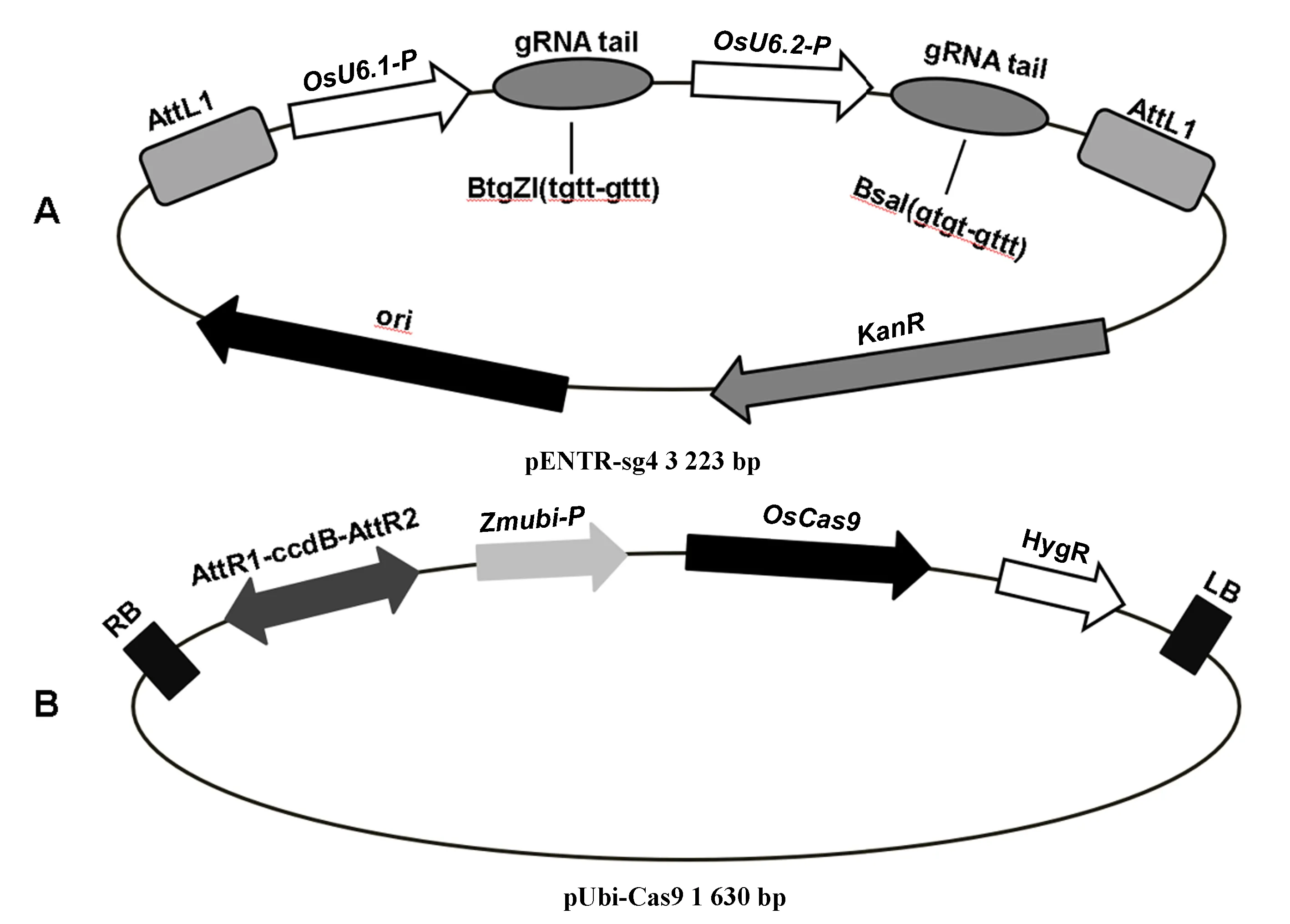
注:A:入门载体PENTR4-sg;B:目标载体pUbi-Cas9。OsU6:水稻U6启动子;Zmubi-p:玉米Ubi启动子;LB:Ti质粒左边界;RB:Ti质粒右边界;OsCas9:水稻密码子优化的Cas9基因;KanR:卡那抗性标记;HygR:潮霉素抗性标记。Note: A:The entry vector pENTR4-sg. B:The destination vector pUbi-Cas9. OsU6: Rice U6 promoter. Zmubi-p: Maize Ubi Promoter. LB: Ti vetor left border. LB: Ti vetor right border. OsCas9:Rice codon optimized cas9. KanR: Kanamycin resistant gene. HygR: Hygromycin resistant gene. 图1 基因编辑载体结构Fig.1 Structure of gene editing vectors
1.4 农杆菌转化
采用冻融法[20]转化农杆菌。用CaCl2法处理EHA105农杆菌菌株,制备感受态。将5 μg构建好的CSMAP65-3A和CSMAP65-3B质粒分别加入感受态细胞中,冰浴 30 min后液氮迅速冷冻3 min,37℃水浴5 min,加入1 mL农根农杆菌培养基(yeast mannitol medium, YEB)液体培养基,置28℃转速200 r·min-1摇床恢复培养3 h。取200 μL 培养物,在YEB固体培养基(卡那霉素+利福平)上筛选培养,于28℃培养3 d后,挑取单克隆菌落进行PCR鉴定。
1.5 水稻转化
选用300粒日本晴种子,去壳后用75%乙醇表面消毒1 min,次氯酸钠溶液消毒30 min,移至营养肉汤(nutrien broth, NB)培养基(含2 mg·L-1的2,4-二氯苯氧乙酸2,4-D),26℃暗培养2周,挑选生长状况好的愈伤用作转化外植体;制备纯度高,生活力强的EHA105工程菌液,浸染水稻愈伤后,在25℃暗条件下共培养3 d;脱菌后在含有50 mg·L-1潮霉素的筛选培养基上光照培养14 d左右(光照强度为13 200 lx,温度为32℃);将预分化的愈伤转至分化培养基上光照培养1个月左右(光照强度为13 200 lx,温度为32℃),得到抗性转基因植株;用1/2 MS培养基生根壮苗获得T0代植株。
1.6 基因编辑情况分析
用CTAB法[21]提取T0代转基因植株叶片DNA,通过检测载体上抗潮霉素基因(HPTⅡ)确定转基因阳性植株。用HPTⅡ特异引物Hyg-F(T C T C C G A C C T G A T G C A G C T C T CG)和Hyg-R(G C A C T G A C G G T G T C G T C C A T C A C AG)进行PCR检测。PCR扩增10 μL体系如下:模板DNA 1 μL,10×Buffer 1 μL,dNTP 0.4 μL,引物(F+R)各0.5 μL,Taq酶0.05 μL,ddH2O 6.55 μL。PCR程序如下:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸45 s,27个循环;72℃终延伸10 min。
针对靶位点附近序列设计引物,对转基因阳性植株的OsMAP65-3.1和OsMAP65-3.2进行克隆及测序分析。采用高保真酶KOD-Fx酶(日本东洋纺公司TOYOBO生产)进行PCR反应,KOD酶错配率低,可提高试验结果的可靠性。PCR扩增20 μL体系如下:模板DNA 2 μL,2×Buffer 10 μL,dNTP 1 μL,引物(F+R)各1 μL,KOD酶0.5 μL,ddH2O 4.5 μL。PCR程序如下:94℃预变性5 min;94℃变性30 s,60℃退火30 s,68℃延伸1 min,30个循环;68℃终延伸10 min。
2 结果与分析
2.1 水稻MAP65-3s同源蛋白分析
水稻中MAP65-3基因的来源用AtMAP65-3氨基酸序列在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库进行比对,证实水稻中的2个基因(LOC_Os01g49200和LOC_Os05g47970)与AtMAP65-3同源性最高,同源性分别高达55%和53%(图2),且2个基因之间的同源性高达74%。LOC_Os01g49200(OsMAP65-3.1)基因包含13个外显子,蛋白质编码区(coding sequence, CDS)全长2 070 bp,编码689个氨基酸;而LOC_Os05g47970(OsMAP65-3.2)同样包含13个外显子,CDS全长1 989 bp, 编码662个氨基酸。
植物MAP65蛋白包含一个相对保守的N端和一个保守性较差的C端,C端又分为C1和C2区,靠近C端的C2区保守性最差。N端是蛋白质形成二聚体所必需的功能结构域,C端是微管结合结构域[21]。进一步的比对结果也证明OsMAP65-3.1、OsMAP65-3.2与AtMAP65-3在N端(均为61%)和C1区同源性较高(分别64%和65%),而在C2区同源性相对较低(42%和35%)。
2.2 OsMAP65-3s sgRNA靶位点设计
对OsMAP65-3.1和OsMAP65-3.2编辑,依据靠近5′端和高特异性的原则,各设计了2个20 bp的靶位点,分别为CS3.1-1和CS3.1-2、CS3.2-1和CS3.2-2,序列信息见表1。CS3.1-1和CS3.1-2分别位于OsMAP65-3.1基因CDS的42~61和161~180;CS3.2-1和CS3.2-2分别位于OsMAP65-3.2基因CDS的221~240和468~487。4个靶位点均在对应基因的N端区域,编辑易产生无功能蛋白。此外,这些靶位点的特异性非常高,每一个靶位点的20个碱基序列在水稻基因组中都是唯一的;为考虑脱靶因素产生其他编辑,仅用12碱基作为靶序列进行基因组比对分析,每个靶位点也是唯一的;以8碱基作为靶序列的位点也较少,都在700之下。分析结果表明本研究所设计的靶位点特异性极高,脱靶概率极低,可特异编辑并产生无功能的OsMAP65-3.1和OsMAP65-3.2。
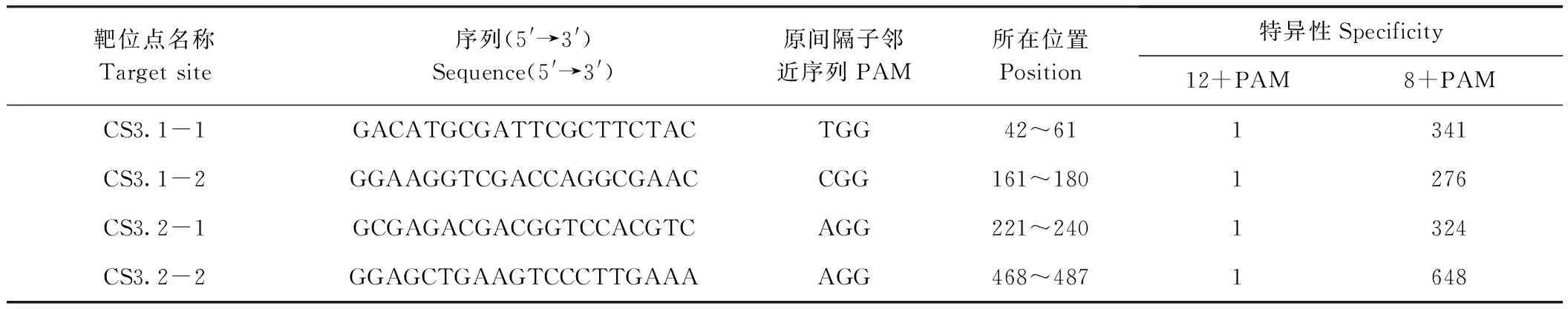
表1 OsMAP65-3s靶位点相关信息Table 1 The information of target sites for OsMAP65-3s
2.3 OsMAP65-3.1和OsMAP65-3.2双基因编辑载体构建
由于OsMAP65-3.1和OsMAP65-3.2同源性较高,并均定位于成膜体中线,可能具有相似的功能。为避免两者的功能冗余现象,将两个基因的sgRNA构建至同一载体上,以获得单基因和双基因同时编辑的植株。为构建双基因编辑载体,根据入门载体pENTR-4sg特征,利用单链合成和退火复性形成双链,将靶位点CS3.1-1 和CS3.2-1 序列带上BtgZ I酶切后的粘性末端序列,CS3.1-2和CS3.2-2序列带上BsaI酶切后的粘性末端序列(图3-A、B)。通过酶切连接法先将CS3.2-1和CS3.1-1分别整合到PENTR4-sg 载体BtgZ I位点,再将CS3.1-2和CS3.2-2 分别整合到对应中间载体的BsaI位点,构建入门载体PENTR4-sgMAP65-3A和PENTR4-sgMAP65-3B。PENTR4-sgMAP65-3A包含靶向CS3.2-1和CS3.1-2的sgRNA,PENTR4-sgMAP65-3B则包含靶向CS3.1-1 和CS3.2-2 的sgRNA。采用PCR技术对两个入门载体阳性克隆检测,前者用OsMAP65-3.2-pENTR-sg4-OsMAP65-3.1-2-R1作为引物,后者用OsMAP65-3.1-1-F1/OsMAP65-3.2-2-R1作引物(表2)。结果表明所检测的菌落均能扩增出片段,说明两个靶位点均已同时整合到载体上,阳性菌落测序结果也证实了入门载体构建成功。通过LR重组反应将对应片段整合到目标载体pUbi-Cas9,形成两个双基因编辑载体,分别为CSMAP65-3A和CSMAP65-3B。双基因编辑载体中包含OsU6.1和OsU6.2启动子指导的OsMAP65-3.1sgRNA和OsMAP65-3.2sgRNA,以及玉米Ubi启动子指导的Cas9基因等重要结构(图2-C、D),确保OsMAP65-3.1sgRNA、OsMAP65-3.2sgRNA和Cas9在水稻中表达。

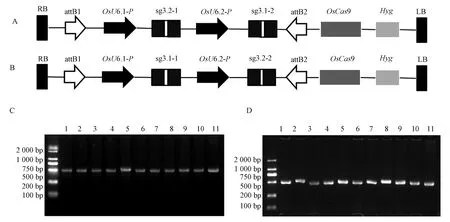
注: A: CSMAP65-3A载体结构图;B: CSMAP65-3B载体结构图;C:CSMAP65-3A载体菌落检测图; D: CSMAP65-3B载体菌落检测图。OsU6:水稻U6启动子; LB:Ti质粒左边界;RB:Ti质粒右边界;OsCas9:水稻密码子优化的Cas9基因; Hyg:潮霉素抗性标记。Note: A: Structure of CSMAP65-3A. B: Structure of CSMAP65-3B. C: Positive clone selection for CSMAP65-3A by PCR. D: Positive clone selection for CSMAP65-3B by PCR. OsU6: Rice U6 promoter. LB: Ti vetor left border. RB: Ti vetor right border. OsCas9: Rice codon optimized Cas9. Hyg: Hygromycin resistant gene.图3 OsMAP65-3s双基因编辑载体构建Fig.3 Construction of double-gene-editing vectors for OsMAP65-3s
2.4 转基因植株鉴定
用含有OsMAP65-3s双基因编辑载体(CSMAP65-3A、CSMAP65-3B)的EHA105菌株制备的工程菌液转化水稻,分别获得17和21株转基因植株。用筛选标记抗潮霉素基因HPTII特异引物Hyg-F和Hyg-R对转基因植株进行PCR鉴定,以载体质粒为模板做阳性对照,野生型日本晴DNA为模板做阴性对照。其中CSMAP65-3A载体获得16株阳性转基因植株,仅有#5株系为阴性植株(图4-A);而CSMAP65-3B载体也仅有#5植株表现为阴性,其他20株均为阳性植株(图4-B)。鉴定结果表明两个载体转基因植株的转化效率均较高,可获得足够的转基因株系供后续基因编辑分析。
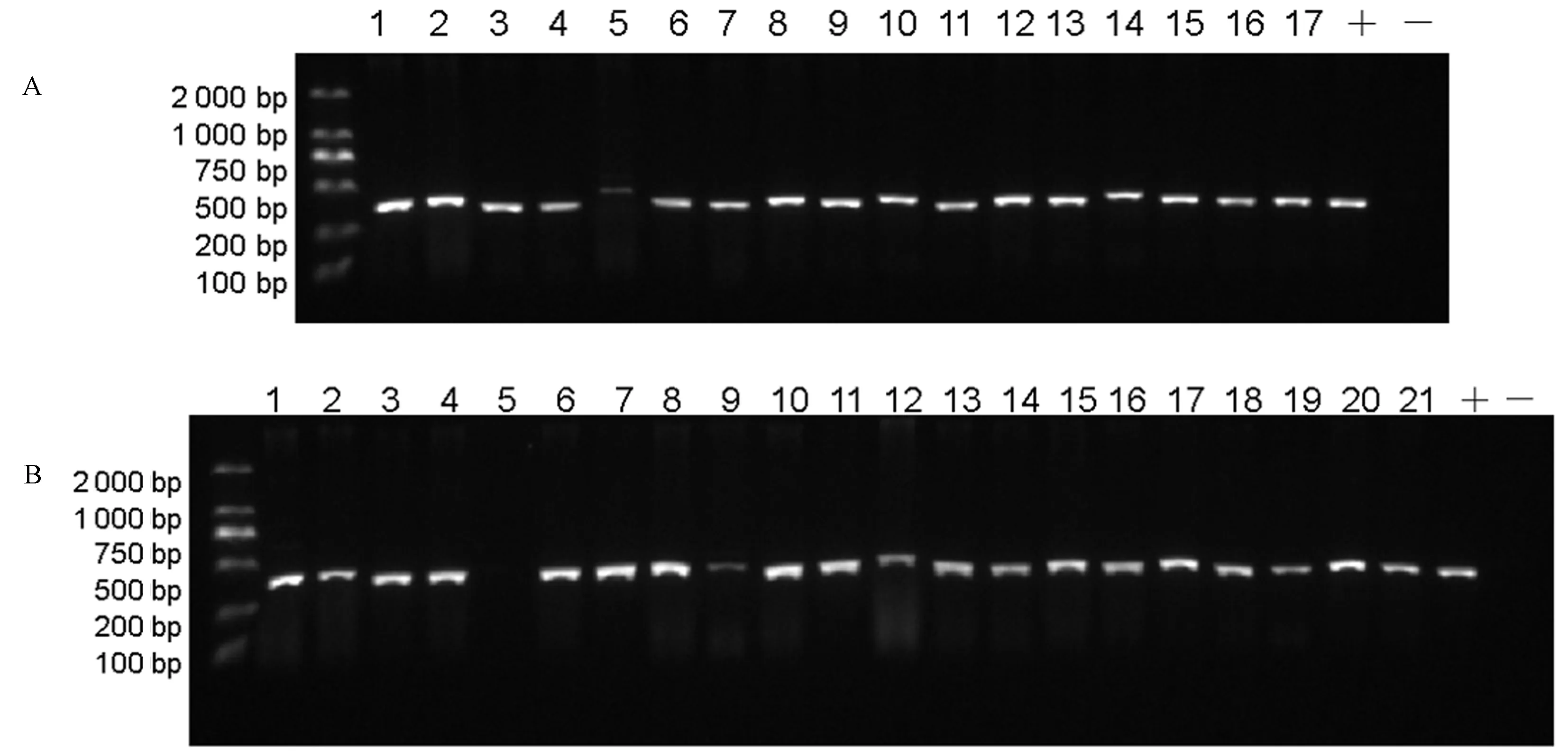
注:A: 转CSMAP65-3A植株HPT Ⅱ鉴定图,1-17泳道代表CSMAP65-3A对应的17株转基因植株; B:转CSMAP65-3B植株HPT Ⅱ鉴定图,1-21代表CSMAP65-3B对应的21株转基因植株。“+”代表以载体质粒为模板的阳性对照,“-”代表以野生型日本晴为模板的阴性对照。Note: A: HPT Ⅱ identification in CSMAP65-3A transgenic plants, 1-17 lane represents 17 transgenic plants corresponding to CSMAP65-3A. B: HPT Ⅱ identification in CSMAP65-3B transgenic plants. 1-21 represents 21 transgenic plants corresponding to CSMAP65-3B. ‘+’ represents positive control with vector plasmid as template. ‘-’ represents negative control with wild-type Nipponbare as template.图4 转基因株系潮霉素抗性基因HPT ⅡPCR鉴定Fig.4 Identification of HPT Ⅱ in transgenic lines by PCR
2.5 靶位点序列克隆
为分析转基因植株中OsMAP65-3.1和OsMAP65-3.2基因编辑情况,用高保真酶克隆靶位点附近片段。由于OsMAP65-3.1基因的2个靶位点(CS3.1-1和CS3.1-2)在该基因DNA序列位置距离仅99 bp,可共用一对引物克隆目标片段,即SQ-OsMAP65-3.1-F/SQ-OsMAP65-3.1-R;而OsMAP65-3.2 2个靶位点(CS3.2-1和CS3.2-2)在染色体位置相差857 bp,克隆需设计不同引物,分别为SQ-OsMAP65-3.2-1-F/SQ-OsMAP65-3.2-1-R和SQ-OsMAP65-3.2-2-F/SQ-OsMAP65-3.2-2-R(表3)。提取CSMAP65-3A和CSMAP65-3B转基因株系DNA,用对应引物对靶位点序列进行克隆,通过PCR反应获得所有株系对应位置的OsMAP65-3.1和OsMAP65-3.2片段,用于测序及编辑情况分析。

表3 OsMAP65-3s各靶位点片段克隆引物Table 3 Primers of target sites for OsMAP65-3s
2.6 OsMAP65-3s编辑情况分析
以野生型序列作为参考,通过测序峰图读取,可分析出每条染色体被编辑的情况。对CSMAP65-3A、CSMAP65-3B转基因株系中各靶位点附近序列的测序峰图进行分析,重点考查正常峰图结果(单峰)是否存在个别位点的套峰(杂合)以及双染色纯合编辑情况,双峰结果是一条染色体被编辑还是两条染色体都被编辑(不同编辑形式)。如CSMAP65-3A转基因#3植株和CSMAP65-3B转基因#3植株,其OsMAP65-3.1与OsMAP65-3.2相应靶位点附近序列测序结果均表现为双峰(图6)。在CSMAP65-3A-#3中,OsMAP65-3.1两条染色体均被编辑,其中一条缺失2个碱基,氨基酸发生移码并提前终止,而另外一条染色体发生单碱基替换,导致其保守区氨基酸发生改变,可能会影响蛋白功能,需后期继续研究;OsMAP65-3.2同样有两条染色体均被编辑,其中一条插入1个碱基,导致氨基酸移码并提前终止,另外一条染色体发生3碱基缺失,在较不保守区域缺失1氨基酸,推测可能不影响蛋白功能。在CSMAP65-3B-#3株系的OsMAP65-3.1与OsMAP65-3.2基因在两条染色体均被编辑,两者编辑形式分别是缺失3碱基/插入1碱基和插入2碱基/缺失4碱基、插入1碱基(图6)。
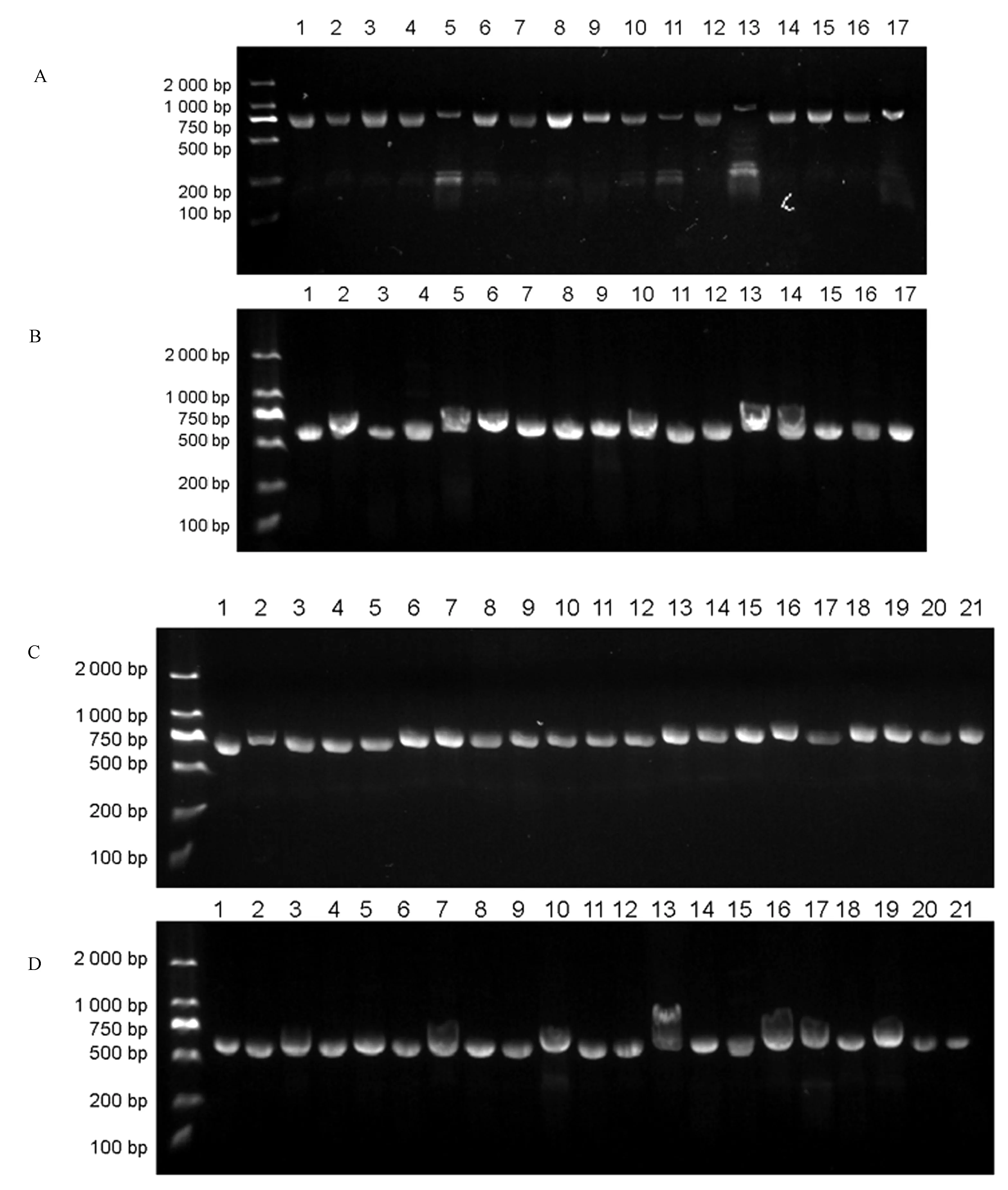
注:CSMAP65-3A 17株转基因植株中OsMAP65-3.2-1靶位点区域片段克隆(A)和OsMAP65-3.1-2靶位点区域片段克隆(B);CSMAP65-3B 21株转基因植株中OsMAP65-3.1-1靶位点区域片段克隆(C)和OsMAP65-3.2-2靶位点区域片段克隆(D)。Note:Cloning of OsMAP65-3.2-1 target region fragment (A) and cloning of OsMAP65-3.1-2 target region fragment (B) in 17 CSMAP65-3A transgenic plants. Cloning of OsMAP65-3.1-1 target region fragment (C) and cloning of OsMAP65-3.1-2 target region fragment (D) in 21 CSMAP65-3A transgenic plants. 图5 转基因植株中OsMAP65-3s靶位点区域片段克隆Fig.5 Cloning of target sites for OsMAP65-3s in transgenic plants
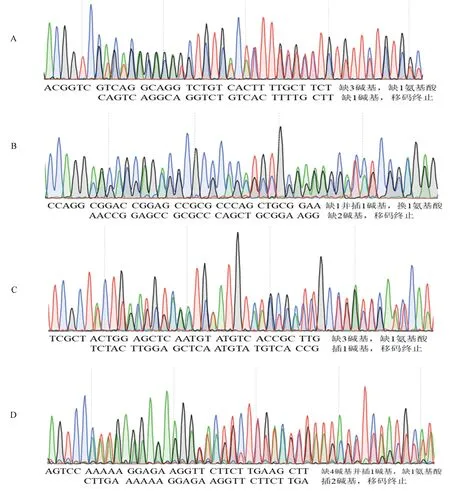
注:CSMAP65-3A转基因3号株系OsMAP65-3.2-1位点编辑情况(A)和OsMAP65-3.1-2位点编辑情况(B);CSMAP65-3B转基因3号株系OsMAP65-3.1-1位点编辑情况(C)和OsMAP65-3.2-2位点编辑情况(D)。Note:The edition of OsMAP65-3.2-1 site (A) and OsMAP65-3.1-2 site (B) in CSMAP65-3A transgenic plants (#3). The edition of OsMAP65-3.1-1 site (C) and OsMAP65-3.2-2 site (D) in CSMAP65-3B transgenic plants (#3).图6 部分转基因植株中OsMAP65-3s靶位点编辑分析Fig.6 The edition of target sites for OsMAP65-3s in transgenic plants
对全部转基因阳性植株进行分析(表4、5),发现在16个CSMAP65-3A阳性转基因株系中,有3个株系发生了基因编辑,其中2株的两个基因均发生编辑;其中2个单株中OsMAP65-3.1-2位点被编辑(3个编辑事件,2株都有一条染色体为移码终止),编辑效率为9.38%;3个株系OsMAP65-3.2-1位点被编辑,其中2株两条染色体均被编辑,包含5个编辑事件,4个为移码终止,编辑效率为15.62%。在20株CSMAP65-3B的转基因阳性材料中,9株发生编辑,其中4株的OsMAP65-3.1-1位点被编辑,其中3株两条染色体同时被编辑,共7个编辑事件,4个移码终止,编辑效率为17.50%;而OsMAP65-3.2-2发生编辑的9个株系全部为两条染色体同时编辑,移码终止的编辑事件高达13次,编辑效率为45.00%。

表4 CSMAP65-3A转基因植株中OsMAP65-3s编辑情况Table 4 The edition of OsMAP65-3s in CSMAP65-3A transgenic plants

表5 CSMAP65-3B转基因植株中OsMAP65-3s编辑情况Table 5 The edition of OsMAP65-3s in CSMAP65-3B transgenic plants
3 讨论
OsMAP65-3.1和OsMAP65-3.2是水稻中细胞质分裂关键因子MAP65-3的2个同源蛋白,本研究团队用烟草叶片瞬时分裂系统已经证明OsMAP65-3.1和OsMAP65-3.2均定位于成膜体中线[22],可能均参与调控水稻细胞质分裂,并可能存在功能冗余。本研究通过CRISPR/Cas9技术对水稻OsMAP65-3.1和OsMAP65-3.2进行编辑实现定点突变,创制osmap65-3s突变体,获取双基因突变体是分析其功能的重要前提,有利于阐明水稻有丝分裂调控机理。创制双基因突变体有两种方案:第一种方案需先分别获得单突变植株,然后进行杂交以获得双突植株。如拟南芥中的CPK10/CPK30双突变体是以纯合单突变体作为亲本进行人工杂交,繁衍至F2代从群体中分离出的纯合双突植株[23]。而水稻突变体资源相对较少,用该方案创制双突变体周期较长。需先用基因编辑技术创制两个基因的单突变体,再通过杂交将两个突变基因聚合到F1,自交F2中筛选到双突变体,经历3~6个世代才可获得双突变体。第二种方案是将两个基因的靶位点对应的sgRNA构建到同一个载体上,可对两个基因进行编辑。由于单个位点的编辑具有一定的概率,转化植株会出现不同的编辑组合,因此可获得单基因突变体和双基因突变体。该方案节省大量的时间,仅需1~2个世代就可获得双突变体。如水稻中酯酶家族成员同源性较高的成员OsGELP110与OsGELP115,将二者sgRNA构建到同一载体转化后,迅速获得osgelp110单突变体、osgelp115单突变体和osgelp110/osgelp115双突变体,此外单独敲除OsGELP110或OsGELP115无明显表型,而双突变体花粉外壁结构会发生变化,导致雄性不育[24]。本研究将OsMAP65-3.1和OsMAP65-3.2的不同靶位点整合成两个不同的双基因编辑载体CSMAP65-3A和CSMAP65-3B,转化后获得的T0代转基因材料中,已经获得多个osmap65-3.2、osmap65-3.2/OsMAP65-3.1(+/-)和OsMAP65-3.2(+/-)/OsMAP65-3.1(+/-)植株(表4、5),可通过对应株系自交T1代获得osmap65-3.1和osmap65-3.1/osmap65-3.2。此外,本研究中双基因编辑植株比例较高,16个CSMAP65-3A阳性植株中有2株,比例12.5%,而20个CSMAP65-3B的转基因株系中有4株两个基因同时被编辑,比例高达20%。而李星坤等[25]用双基因编辑载体对拟南芥中糖基转移酶同工酶基因UGT84A1和UGT84A2同时进行编辑,双突植株比例仅为4.76%。因此,本研究选用靶位点和编辑载体可快速、高效地创制OsMAP65-3s双突变体材料。
本研究针对OsMAP65-3.1和OsMAP65-3.2均设计了2个不同的靶位点,且都获得了水稻编辑植株。其中OsMAP65-3.1-1位点编辑效率为17.50%,OsMAP65-3.1-2位点编辑效率为9.38%;OsMAP65-3.2-1位点编辑效率为15.62%,OsMAP65-3.2-2编辑效率为45.00%。表明同一基因的不同靶位点会影响编辑效率,与已报道的蛋白激酶MPK5一致,载体的编辑效率与不同的靶序列相关性较大[26]。因此,为确保目标基因的高效编辑,应选用2个及以上的靶位点。但是,相比OsMAP65-3.2以及前人报道的水稻OsGRAS39基因[27],本研究中OsMAP65-3.1 2个靶位点编辑效率均较低,一定程度上可排除靶位点选择的因素。由于OsMAP65-3.1基因在水稻中的功能非常重要,该基因被编辑的细胞在水稻转化过程中难以存活,导致成苗率低,且大部分编辑事件无法检测到。因此,OsMAP65-3.1编辑植株难以获得。MAP65-3是调控植物细胞板的合成及细胞质分裂的关键因子[22,28]。MAP65-3通过二聚化及磷酸化调控其蛋白活性决定了成膜体中间区域空间的宽窄和成膜体的扩张;该基因的拟南芥突变体成膜体中间区域变的更宽,细胞质分裂失败的频率明显增加[29-30]。因此,水稻OsMAP65-3s异常可能会影响细胞分裂及转化苗的形成。
4 结论
本研究通过CRISPR/Cas9技术,对水稻中2个与细胞质分裂相关的OsMAP65-3基因进行敲除创制突变体材料。为避免基因功能冗余,本试验在一个载体中同时设计了OsMAP65-3.1与OsMAP65-3.2敲除靶位点,并且设计了2个双敲载体来提高编辑效率。在获得的2个转基因群体中,阳性植株比例均高于90%,所设计的4个靶位点都出现编辑事件,其中OsMAP65-3.1的2个靶位点的编辑效率分别为17.50%和9.38%,OsMAP65-3.2编辑效率分别为15.62%和45.00%。T0代已经获得4种突变体材料,分别是osmap65-3.2、osmap65-3.2/OsMAP65-3.1(+/-)和OsMAP65-3.2(+/-)/OsMAP65-3.1(+/-), 后面仍需通过自交获得osmap65-3.1单突变体及osmap65-3.1/osmap65-3.2 双突变体。此外,在获得的编辑植株中,OsMAP65-3.2在T0代已经出现2条染色体均被提前终止的突变体,而OsMAP65-3.1只存在突变杂合,表明OsMAP65-3.1与OsMAP65-3.2的功能可能存在差异,且OsMAP65-3.1在水稻有丝分裂过程中可能更为重要。

