梨果黑斑病菌磷酸二酯酶PDE基因克隆及其在侵染结构分化中的表达分析
毛仁燕 蒋倩倩 李永才 毕 阳 刘勇翔 黄 怡 张 苗
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
链格孢菌(Alternariaalternata)作为典型的潜伏性侵染真菌[1],是梨果采后主要致腐病原物之一[2],其侵染后不仅会造成重大的经济损失,同时其作为病原物产生的毒素等代谢产物还会引起食品安全隐患[3-4]。深入了解A.alternata与果实的互作机制,对开发有效的病害防控措施具有至关重要的意义。病原真菌通过感知和响应宿主表面疏水性和表皮蜡质组分等物化信号进而启动侵染,并在侵染过程中形成侵染结构,在病原菌识别外界信号的过程中,涉及众多细胞信号转导途径,如cAMP(cyclic adenosine monophosphate)、MAPK(mitogen-activated protein kinase)及Ca2+途径等[5]。其中,cAMP-PKA(cAMP-protein kinase A)信号传导途径在真菌致病调控中至关重要,该途径通过调节cAMP的细胞内水平来调节真菌病原体的形态发生和发病机制[6-7]。细胞内cAMP的水平取决于其合成和降解相关酶的活性和基因表达,其中磷酸二酯酶(phosphodiesterase, PDE)可通过降解cAMP进而维持胞内cAMP平衡。PDE共有11个家族,其家族催化域的氨基酸序列仅有25%~35%的相似性,但都具有共同的结构特征。如PDE所有催化域包含3个最多由16个螺旋组成的亚结构,这些螺旋中的活性位点由高度保守的氨基酸残基组成[8]。其次,与金属锌结合的位点包含2个组氨酸和2个天冬氨酸残基,这些残基属于磷酸二酯酶超家族HD结构的一部分,在目前已知的PDE中是绝对保守的[9]。在真菌中,PDE被划分为低亲和力磷酸二酯酶PDEL和高亲和力磷酸二酯酶PDEH,尽管不同真菌之间的序列相似性较低,但均具有保守特征序列[10-12]。研究发现,在玉米大斑病菌(Setosphaeriaturcica)[13]和柑橘褐斑病菌(Alternariaalternata)[14]中,PDEH和PDEL均具有典型的Ⅰ型和Ⅱ型催化结构域,但两种酶在致病性调控方面存在相反的结果。因此,了解AaPDE基因结构的特异性对阐明其调控机制具有重要意义。
PDE的主要功能是特异性催化cAMP/cGMP 3′,5′环磷酸的3′环磷酸键水解,进而调节胞内cAMP的水平。PDEH在真菌、哺乳动物等多种生物中均有表达并表现出重要的调控作用[15]。相比之下,对PDEL的研究仍不够系统,但已在多种生物,如酿酒酵母(Saccharomycescerevisiae)[15]、稻瘟病菌(Magnaportheoryzae)[16]、粟酒裂殖酵母(Schizosaccharomycespombe)[17]和新生隐球菌(Cryptococcusneoformans)中发现PDEL[18]。在S.cerevisiae中,ScPDEH在调节营养感知、假菌丝分化、细胞周期进程和应激信号传导中起重要作用[19],ScPDEL并不直接调控cAMP水平,只在葡萄糖存在的条件下负责调控cAMP水平[20]。在黄曲霉(Aspergillusflavus)中,AfPDEH对黄曲霉菌的生长和毒素合成具有重要调控作用,而AfPDEL对其作用较弱[21]。在模式真菌稻瘟病菌中,MoPDEH在产孢量、致病性和细胞内cAMP水平调节中均起主要作用,而MoPDEL无明显作用[22]。在人类病原体白色念珠菌(Candidaalbicans)中,CaPDEH通过调节细胞内cAMP水平来控制发育和毒性[23]。可见PDE的功能因病原物而异,具体调控机制尚需全面系统揭示。
本研究前期通过药理学研究发现cAMP-PKA信号途径与梨果表皮物化信号诱导A.alternata侵染结构分化有关[24],并对该途径的催化亚基AaPKAc进行了功能研究,进一步证实了cAMP-PKA信号途径调控A.alternata菌丝生长、生物量、致病性和毒素产生[25]。为进一步探究梨果黑斑病菌cAMP-PKA途径中对cAMP水平具有重要调控作用的PDE的生物功能,本研究克隆PDEL和PDEH基因,利用生物信息学的方法对其编码蛋白的理化性质、结构特征及分子进化等方面进行预测分析。此外,采用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)技术研究PDEL和PDEH在梨果黑斑病菌侵染结构分化过程中的表达特性,以期为进一步从分子水平揭示其调控机制奠定理论基础。
1 材料与方法
1.1 试验材料
梨果黑斑病病菌A.alternata菌株(KY397985.1)分离自梨果的黑斑病部,经过分离纯化后备用。
1.2 试验方法
1.2.1 梨果黑斑病菌A.alternata基因组DNA及RNA的提取 取培养于马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)中5 d(28℃)的A.alternata新鲜菌丝0.1 g于研钵中,液氮研磨后使用DNA提取试剂盒E.Z.N.A.©HP Fungal DNA Kit(Omega,美国)提取,具体步骤参照产品说明书。提取A.alternata总RNA时,将121℃高压灭菌后的研钵用液氮冰浴,再将上述取得的新鲜菌丝或孢子持续利用液氮冰预研磨,将研磨好的样品用TRNzol试剂提取,操作过程中将提取物始终保持在4℃以下,具体操作参考使用说明书。将所得的RNA用Biospecnano型核算定量仪(岛津,日本)测定浓度,并检测OD260/OD280等指标后置于-80℃冷冻保存。将部分提取的RNA使用PrimeScriptTMRT reagent Kit with gDNA Eraser(Code.RR047B)试剂盒(天根生化科技有限公司,北京)进行基因组gDNA消化以及第一链cDNA合成。
1.2.2 梨果黑斑病菌AaPDEL和AaPDEH基因克隆 在NCBI(https://www.ncbi.nlm.nih.gov/)下载A.alternata的磷酸二酯酶PDEL和PDEH的基因序列,利用DNAMAN 6.0设计AaPDEL和AaPDEH的扩增引物(表1),以梨果黑斑病菌A.alternata的cDNA为模板进行扩增,20 μL PCR反应体系:20 ng·μL-1cDNA 1 μL,10 μmol·L-1引物F、R各0.5 μL,2×PhantaMaxMasterMix高保真酶10 μL,ddH2O 8 μL。 扩增产物通过凝胶电泳(1%琼脂糖)观察条带大小,使用全式金琼脂糖凝胶回收试剂盒(Bio-Rad,美国)对符合预期大小的目的条带切胶回收。连接PTOPO-Blunt载体并送往北京擎科测序。
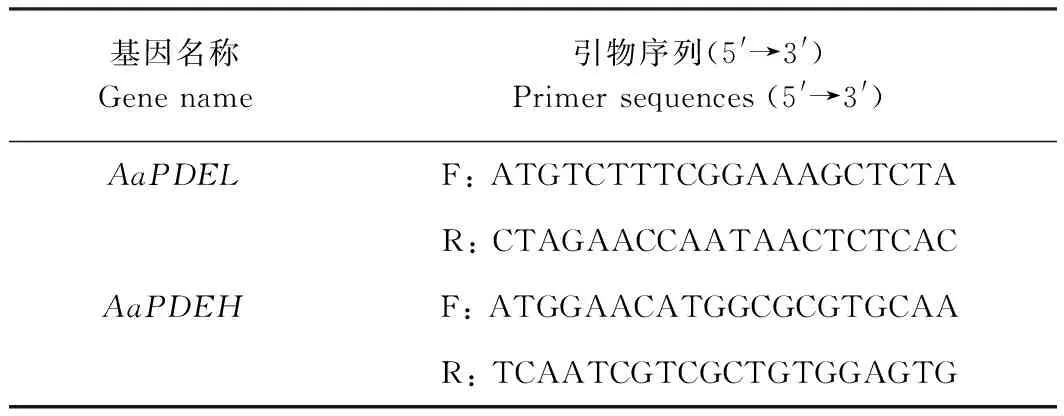
表1 扩增目的基因引物序列Table 1 Primers used for amplication of target gene
1.2.3AaPDEL和AaPDEH基因序列和编码蛋白的生物信息学分析 利用GENEDOC软件进行同源序列比对。采用MEGA7软件中的MUSCLE程序进行与其他真菌物种中PDE蛋白的多重序列比对,使用邻接法(neighbor-joining, NJ)构建系统进化树,运行参数如下:Bootstrap值为1 000,其余参数设置为默认值。利用在线网址进行目的基因及其编码产物的生物信息学分析,预测网址如表2所示:

表2 在线预测网址Table 2 Online website
1.2.4 qRT-PCR分析 用无菌水从培养5 d的A.alternata菌落中收集孢子,经过4层纱布过滤得到孢子悬浮液,并利用血球计数板计数,用无菌水稀释孢子悬浮液浓度至5×105spores·mL-1。将疏水Gelbond膜(接触角为74.63°)剪切至盖玻片大小(5 cm×2 cm)放置于铺有湿润滤纸的培养皿中后在膜上滴加20 μLA.alternata的孢子悬浮液,在28℃的恒温箱中黑暗培养2、4、6、8 h。用SYBR GreenⅠReal Time PCR方法检测A.alternata中AaPDEL和AaPDEH基因分别在孢子萌发(2 h)、芽管伸长(4 h)、附着胞形成(6 h)、侵染菌丝形成(8 h)阶段的mRNA转录水平。以磷酸甘油醛脱氢酶GAPDH(glyceraldehyde phosphate dehydrogenase)为内参基因,PCR反应程序:95℃预变性30 s,95℃变性5 s,60℃ 40 s (收集荧光),40个循环。以诱导2 h为对照,设置3次重复。基因相对表达量计算采用2-ΔΔCT算法。
1.2.5 数据统计与分析 全部试验数据采用Microsoft Excel 2010和SPSS 18.0数据处理系统进行分析,用Origin9.0绘制图表,用Duncan’s法进行差异显著性分析和标准偏差计算。
2 结果与分析
2.1 AaPDEL和AaPDEH基因克隆
以梨果黑斑病菌A.alternata(KY397 985.1)cDNA为模板,利用特异性引物AaPDEH-F/R和AaPDEL-F/R对其进行PCR扩增,得到大小分别为2 800 bp左右和3 100 bp左右的扩增产物AaPDEH和AaPDEL(图1)。

图1 AaPDEH和AaPDEL基因的克隆Fig.1 Cloning of AaPDEH and AaPDEL genes
2.2 AaPDEL和AaPDEH蛋白的生物信息学分析
2.2.1 基因结构及蛋白理化性质分析 基因结构及序列信息分析结果表明,AaPDEL基因全长为4 923 bp,包含4个内含子和5个外显子(图2),共含38个开放阅读框(open reading frame,ORF),其蛋白编码区(coding sequence, CDS)长度为3 132 bp,共编码1 043个氨基酸;AaPDEH基因全长为3 138 bp,包含5个内含子和6个外显子(图2),共含22个ORF,其CDS区长度为 2 886 bp, 共编码961个氨基酸。对其编码蛋白的理化性质预测表明,AaPDEL分子量为114.38 kDa,化学式为C5069H7849N1397O1573S19,理论等电点为5.72,负电荷残基数均大于正电荷残基数,属于酸性蛋白;AaPDEH分子量为105.99 kDa,C4621H7387N1339O1452S33,其等电点为8.16,负电荷残基数均小于正电荷残基数,属于碱性蛋白;AaPDEL和AaPDEH总平均亲水性均小于0,脂肪系数均低于100,不稳定系数均大于40,表明AaPDEL和AaPDEH均属于亲水性不稳定蛋白。
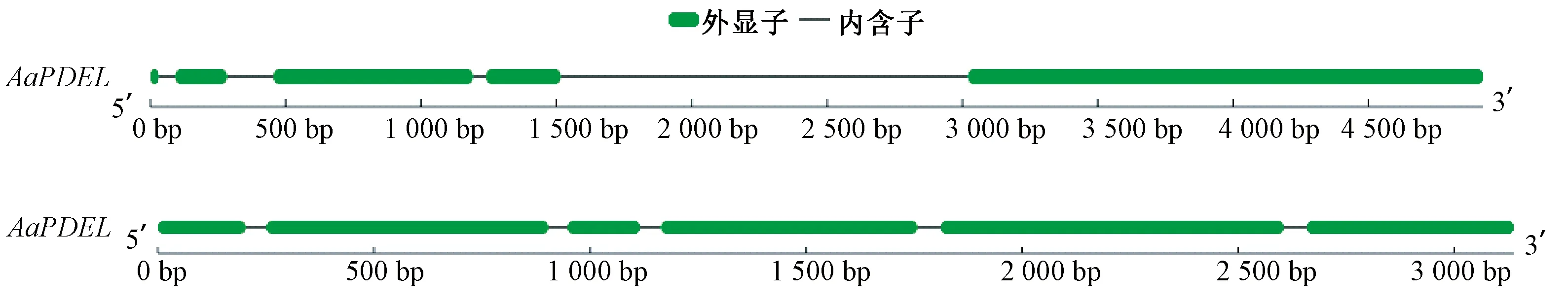
图2 AaPDEL和AaPDEH基因结构Fig.2 Genetic structures of AaPDEL and AaPDEH
2.2.2 同源序列比对和结构域分析 通过GENEDOC软件进行氨基酸同源序列比对分析发现,AaPDEL和AaPDEH分别具有Class Ⅱ PDE保守催化结构域H-x-H-L-D-H-[LIVM]-x-[GS]-[LIVMA]-[LIVM](2)-x-S-[AP]和Class Ⅰ PDE保守催化结构域H-D-[LIVMFY]-x-H-x-[AG]-x(2)-[NQ]-x-[LIVMFY](图3)。此外,通过SMART网站在线分析其氨基酸序列的结构域,并通过IBS1.0软件绘制AaPDEL和AaPDEL蛋白结构域,结果显示,AaPDEL在位于第251~第357氨基酸范围内具有翻译延长因子EF1G保守基序,AaPDEH在位于第358~第548氨基酸范围内含有一个保守的金属依赖性磷酸二酯酶“HD”基序(图4)。

图3 AaPDEL和AaPDEL同源序列比对Fig.3 Alignment of AaPDEL and AaPDEH homologous sequences
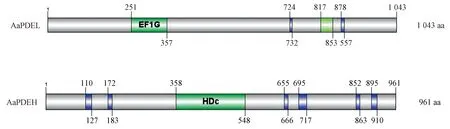
图4 AaPDEL和AaPDEL的结构域分析Fig.4 Domain analysis of AaPDEL and AaPDEH
2.2.3 系统进化树分析 利用NCBI Blast(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线工具检索AaPDEL和AaPDEH蛋白的同源序列,构建系统进化树(图5)。结果表明,AaPDEL和AaPDEH分别与小麦褐斑病菌(Pyrenophoratritici-repentis)和番茄匍柄霉(Stemphyliumlycopersici)基因聚于同一分支,亲缘关系最近,同源性分别高达79.25%和88.80%。
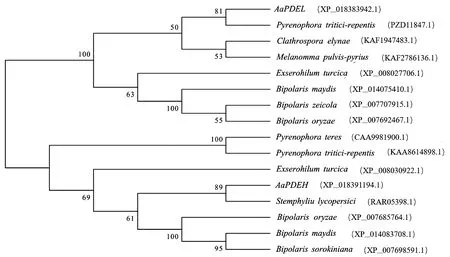
图5 AaPDEL和AaPDEH的系统进化树Fig.5 Phylogenetic tree of AaPDEL and AaPDEH
2.2.4 跨膜结构域、信号肽和亲/疏水性分析 利用TMHMM Serverv.2.0预测AaPDEL和AaPDEH的跨膜区域,结果显示,AaPDEL和AaPDEH均无跨膜区,属于非跨膜蛋白(图6-A、B)。利用SignalP 4.1 Server预测AaPDEL和AaPDEH为信号肽的可能性,其值为0.146 7和0.050 1,因此两个蛋白无信号肽,属于非分泌蛋白(图6-C、D)。利用ProtScale预测AaPDEL和AaPDEH的亲疏水性,发现整体上亲水性氨基酸均匀分布在整个肽链中,且平均分值大于疏水性氨基酸,初步推测AaPDEL和AaPDEH均为亲水性蛋白(图6-E、F)。

图6 AaPDEL和AaPDEH蛋白的跨膜结构域(A、B),信号肽(C、D)和亲疏水性(E、F)预测Fig.6 Prediction of transmembrane domains (A, B), signal peptides (C, D), and hydrophobicity predictions (E, F) of AaPDEL and AaPDEH proteins
2.2.5 二、三级结构预测 采用SOPMA软件预测AaPDEL和AaPDEH蛋白二级结构,如图7-A所示。AaPDEL和AaPDEH蛋白二级结构均由α-螺旋、β-折叠、无规则卷曲和延伸链组成,其中α-螺旋结构和无规则卷曲均是出现最多的结构,而β-折叠和延伸链出现比例均较小。利用在线工具SWISS-MODEL对AaPDEL和AaPDEH蛋白进行同源建模,得到三级结构图(图7-B)。
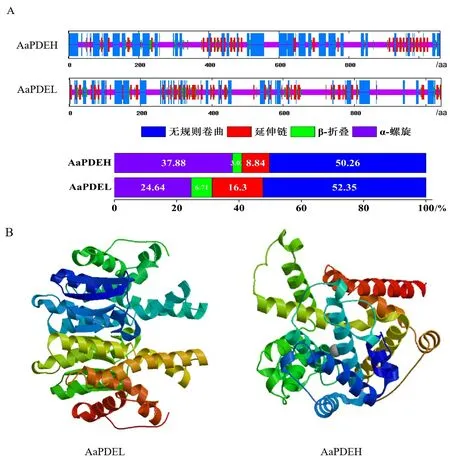
注:A和B分别是AaPDEL和AaPDEH的二、三级结构。Note: A and B are the secondary and tertiary structures of AaPDEL and AaPDEH, respectively.图7 AaPDEL和AaPDEH基因编码产物的二、三级结构Fig.7 AaPDEL and AaPDEH genes coding products of secondary and tertiary structure
2.2.6 亚细胞定位 成熟蛋白质仅在特定的细胞器里发挥稳定的生物学功能,因此,分析蛋白质的亚细胞定位有助于了解蛋白质的生物学功能。利用Softberry预测结果表明,AaPDEL主要定位于线粒体上,AaPDEH主要定位于细胞核上(表3)。
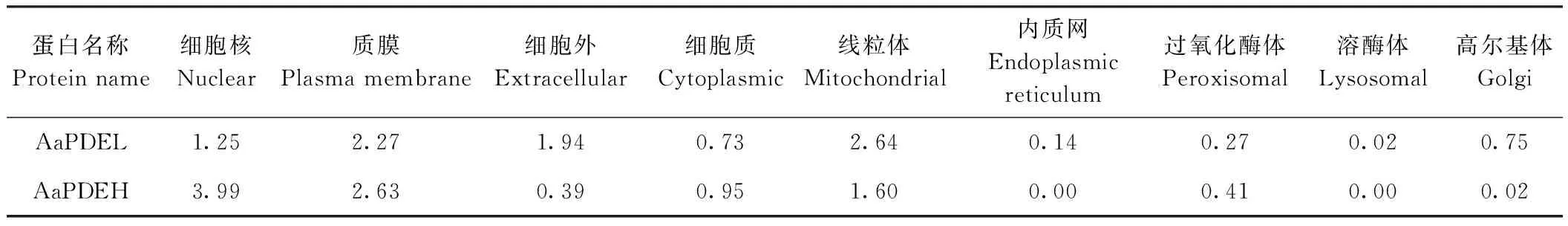
表3 AaPDEL和AaPDEH亚细胞定位预测Table 3 Prediction of AaPDEL and AaPDEH subcellular localization
2.2.7 磷酸化位点分析 利用NetPhos3.1 Server在线分析工具预测AaPDEL和AaPDEH中的磷酸化位点,结果发现,AaPDEL蛋白存在58个Ser磷酸化位点,32个Thr磷酸化位点和15个Tys磷酸化位点(图8-A);AaPDEH蛋白存在80个Ser磷酸化位点,36个Thr磷酸化位点和7个Tys磷酸化位点(图8-B)。
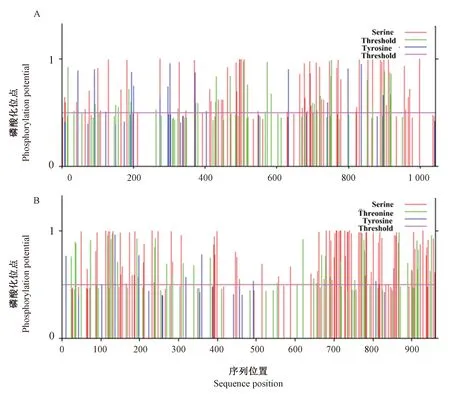
注:Ser:丝氨酸;Thr:苏氨酸;Tys:酪氨酸。Note: Ser:Serine. Thr:Threonine. Tys:Tyrosine.图8 AaPDEL(A)和AaPDEH(B)蛋白的磷酸位点分析Fig.8 Protein phosphorylation sites analysis of AaPDEL(A) and AaPDEH(B) proteins
2.3 AaPDEL和AaPDEH在疏水性诱导侵染分化中的表达分析
通过qRT-PCR发现AaPDEL和AaPDEH在A.alternata侵染结构分化过程中表达量存在差异(图9)。以萌发初级阶段(2 h)作为对照,AaPDEL表达量在芽管伸长阶段(4 h)低于对照,随后在附着胞形成阶段(6 h),以及侵染菌丝形成后期(8 h)均显著上调。AaPDEH表达量在侵染结构形成阶段持续显著上调。AaPDEL和AaPDEH基因在附着胞形成阶段(6 h)表达均出现了高峰,表达量较萌发初级阶段(2 h)分别上调了1.19和1.97倍。由此表明,AaPDEL和AaPDEH协同调控疏水诱导A.alternata附着胞和侵染菌丝的形成,以AaPDEH作用更为明显。
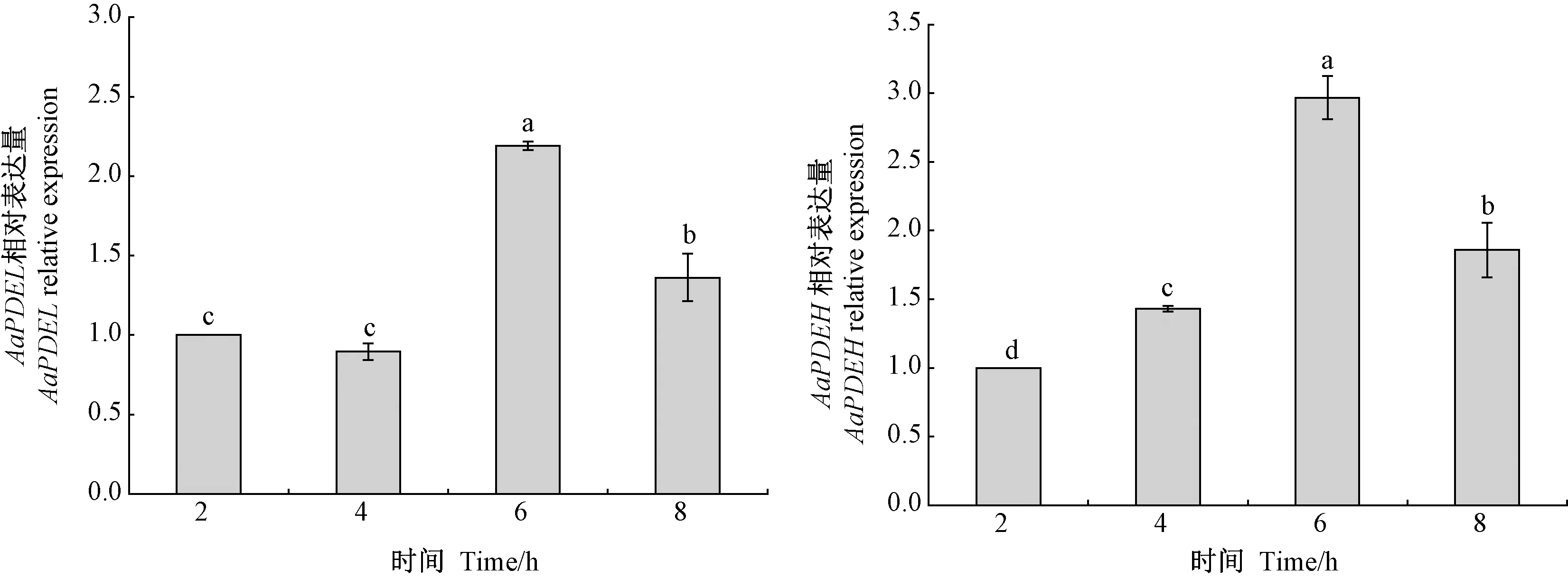
注:不同字母代表显著性差异(P<0.05)。Note: Different letters indicating significant differences at 0.05 level.图9 AaPDEL和AaPDEH基因在侵染结构分化中的表达量Fig.9 Expression of AaPDEL and AaPDEH genes in infection structure differentiation.
3 讨论
本研究通过蛋白结构域分析表明,AaPDEH具有典型的Class I PDE保守催化结构域和金属依赖性磷酸二酯酶“HD”基序;AaPDEL具有典型的Class Ⅱ PDE保守催化结构域,这与M.oryzae[26]、S.turcica[27]和柑橘褐斑病菌(A.alternata)[28]等的磷酸二酯酶分析结果类似。保守结构域是基因的核心,在生物进化或者一个蛋白家族中具有不变或相同的结构域,具有重要的功能。已有研究发现,存在于具有金属依赖性磷酸水解酶超家族中的HD结构域是调节磷酸二酯酶活性所必需的[29]。在M.oryzae中,高亲和力磷酸二酯酶的HD结构域能够修复MoPDEH缺失突变株在产孢量、孢子形态、亲水表面附着胞形成、毒力和胞内cAMP水平上的缺陷[30],这表明AaPDEH结构的保守性可能与功能之间存在必然联系。与ScPDEL[31]相比,AaPDEL多一个EF1G结构域,因此该蛋白在梨果黑斑病菌A.alternata中可能具有更复杂的生物学功能。
PDE作为G蛋白信号通路中重要的效应酶,一般在细胞内发挥作用。本研究通过生物学软件分析发现,梨果黑斑病菌中AaPDEL和AaPDEH在亚细胞定位上存在一定差异,分别位于线粒体和细胞核中。Ramanujam等[22]通过融合报告基因定位法发现定位于不同位置的MoPDEH和MoPDEL对调控cAMP水平以及致病性发挥不同的调控作用。因此,AaPDEL和AaPDEH的具体调控作用还需进一步验证。
宿主表面蜡质和疏水性是诱导部分植物病原真菌中侵染结构形成的重要刺激信号[32-33]。在小麦白粉菌(Blumeriagraminis)中,喷蜡的载玻片上需要有高疏水性表面才能诱导B.graminis孢子萌发和附着胞形成[34]。在玉米黑粉病菌(Ustilagomaydis)中疏水性表面能够诱导菌丝的扩展和附着胞形成[35]。本试验前期研究发现,A.alternata在梨果表皮上的侵染过程为孢子萌发形成芽管,芽管伸长、顶端膨大形成附着胞,部分附着胞进一步分化形成侵染菌丝,进而通过皮孔或表皮伤口侵入果实,而果实表皮疏水性与诱导A.alternata附着胞的形成呈正相关[36]。前人研究表明,许多植物病原真菌中附着胞的形成是成功侵入寄主的关键[37]。本研究利用人造疏水性表面诱导梨果黑斑病菌侵染结构分化发现,AaPDEL和AaPDEH基因均在附着胞形成阶段(6 h)上调表达,表明AaPDEL和AaPDEH参与了疏水介质诱导A.alternata附着胞形成的调控作用,这与申珅等[13]研究S.turcica中StL-PDE主要参与分生孢子发育,StH-PDE在附着胞发育过程中发挥重要作用的结果不一致,表明磷酸二酯酶PDEL和PDEH在不同真菌中的调控作用具有物种特异性。同时本研究发现在附着胞形成阶段,AaPDEH表达量高于AaPDEL,表明AaPDEH在附着孢形成阶段发挥更重要的调控作用,该结果与前人研究一致[38],在B.cinerea中,高亲和力磷酸二酯酶BcPDEH在生长、分化和毒力等方面的调控作用要比低亲和力磷酸二酯酶BcPDEL更明显。在M.oryzae中,MoPDEH在分生孢子萌发、附着胞和侵染菌丝形成阶段均上调表达,在调节cAMP水平和致病性方面起主导作用,而MoPDEL无明显功能[16]。综上,AaPDEL和AaPDEH均参与了疏水诱导A.alternata侵染结构分化的调控,其中AaPDEH的调控作用更明显,但其调控的分子机制尚需进一步揭示。
4 结论
本研究从梨果黑斑病菌克隆得到AaPDEL和AaPDEH基因,利用生物信息学分析了该基因编码蛋白保守结构域、信号肽、跨膜区结构以及亚细胞定位等。同时qRT-PCR分析表明,在疏水性诱导条件下,AaPDEL和AaPDEH在A.alternata附着胞形成时期上调表达,其中AaPDEH调控作用更为明显,表明AaPDE参与了梨果黑斑病菌侵染结构分化的调控。该结果为进一步通过分子水平揭示PDE基因的功能及其调控梨果黑斑病菌侵染结构分化的机制提供理论依据。

