CEP55基因沉默对非小细胞肺癌细胞恶性生物学行为的影响及机制
陈志平,邵东奇,毕明宏
1蚌埠医学院第一附属医院肿瘤内科,安徽蚌埠 233004;2蚌埠医学院第一附属医院神经外科
肺癌是世界范围内的主要死亡原因之一[1]。中心体蛋白55(CEP55)已被鉴定为肿瘤睾丸抗原和肿瘤相关抗原[2]。肿瘤睾丸抗原通常主要在睾丸中表达,但在癌症组织中也广泛表达[3]。我们前期研究通过TCGA官方数据库下载1 146例肺癌患者的基因表达数据,结果显示CEP55高表达。激活的PI3K/Akt/mTOR信号通路可介导多种细胞功能,包括血管生成、代谢、细胞活力、存活、蛋白质合成、转录和凋亡[4]。最近有文献报道CEP55参与促进肿瘤发生和调控PI3K/Akt/mTOR信号通路[5]。但CEP55在肺癌中的作用仍不清楚。2020年11月—2021年6月,本研究观察了沉默CEP55基因对肺癌细胞增殖、迁移及侵袭能力的影响,并探讨其可能的作用机制。现报告如下。
1 材料与方法
1.1 细胞、试剂及仪器 正常肺上皮细胞(BEAS-2B细胞)及NSCLC细胞(A549、H1299、H1975细胞)由蚌埠医学院科研中心实验室保存。细胞培养基RPMI-1640购自美国Hyclone公司,胎牛血清(FBS)购自碧云天生物技术有限公司。Lipofectamine2000转染试剂购自上海吉玛生物科技有限公司,MTT试剂购自广州赛库生物技术有限公司,基质胶(Matrigel)购自北京索莱宝科技有限公司,CEP55兔抗人多克隆抗体购自美国Affinity公司,HRP标记山羊抗兔IgG抗体购自美国Affinity公司,Transwell小室购自江苏凯基生物技术有限公司。β-肌动蛋白(βactin)、蛋白激酶B(Akt)、磷酸化蛋白激酶B(p-Akt)、哺乳动物雷帕霉素靶蛋白(mTOR)、磷酸化哺乳动物雷帕霉素靶蛋白(p-mTOR)一抗均购自Abbkine科技有限公司。CEP55 siRNA购自上海吉玛生物科技有限公司。恒温培养箱购于中国上海海塞飞尔科技有限公司,恒温磁力搅拌器购于中国上海硕光司乐仪器有限公司,倒置显微镜购于日本Olympus公司,Synergy多功能酶标仪购于美国Biotek公司,电泳槽、转膜槽、电泳仪均购于美国Bio-Rad公司。
1.2 细胞培养 NSCLC细胞A549在含10%FBS、1%青链霉素的RPMI-1640培养基、37℃、5%CO2的培养箱中培养。显微镜下观察细胞状态及密度,待细胞密度达到85%时进行细胞传代培养。
1.3 细胞分组及转染 实验分为control组(只转染Lipofectamine2000)、si-NC组(转染Lipofectamine2000和NC序列)、si-CEP55组(转染Lipofectamine2000、si-CEP55序列)。转染前1 d,取增殖期A549细胞5×105个/孔接种于6孔板上,当细胞密度铺满瓶底80%左右时弃培养皿内的液体,用PBS洗涤2次,更换新配制的不含血清及抗生素的RPMI-1640培养基培养2 h;取适量的si-CEP55与Lipofectamine2000各加入250μL不含血清及抗生素的RPMI-1640培养基中,使用移液器缓慢吹打混匀,常温放置10 min;将上述si-CEP55与Lipofectamine2000各250μL稀释液混匀,室温孵育20 min;用无血清RPMI-1640培养基漂洗细胞2次,将孵育好的混合液500μL转移至6孔板中,轻轻摇匀,使其覆盖整个皿底;37℃、5%CO2细胞培养箱中孵育6 h,更换含10%FBS的RPMI-1640培养基(不含抗生素),继续培养24 h,收集细胞用于后续实验。
1.4 细胞增殖能力检测 采用MTT法。收集对数期各组细胞,调整细胞悬液浓度,接种至96孔板内,每孔100μL细胞悬液,使待测细胞密度为5×103个/孔,37℃、5%CO2的培养箱中分别培养24、48、72 h后,每孔加入MTT溶液15μL,继续培养4 h;终止培养,吸去96孔板内上清液,每孔加入DMSO溶液150μL,37℃恒温箱孵育30 min,使结晶充分溶解,在酶标仪上490 nm处测各孔的光密度(OD)值,记录结果,以时间为横坐标,吸光值为纵坐标,绘制生长曲线。并以OD490值表示细胞增殖能力。
1.5 细胞侵袭能力检测 采用Transwell侵袭实验。用无血清培养基将提前1 d融化好的Matrigel稀释至终浓度1 mg/mL,冰上操作;在Transwell小室上室底部中央垂直加入100μL的Matrigel(终浓度为1 mg/mL),37℃温育4~5 h使其干成胶状,待Matrigel干成胶状后,取各组细胞以2×104个/mL加入Transwell小室,上室加入新鲜无血清RPMI-1640培养基100μL,下室加入含有10%FBS的RPMI-1640培养基600μL,培养48 h后下室用多聚甲醛固定15 min,结晶紫染色10 min;显微镜下观察,随机选取5个高倍(200倍)视野,计算侵袭细胞数。
1.6 细胞迁移能力检测 Transwell迁移实验。取各组A549细胞以2×104个/mL加入Transwell小室,上室加入新鲜无血清RPMI-1640培养基100μL,下室加入含有10%FBS的RPMI-1640培养基600μL,养48 h后下室用多聚甲醛固定15 min,结晶紫染色10 min;显微镜下观察,随机选取5个高倍(200倍)视野,计算迁移细胞数。
1.7 细胞内CEP55、p-Akt、p-mTOR蛋白相对表达量检测 采用Western blotting法。将转染48 h的各组细胞加入预冷的RIPA裂解液提取总蛋白,BCA法测定蛋白浓度;加入蛋白上样缓冲液,调整蛋白为相同浓度,95℃煮沸5 min使蛋白变性;10%SDS-PAGE分离蛋白,分离后的蛋白转移至PVDF膜,5%脱脂奶封闭2 h;一抗(CEP55、β-actin、Akt、p-Akt、mTOR和p-mTOR)按1∶1 000稀释,4℃摇床孵育过夜,二抗1∶5 000稀释,摇床孵育2 h;ECL发光,暗室曝光拍照,以Image J软件分析目的蛋白条带灰度值,β-actin为内参,以二者条带灰度值比值为蛋白的相对表达量。
1.8 统计学方法 采用SPSS21.0统计软件。所有实验重复3次。符合正态分布的计量资料用±s表示,多组比较采用方差分析方法,进一步两两比较采用SNK-q法。P<0.05为差异有统计学意义。
2 结果
2.1 CEP55在NSCLC细胞中的表达 BEAS-2B、A549、H1975、H1299细胞中CEP55蛋白表达分别为0.18±0.01、0.52±0.05、0.36±0.02,0.39±0.03。与BEAS-2B细胞比较,A549、H1975、H1299细胞中CEP55蛋白相对表达量高(P均<0.05),且A549细胞中CEP55蛋白相对表达量最高(P均<0.05),选择A549细胞进行后续实验。
2.2 si-CEP55沉默效率 si-NC组、control组、si-CEP55组CEP55蛋白相对表达量分别为0.95±0.04、0.99±0.03、0.34±0.02。与si-NC组、control组比较,si-CEP55组CEP55蛋白相对表达量低(P均<0.05)。
2.3 沉默CEP55基因对A549细胞增殖能力的影响 与si-NC组、control组比较,si-CEP55组培养24、48、72 h的OD490值低(P均<0.05)。见表1。
表1 三组细胞增殖能力(±s)
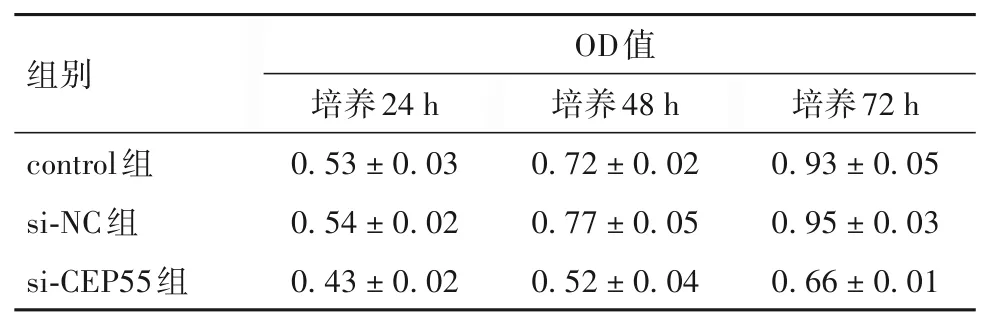
表1 三组细胞增殖能力(±s)
?
2.4 沉默CEP55基因对A549细胞侵袭能力的影响 si-NC组、control组、si-CEP55组侵袭细胞数分别为(136±15)、(130±14)、(38±6)个。与si-NC组、control组比较,si-CEP55组侵袭细胞数少(P均<0.05)。
2.5 沉默CEP55基因对A549细胞迁移能力的影响 si-NC组、control组、si-CEP55组迁移细胞数分别为(161±23)、(156±20)、(54±8)个。与si-NC组、control组比较,si-CEP55组迁移细胞数少(P均<0.05)。
2.6 沉默CEP55基因对PI3K/AKT/mTOR信号通路的影响 与si-NC组、control组比较,si-CEP55组细胞中p-Akt、p-mTOR蛋白表达低(P均<0.05)。见表2。
表2 三组p-Akt、p-mTOR蛋白相对表达量(±s)
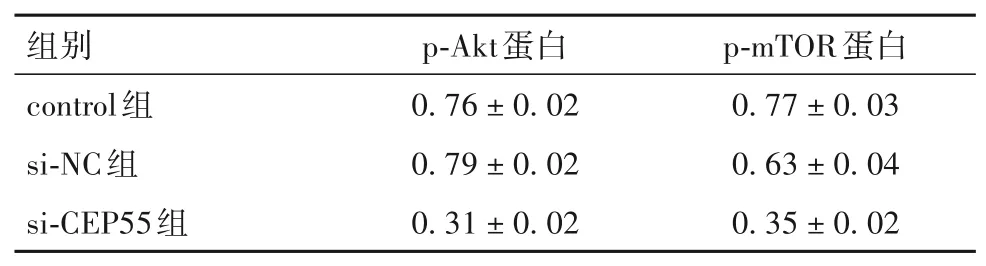
表2 三组p-Akt、p-mTOR蛋白相对表达量(±s)
?
3 讨论
NSCLC作为肺癌的一种主要类型,占所有肺癌的80%以上。多年来,肺癌的治疗策略主要包括手术、化疗和放疗。尽管这些传统疗法取得了进展,但患者病死率仍然很高,5年生存率仅为15%[6]。近年发现的几个关键驱动基因突变,包括EGFR、KRAS和ALK,开启了认识肺癌的新纪元,并推动了靶向治疗的发展[7]。分子靶向治疗目前已经广泛应用于肺癌的治疗,与传统化疗相比,有较高的疗效和较低的毒性。然而,由于大多数肺癌在初始阶段没有症状,诊断时多为晚期,导致整体预后仍然较差。因此,全面了解肺癌进展的分子机制,寻找特定的肿瘤基因和治疗靶点,将有助于提高抗肿瘤治疗的疗效,为癌症患者提供更精确的个体化治疗,从而提高肺癌的总体生存率。
中心体蛋白长期以来被认为是调节有丝分裂纺锤体和微管组织的支架蛋白,在细胞周期过程中起重要作用[8]。CEP55也被称为FLJ10540和C10orf3,在整个细胞周期中位于中心体,在有丝分裂时位于纺锤体中,在胞质分裂过程中位于中体[9]。胞质分裂在细胞分裂过程中受到严格控制,需要多组分亚基以CEP55依赖的方式向中体招募[10]。CEP55是脱落的关键成分,在细胞质分裂的最后阶段负责调节两个子细胞的物理分离[11]。鉴于CEP55在细胞周期中的重要作用,激励我们开始探索该基因和肺癌的潜在相关性。有研究发现,CEP55在多种癌症组织中过表达,比如上皮卵巢癌[12]和肝癌[13]。也有证据表明,CEP55的上调与多种恶性肿瘤的发生发展有关,包括乳腺癌、甲状腺癌、肺癌[14-16]。这些发现证明CEP55在多种肿瘤发生发展中起重要作用。在本研究中,我们证实CEP55在肺癌组织和细胞系中同样高表达,这一发现为后续实验提供了理论基础。
据文献报道,高增殖活性可增加肿瘤进展的风险[17]。研究发现,CEP55参与甲状腺癌、乳腺癌[18]以及前列腺癌[19]的细胞增殖,提示CEP55过表达可能促进肿瘤细胞生长。而敲除CEP55可显著抑制肿瘤细胞的存活和增殖,甚至导致肿瘤细胞死亡[20-21]。与本研究结果一致,沉默CEP55基因可抑制A549细胞增殖、迁移及侵袭。
PI3K/Akt/mTOR信号通路受到多步骤严格控制。Akt在细胞存活、细胞周期、血管生成、蛋白质合成和代谢中发挥多种作用[22]。mTOR是Akt的底物,Akt可以激活下游mTOR通路,同时被下游的mTOR反馈调节。CEP55直接与PI3K催化亚基PIK3CA(也称为p110)相互作用,并促进其稳定性和活化[23]。据文献报道,在肾细胞癌中,敲低CEP55的表达能够显著抑制PI3K/Akt/mTOR通路的激活[24];这些研究表明CEP55在调节PI3K/Akt/mTOR信号通路中发挥重要作用。本研究结果显示,抑制NSCLC细胞株A549细胞中的CEP55表达同样导致PI3K/Akt/mTOR信号通路活性下调,p-Akt和p-mTOR蛋白表达降低。当然,本研究仅从体外实验探讨CEP55在NSCLC肿瘤发生中的作用机制,还有待更多的体内实验进行进一步的验证。
综上所述,CEP55在肺癌中高表达,抑制其表达显著抑制肺癌细胞的增殖、迁移及侵袭。这些可能与CEP55在NSCLC中通过激活PI3K/Akt/mTOR信号通路来促进肿瘤细胞的增殖、迁移及侵袭有关。提示CEP55可能是肺癌治疗的一个潜在靶点。

