血浆miR-195对早期急性心肌梗死的诊断价值及可能机制的生物信息学分析
张淑华,陈延宇,刘燕锋,王云霞,姚宇迪,吴志勇
1江西省人民医院(南昌医学院第一附属医院)心血管病研究所,南昌 330006;2南昌大学医学院;3南昌大学第一附属医院高新医院中心实验室
急性心肌梗死(AMI)是全球病死率较高的疾病之一,准确的早期诊断和及时的血运重建可以修复缺血心肌,降低病死率,改善患者预后。一直以来,心肌肌钙蛋白I(cTnI)被认为是临床诊断AMI的“金标准”,可用于早期诊断AMI,从而提高治疗效果[1]。然而,在AMI患者中,cTnI水平最早在胸痛发作3.5 h后升高,在血液中能被检测到升高的时间相对“延迟”。而且非AMI患者如不稳定型心绞痛、主动脉夹层、肺栓塞、终末期肾功能不全、心肌炎、心力衰竭等,cTnI水平可非特异度升高[2]。非编码微小RNA(miRNA)广泛存在于各个进化阶段的生物体中,具有高度的保守性、时序性和组织特异度。miRNA在心肌高表达或特异表达参与心脏发育、心律失常、心肌肥厚及心力衰竭等多种心脏生理和病理过程[3]。此外,生物信息学可有效筛选与预测疾病的关键基因。为此,本研究欲探讨miR-195在AMI患者血浆中的表达变化,并结合生物信息学评价其临床应用价值。
1 资料与方法
1.1 临床资料 选取2020年6月—12月在江西省人民医院心内科住院治疗的AMI患者100例(AMI组),男68例、女32例,年龄41~61岁。纳入标准:符合中华医学会心血管病学分会制定的AMI诊断标准[4],并均在症状出现24 h内入院,无心肌梗死或经皮冠状动脉介入史。排除标准:合并血液系统疾病、急性或慢性感染性疾病、严重肝肾功能不全、瓣膜性心脏病、周围血管性疾病、肿瘤等疾病。另同期选择门诊体检健康的60例志愿者为对照组,排除心脑血管疾病,男39例、女21例,年龄44~62岁。两组年龄、性别比较差异无统计学意义(P均>0.05)。本研究经江西省人民医院医学伦理委员会批准(2018026),受试对象均签署知情同意书。
1.2 血液标本采集 采集AMI组胸痛4~6 h、>6~8 h、>8 h及对照组体检当日晨外周静脉血5 mL,置于乙二胺四乙酸二钠抗凝管中,4℃下2 000 r/min(半径10 cm)离心10 min,收集血浆,置于-80℃储存备用。
1.3 血浆cTnI检测 采用固相免疫层析法检测受试者血浆cTnI,以0.5 ng/mL为检测临界值,试剂盒购自中生北控生物科技股份有限公司。
1.4 血浆miR-195表达检测 按照miRNeasy kit试剂盒说明书(No217184,Qiagen)提取血浆标本总RNA,用NanoDrop2000超微量分光光度计(美国Thermo Fish Scientific公司)测定RNA样品的浓度和纯度。采用Taqman miRNA荧光定量聚合酶链反应(PCR)试剂盒(美国ABI公司)及miRNA特异度茎环结构引物进行反转录—实时定量PCR,选择人工合成的线虫cel-miR-39作为外源性参照,在ABI7500型荧光定量PCR仪(美国ABI公司)上进行PCP扩增。miR-195上游引物5'-GATAGCAGCACAGCAATATTAGC-3'、下游引物5'-CAGTCCGTGTCGTAGAGT-3';cel-miR-39上游引物5'-GACTTCATCCGGGTGTAAATC-3':下 游 引 物5'-TATCGTTCTCCACTCCTTCAC-3'。反应条件:95℃5 min,95℃15 s、60℃60 s循环40次。每个样本重复实验3次,取平均Ct值。同时以不含RNA模板的ddH2O作为阴性对照。用2-ΔΔCt法计算miR-195相对表达量。
1.5 miR-195靶基因与AMI相关基因匹配及筛选 运用miRDB和miRWalk两个miRNA靶基因预测数据库分别获得miR-195的靶基因1 419和7 684个。同时在Geencards数据库以“acute myocardial infarction”为关键词检索获得1 544个相关基因。通过Venny2.1.0对上述三个数据库中的基因集进行交集处理,初步获得70个miR-195可能作用于AMI的潜在靶基因。使用DAVID Bioinformatics Resources 6.8将已获得的70个交集基因取交集进行基因本体数据库(GO)富集和京都基因与基因组百科全书(KEGG)通路分析,Cytoscape3.7.2软件对主要交集基因—信号通路进行可视化分析。
1.6 统计学方法 采用SPSS20.0统计软件。服从正态分布的计量资料用±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。采用受试者特征曲线分析血浆miR-195对AMI的诊断效能。P<0.05为差异有统计学意义。
2 结果
2.1 AMI组不同时点与对照组血浆miR-195相对表达量、cTnI比较 见表1。
表1 AMI组不同时点与对照组血浆miR-195相对表达量、cTnI比较(±s)

表1 AMI组不同时点与对照组血浆miR-195相对表达量、cTnI比较(±s)
注:与对照组比较,△P<0.05;与胸痛4~6 h AMI组比较,#P<0.05。
?
2.2 血浆miR-195联合cTnI对AMI的诊断效能 miR-195对AMI诊断的曲线下面积为0.94,最佳截断值为0.85,敏感度为90.0%,特异度为94.7%;cTnI对AMI诊断的曲线下面积为0.86,最佳截断值为0.54 ng/mL,敏感度为85.0%,特异度为68.4%;miR-195联合cTnI对AMI诊断的曲线下面积为0.96,敏感度为91.0%,特异度为93.0%。
2.3 miR-195与AMI相关的基因 初步获得70个miR-195可能作用于AMI的潜在靶基因。为确保通路的正确性,仅将每种富集结果中评分排名前三的通路纳入分析范围,结果显示miR-195可能通过影响心肌细胞凋亡的负向调控通路(GO:0043066)参与AMI的 发 生 发 展,BCL-2、MAPK8、RAF1、IGF1、NOTCH2、IKBKB、PTEN、VEGFA、PDCD1、CCND2等10个基因富集于该通路。见图1。
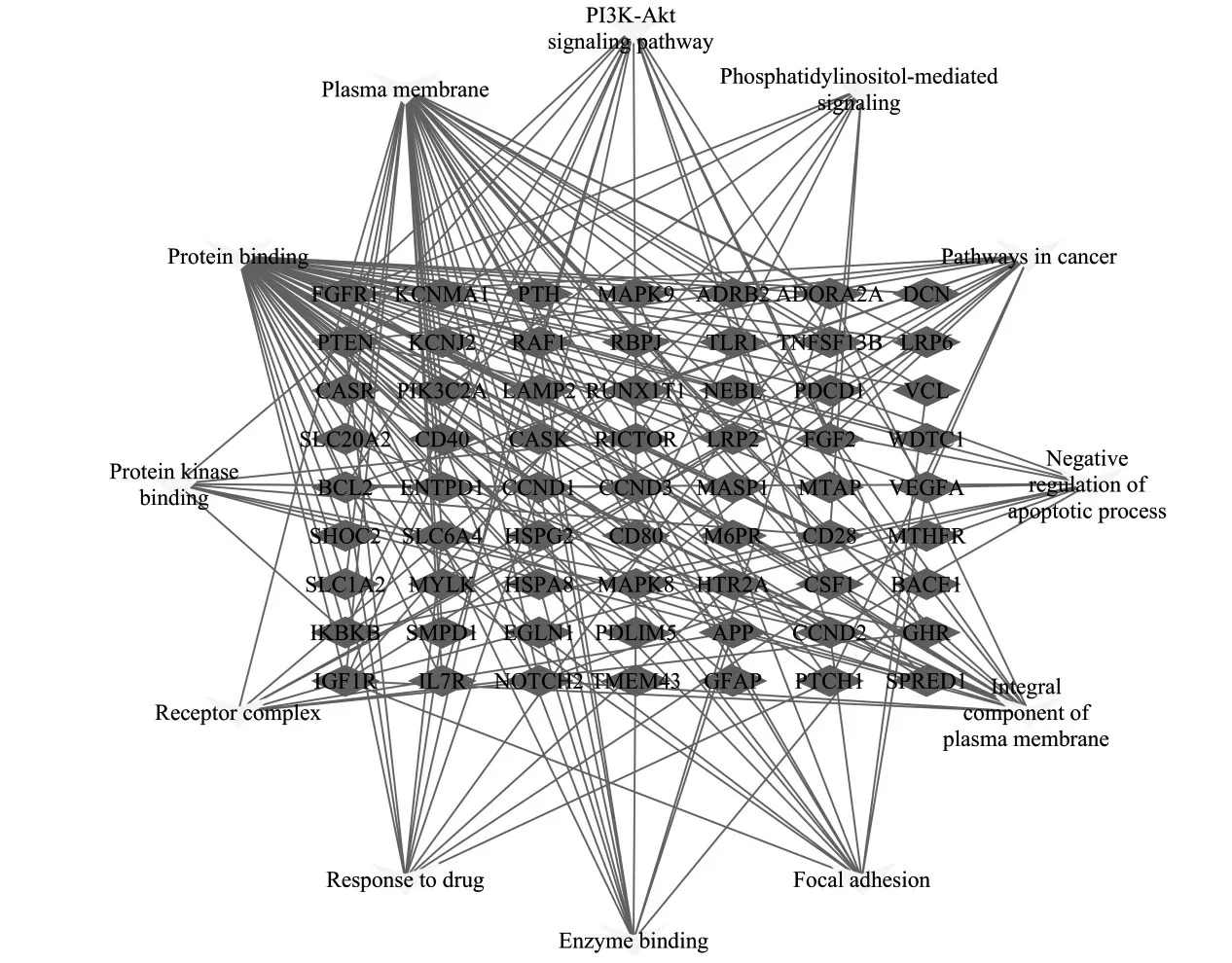
图1 miR-195与AMI相关交集基因—主要信号通路网络图
3 讨论
miRNA通过诱导靶基因mRNA降解或抑制蛋白质翻译控制基因转录后表达,从而发挥生物学功能。miRNA在心肌梗死、缺血性心肌病、心力衰竭、动脉粥样硬化等心血管疾病中具有重要作用[3]。这些潜在作用改变了我们以往对心血管疾病的认知,并为疾病的预测、诊断及治疗提供了新策略。
AMI发病迅速、致死率极高,及时有效地诊断与治疗是降低病死率、改善预后的关键。cTnI是心肌特有的结构蛋白,对心肌损伤有较高的敏感度和特异度,也是目前临床诊断AMI常用的指标。研究表明,cTnI仅存在于心肌细胞中,主要与肌原纤维结合,当心肌细胞损伤时从心肌纤维上降解下来释放到血液中,因此,血清中cTnI的水平升高可反映心肌细胞受损[2]。
miRNA主要是与胞质中的蛋白质复合物结合,当细胞损伤时,miRNA能以更快的速度释放到血液中,并可在一定时间内稳定存在于循环体液中。这奠定了miRNA作为早期AMI生物标志物的基础。基于循环miRNA高稳定性及不易被降解的优势,多种循环miRNA已被报道在AMI早期表达失调,且早于传统生物标志物CK和cTnI等[5-6]。研究显示,AMI患者血浆miR-195表达在胸痛发作后8、12 h均升高[7]。然而,该研究样本量少,且未能检测到胸痛发作后更短时间内miR-195的变化。本研究纳入100例AMI患者,结果显示患者胸痛发生4 h血浆中即可检测到miR-195相对表达量升高,且随着胸痛时间的增加,miR-195表达有增加趋势。miR-195联合cTnI诊断AMI的敏感度及特异度分别为91.0%、93.0%,均高于cTnI,提示循环miR-195联合应用于诊断AMI,可有效提高cTnI的诊断效能。
miR-195是miR-15a/15b/16/195/497家族中的重要一员,人miR-195基因定位于染色体17p13.1区域,距离抑癌基因p53仅650 kb,该区域常发生杂合性缺失。其在肿瘤发生发展、细胞增殖凋亡、侵袭迁移、耐药形成及预后等多方面发挥重要作用[8]。Bcl-2及RAF1是miR-195的代表性靶点[9]。本研究分析获得70个miR-195靶向AMI的潜在靶基因,通过GO功能和KEGG通路分析发现,miR-195可能通过影响细胞凋亡的负向调控通路进而影响AMI。富集于凋亡负向调控通路的靶基因有Bcl-2、MAPK8、RAF1、IGF1、NOTCH2、IKBKB、PTEN、VEGFA、PDCD1、CCND2,这些基因曾被报道参与了AMI中心肌细胞凋亡[10-14]。
综上所述,在AMI早期血浆miR-195表达升高,miR-195的作用机制主要与心肌细胞凋亡相关。这也提示miR-195不仅可作为心肌梗死早期诊断的生物标志物,且有望成为AMI治疗的潜在靶点或预后的评价指标。

