大肠杆菌细胞膜固定相萃取辣木籽抗菌肽
和 丽,许映月,陈凤敏,黄艾祥,王雪峰,2
(1.云南农业大学 食品科学技术学院,昆明 650201; 2.云南省畜产品加工工程技术研究中心,昆明 650201)
抗菌肽(Antimicrobial peptides,AMPs),又称肽类抗生素(peptide antibiotics),是一类具有广谱抗菌活性的小分子肽,一般含5~100个氨基酸[1-2]。抗菌肽的作用机制不同于抗生素,不产生耐药性,能够替代传统抗生素,是近年来国内外的研究热点[3-5]。目前,对抗菌肽筛选、分离的方法有超滤法[6]、凝胶色谱层析法[7-8]、高效液相色谱法[9]等。抗菌肽的筛选、分离较为复杂,往往需要几种方法结合使用。贺浪冲等[10]首次报道了细胞膜色谱法,该方法是将具有活性的细胞膜固定在硅胶载体表面,形成载体细胞,将液相色谱、细胞生物学与受体药理学相结合形成一种能模仿药物与靶体相互作用的色谱系统[11]。细胞膜色谱法借助大孔硅胶的刚性作用和细菌的细胞膜,更加真实地模拟了细胞膜结构。Hou[12]、Wang[13]等将细胞膜色谱法进行推广并成功运用到中药资源活性物质的筛选,带动了该技术的发展。肖建辉[14]利用细胞膜色谱技术从麻疯树籽粕中有效分离出JCpep7和JCpep8;唐亚丽[15]同样利用此技术从家蝇中分离筛选出了MDpep5和MDpep9。因此,细胞膜色谱法有望成为一种快速、有效的抗菌肽筛选方法。
辣木(Moringaoleifera)为云南特色植物资源,辣木籽富含多种营养物质,具有营养保健作用,但目前对于辣木籽抗菌肽的研究报道较少。本文对大肠杆菌进行超声破壁,利用大肠杆菌细胞膜与大孔硅胶进行吸附制备细胞膜固定相,采用大肠杆菌细胞膜固定相联合反相-高效液相色谱(RP-HPLC)筛选辣木籽抗菌肽,研究萃取前后抑菌活性变化并明确RP-HPLC差异峰,为后续抗菌肽的靶向筛选提供依据。
1 材料与方法
1.1 实验材料
辣木籽,云南天佑科技开发有限公司;氯化钠、盐酸、氢氧化钠、磷酸氢二钠、磷酸二氢钠,均为分析纯,天津市风船化学试剂科技有限公司;牛血清白蛋白、乙腈、甲醇,均为色谱纯,德国默克股份两合公司;三羟甲基氨基甲烷、LB肉汤培养基,Sigma公司;考马斯亮蓝G-250,上海康朗生物科技有限公司;大孔硅胶,分析级,苏州赛分科技股份有限公司;大肠杆菌CICC10003、金黄色葡萄球菌CICC10384,中国工业菌种保藏中心。
Agilent 1200型高效液相色谱仪,安捷伦公司;UV-1800CP型紫外分光光度计,上海美谱达仪器有限公司;SCQ-92018数控加热超声波清洗机,上海声彦超声波仪器有限公司;HH-6数显恒温水浴锅,国华电器有限公司;CP153电子天平,奥豪斯仪器有限公司;DT5-2离心机,上海安亭科学仪器厂;HI99161pH 计,意大利哈纳仪器有限公司;Eclipse E200型显微镜,上海奋业光电仪器设备有限公司。
1.2 实验方法
1.2.1 辣木籽蛋白的提取
参考王雪峰等[16]的方法,稍作修改。辣木籽脱脂粕→0.3 mol/L的NaCl溶液溶解(料液比1∶10)→用0.1 mol/L NaOH调节pH至7.15→电动搅拌仪搅拌30 min→抽滤,去除残渣,收集滤液→50℃浓缩至总体积的1/3→真空冷冻干燥→辣木籽蛋白粉→-20℃保存备用。
1.2.2 辣木籽多肽的制备
参考王雪峰等[16]的方法,稍作修改。辣木籽蛋白粉→纯水溶解混匀(料液比1∶30)→加入5.5%碱性蛋白酶于55℃水浴酶解4.5 h→沸水浴灭酶10 min→离心(5 000 r/min,15 min)→收集上清液→超滤截留(3 kDa)→收集滤液透析6~12 h(透析袋分子质量100~500 Da)→真空冷冻干燥→辣木籽多肽→-20℃保存备用。
1.2.3 大肠杆菌细胞膜(E.colicell membrane,ECM)的制备
参考杨文博[17]的方法并进行适当调整。取大肠杆菌活化至对数期后用生理盐水离心洗涤3次。取沉淀悬浮于50 mmol/L、pH 7.2的Tris-HCl溶液中,取菌体悬浮液于反应管中,于4℃以一定超声功率超声破碎一定时间(每次超声时间9 s,间隔时间6 s),在显微镜下观察其形态,破碎到一定程度后离心(3 000 r/min,10 min),取上清液,并于4℃下离心(10 000 r/min,20 min),取沉淀加入1 mg DNA酶后用Tris-HCl重悬,37℃培养1 h后以4 500 r/min离心10 min,收集上层液体,将上层液体以10 000 r/min 离心10 min,取沉淀用Tris-HCl缓冲溶液洗涤3次,即得大肠杆菌细胞膜。
参照康洁[18]的方法并做适当调整,采用显微镜检测法和番红溶液染色法对细胞形态进行观察。吸取少量破壁后的菌液用番红溶液染色,1 min后用清水清洗,用酒精灯烘干,通过显微镜观察比较细胞内容物的渗出情况,确定其破壁效果。
1.2.4 大肠杆菌细胞膜固定相(ECMSP)的制备
参照李连连[19]的方法并进行调整对大孔硅胶载体进行活化。取1 g大孔硅胶加到200 mL 1 mol/L的HCl溶液中,50 Hz条件下超声15 min,搅拌回流2 h后,重复洗涤至上清液pH 中性,滤纸过滤,将大孔硅胶于120℃下活化7 h,大孔硅胶需要制备现用。
参考肖建辉[14]的方法并进行适当调整制备ECMSP。取等量活化后的大孔硅胶与150 μg/mL ECM悬液混匀→4℃下振荡吸附12 h→50 Hz条件下超声研磨20 min→加入适量去离子水离心(4 000 r/min,20 min)→取沉淀洗涤获得ECMSP。
1.2.5 ECMSP性质分析
1.2.5.1 ECM吸附等温线的绘制
参考Bilgili[20]的方法并进行适当修改绘制ECM吸附等温线。取等量活化后的大孔硅胶和不同质量浓度的ECM悬液混匀,在4℃、150 r/min条件下振摇12 h,再加入等体积的纯水,于50 Hz超声20 min并离心。采用考马斯亮蓝法测定初始ECM悬液中蛋白质的质量浓度和上清液中ECM蛋白质的质量浓度,并计算单位质量的大孔硅胶吸附的ECM的蛋白质质量。以单位质量的大孔硅胶吸附的ECM的蛋白质质量为纵坐标,初始ECM悬液中的蛋白质质量浓度为横坐标,绘制吸附等温线。根据实验结果,对上述方程进行线性回归,按Langmuir吸附等温线方程1/Cs=(1+K*Cm)/(CsmaxK*Cm)=1/(CsmaxK*Cm)+1/Csmax(Cs为单位质量大孔硅胶吸附的ECM的蛋白质质量,μg/mg;Cm为初始ECM悬液中蛋白质质量浓度,μg/mL;Csmax为单位质量大孔硅胶吸附的ECM的最大蛋白质质量,μg/mg;K*为吸附常数,μg/mL),计算得到大孔硅胶表面ECM的饱和吸附值和吸附常数。
1.2.5.2 蛋白质含量的测定[16]
采用考马斯亮蓝法测定蛋白质含量。蛋白质标准溶液:称取11.3 mg牛血清白蛋白,用0.9%的NaCl定容至1 mL,制成11.3 mg/mL的标准储备溶液,再逐级稀释,得到系列质量浓度的蛋白质标准溶液。考马斯亮蓝G-250(0.01%)染液:称取0.1 g考马斯亮蓝G-250,溶于50 mL 90%乙醇中,加入100 mL 0.85 g/mL的磷酸后用蒸馏水定容至1 000 mL。标准曲线的绘制:取7支10 mL具塞试管,分别进行1~7编号后,依次加入1 mL不同质量浓度的蛋白质标准溶液和5 mL考马斯亮蓝G-250染液,盖塞后混匀,于595 nm波长处测定吸光值,以0.9%的NaCl代替蛋白质标准溶液作空白对照,以蛋白质标准溶液质量浓度为横坐标,595 nm波长处吸光值为纵坐标,绘制标准曲线,得到标准曲线方程为y=0.064 7x+0.034 9(R2=0.999 6)。
取1 mL ECM悬液或滤液于10 mL试管中,加入5 mL考马斯亮蓝G-250染液,混匀,室温静置5 min后测定其在595 nm处的吸光值,空白组用蒸馏水代替ECM悬液或滤液,再根据标准曲线方程得到初始ECM悬液及滤液ECM上的蛋白质含量。
1.2.5.3 ECMSP的表面特征观察
取适量固定相或载体硅胶于载玻片上,用番红染色,1 min后用清水清洗,用酒精灯烘干后在显微镜下观察其表面特征。
1.2.6 ECMSP对辣木籽抗菌肽的萃取
以ECMSP作为细胞膜色谱法的固定相。配制质量浓度0.5 mg/mL的辣木籽多肽,将等量的辣木籽多肽和ECMSP加到反应管中,于37℃下振荡反应1 h后用0.22 μm的微孔滤膜过滤,收集滤液,并将滤出物用PBS缓冲液(50 mmol/L,pH 7.2)洗涤3次,合并所有滤液,对抗菌肽萃取前后RP-HPLC差异峰及其抑菌活力变化进行分析。
1.2.7 辣木籽抗菌肽的抑菌率测定
参考唐文婷[21]的方法测定抑菌率。将金黄色葡萄球菌和大肠杆菌培养至对数期,离心收集菌体沉淀,用PBS洗涤3次后重悬至105CFU/mL。取50 μL经倍比稀释后的抗菌肽母液、100 μL待测菌液和100 μL灭菌后的LB肉汤培养基混匀,在37℃培养12 h,用酶标仪在600 nm下测定吸光值,以PBS缓冲液作为对照组。抑菌率(Y)按式(1)计算。
Y=(A0-A)/A0×100%
(1)
式中:A为样品的吸光值,A0为对照的吸光值。
1.2.8 辣木籽抗菌肽RP-HPLC测定
RP-HPLC条件:Amethyst C18色谱柱(250 mm×4.6 mm,5 μm);进样量10 μL;柱温45℃;流速0.5 mL/min;检测波长215 nm;流动相A相为体积分数0.1%的三氟乙酸乙腈溶液,B相为体积分数0.1%的三氟乙酸水溶液;梯度洗脱条件如表1所示。

表1 流动相的梯度洗脱条件
1.2.9 数据分析
所有实验均进行3次,采用Excel 2010、IBM SPSS Statistics 25对数据进行统计分析。
2 结果与分析
2.1 超声破壁参数的选择
2.1.1 超声功率对大肠杆菌破壁效果的影响
按1.2.3方法,将一定量的菌体悬浮液置于反应管中,设定每次超声时间9 s、间隔时间6 s,固定超声时间为25 min,考察超声功率(0、200、300、400、500、600 W)对大肠杆菌破壁效果的影响,结果见图1。

图1 超声功率对大肠杆菌破壁效果的影响
由图1可知,随着超声功率的增加,菌体的破壁效果提高。当超声功率增加到400 W时,细胞开始有明显断裂的现象,局部出现了一些细胞碎絮;当超声功率为500 W时,破壁效果明显,菌体整体出现破碎现象;当超声功率增加至600 W时,大肠杆菌细胞出现絮状现象,原因可能是产生超声热效应,细胞发生炭化沉底,影响了破壁效果[22]。因此,最佳超声功率为500 W。
2.1.2 超声时间对大肠杆菌破壁效果的影响
按1.2.3方法,将一定量的菌体悬浮液置于反应管中,设定每次超声时间9 s、间隔时间6 s,固定超声功率500 W,考察超声时间(0、15、20、25、30、35、40、45 min)对大肠杆菌破壁效果的影响,结果见图2。

图2 超声时间对大肠杆菌破壁效果的影响
由图2可知,随着超声时间的延长,菌体的破壁效果提高。当超声时间为30 min时,大肠杆菌细胞的破壁率明显提高,这主要是因为随着超声时间的延长,超声稳流振荡及空化效应积累增多,有利于细胞的破碎。然而,能量的增多会引起超声波的化学效应,即能量会将溶出的大分子打断或使其变性[22],超声时间为35~45 min时,极可能出现超声波的化学效应。因此,选取最佳超声时间为30 min。
2.2 ECMSP性质分析
2.2.1 ECM吸附等温线
ECM为悬液状态,不能直接作为固定相,需要将其固定在一定的载体上。研究表明,硅胶表面硅羟基(Si—OH)的吸附作用很强,硅胶自身具备一定的刚性,因而可以利用硅胶与大肠杆菌细胞膜形成载体细胞膜,作为色谱固定相[23]。裸露的大孔硅胶对ECM的吸附等温线如图3所示。

图3 ECM吸附等温线
由图3可知,当初始ECM悬液中蛋白质质量浓度(Cm)大于150 μg/mL时,其吸附量随着Cm的进一步增加变化平缓,说明吸附趋于饱和。即当初始ECM悬液中蛋白质质量浓度大于150 μg/mL时,ECM完全覆盖整个大孔硅胶表面。根据Langmuir吸附等温线方程求出吸附在大孔硅胶表面ECM的最大蛋白质质量浓度(Csmax)为9.98 μg/mg,吸附常数(K*)为171.02 μg/mL。
2.2.2 ECMSP的表面特征
将载体与ECMSP经过番红染色,镜检观察,结果见图4。
从图4可以看出,裸露的大孔硅胶表面光滑,而ECMSP表面是粗糙的,说明ECM已经完全覆盖在硅胶表面。研究表明,在水溶液中硅胶表面硅氧桥(Si—O—Si)和硅羟基(Si—OH)等活性基团能强烈并不可逆转地吸附在细胞膜上的蛋白质和脂类等大分子物质上[24],表明ECM能被牢固地吸附固定在大孔硅胶表面。除此之外,由于大肠杆菌细胞膜具有磷脂双分子层结构,脂质分子极性头间的离子相互作用以及膜内部烷基链间的疏水相互作用,能使吸附在硅胶表面的细胞膜碎片之间彼此靠近而融合并自动形成闭合结构,完全覆盖在硅胶表面[23]。

图4 载体硅胶(A)和ECMSP(B)显微镜图
2.3 ECMSP对辣木籽抗菌肽的萃取效果
ECMSP对辣木籽抗菌肽的萃取效果见图5。

图5 ECMSP萃取前后抗菌肽的抑菌活力变化
由图5可知,ECMSP对辣木籽抗菌肽萃取前后的抑菌活力发生显著变化,萃取前辣木籽抗菌肽对金黄色葡萄球菌和大肠杆菌的抑菌率分别为43.13%和30.35%,萃取后的抑菌率分别为23.73%和12.50%,说明ECMSP对辣木籽蛋白肽中具有抑菌活性的抗菌肽产生有效吸附,造成萃取前后的抑菌活力出现差异。
2.4 ECMSP萃取前后辣木籽抗菌肽的RP-HPLC分析
采用ECMSP萃取辣木籽抗菌肽,对萃取前后的抗菌肽进行RP-HPLC分析,结果如图6所示。
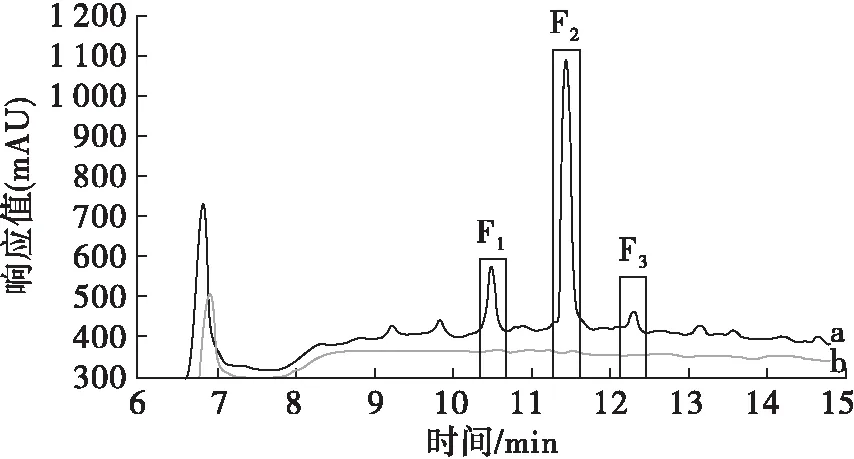
图6 ECMSP萃取前(a)后(b)抗菌肽的RP-HPLC图谱
由图6可知,萃取前后辣木籽抗菌肽的色谱峰发生了明显变化,其中F1、F2、F3均消失,说明3个差异峰被ECMSP有效吸附,对比ECMSP对辣木籽抗菌肽萃取前后的抑菌活力变化情况,表明这3个差异峰中有潜在抗菌肽,有待进一步的分离鉴定。
3 结 论
对大肠杆菌进行超声破壁以制备ECM,在超声功率500 W、超声时间30 min条件下,破壁效果较好。大孔硅胶对ECM的饱和吸附值(Csmax)为9.98 μg/mg,吸附常数(K*)为171.02 μg/mL。ECMSP对辣木籽抗菌肽的吸附效果明显,ECMSP萃取前抗菌肽对金黄色葡萄球菌和大肠杆菌的抑菌率分别为43.13%和30.35%,ECMSP萃取后的抑菌率分别为23.73%和12.50%。RP-HPLC分析表明,辣木籽抗菌肽经ECMSP萃取前后出现了3个明显差异峰,这3个差异峰可能是3种潜在的抗菌肽,有待进一步的分离鉴定。该研究可为后续抗菌肽的靶向筛选提供重要依据。

