真菌Aspergillus sp.对铜的耐受机制研究
陈兰洲,吴万银,李昌虎,何凡,张玉克
(武汉大学 资源与环境科学学院,武汉 430074)
废弃矿山的尾矿中含有大量的重金属,其渗滤液容易污染矿山周边的土壤,并且会对周边居民的健康以及生态环境造成影响[1].因此,对废弃矿山进行修复变得极为重要和迫切.目前,物理修复、化学修复以及生物修复技术是常用的矿山修复方法,其中,无额外污染、经济有效的微生物修复技术逐渐受到研究者的关注[2].
微生物修复技术是指利用人工驯化或者土著微生物的自身特性和新陈代谢作用来吸附重金属、降低重金属毒性以及改善土壤质地的修复技术[3].微生物细胞壁中带有负电的官能团,展现出了较好的与重金属结合的能力,此外,微生物代谢的各种小分子有机酸也是微生物修复重金属污染土壤的重要物质,这些有机酸能够改变基质酸碱度以及结合重金属降低其毒性[4].合适的微生物物种选择则是微生物修复成功的关键,与异位微生物相比,原位微生物更加有优势,主要表现在对生态环境的适应性和相关重金属的耐受性上[5],然而目前对特定场地的微生物修复物种的相关耐受性、污染物去除机理、作用机制等方面的研究尚有欠缺.
因此,本研究以铜尾矿库筛选出的一株土著真菌为对象,研究了其对重金属铜的耐受、去除能力,并进一步分析了其耐受的机理和其对生长环境的改变能力,以期为选择金属矿区污染土壤修复的微生物物种提供参考依据.
1 材料与方法
1.1 实验材料
供试真菌为Aspergillussp.TDC-1,分离自云南汤丹的一处铜矿尾矿库,经纯化鉴定后(NCBI检索号:MZ221492)保存于武汉大学资源与环境科学学院生态学与环境生物学实验室.将保存的菌种接种到马铃薯葡萄糖琼脂(PDA)固体培养基上,28 ℃恒温培养5 d 后,在平板中倒入无菌去离子水,使用灭菌的接种环将孢子轻轻划入无菌水中,然后将孢子悬浮液吸出备用.
1.2 实验方法
将含有200 mL PDA 液体培养基的锥形瓶高温灭菌,冷却至室温后加入CuSO4·5H2O 储备液,分别配置成Cu2+浓度为0、5、25、50、100、150、200 mg·L-1的培养基.然后接种2 mL孢子悬浮液,设置3个平行,最后置于震荡培养箱中进行培养(27 ℃,150 r/min),培养14 d 后使用0.45 μm 水膜过滤,收集菌丝体和滤液用于后续分析.
1.3 菌丝扫描电镜观察
将新鲜菌丝体洗涤后使用FAA 固定液(50%乙醇、丙三醇、甲醛、冰醋酸的体积比为18∶1∶1∶1)固定过夜,固定后,使用20%的乙醇对菌丝进行处理,时间为15 min,然后离心收集菌丝,之后依次使用浓度为50%、80%、100%的乙醇各处理一次.处理结束后加入叔丁醇,并放于-20 ℃冰箱进行样品固化,然后在冷冻干燥机中冻干样品,冻干时长为12 h,冻干后使用扫描电子显微镜(SEM)观察菌丝的形态.
1.4 菌丝生理生化指标
将收集到的新鲜菌丝体用去离子水洗涤2~3次,放入70 ℃烘箱中烘干至恒重,然后称量菌丝体的干重.真菌的生长抑制率按照公式(1)进行计算.
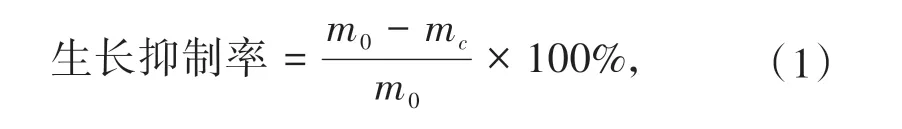
式中,m0为未受胁迫处理组的真菌干重,mc为受胁迫处理组的真菌干重.
在研钵中加入0.1~0.2 g 新鲜菌丝、适量石英砂和2 mL 0.05 mol/L 的磷酸缓冲溶液(含有体积分数为1%的聚乙烯吡咯烷酮并且调节pH到7.8),研磨,待研磨成匀浆后吸出匀浆液并定容到10 mL,然后离心10 min(4 ℃,8000 r/min),取上清液并使用紫外分光光度计测量菌丝中的蛋白质含量和超氧化物歧化酶(SOD)活性[6].然后另取0.1~0.2 g 新鲜菌丝于研钵中,以2 mL 0.05 mol·L-1的磷酸缓冲溶液(pH为7.8)为提取液,研磨离心后取上清液测量菌丝中的丙二醛(MDA)的含量[6].
1.5 pH和有机酸含量的测定
使用pH 计直接测量培养液的pH.用0.1 mol·L-1的H2SO4酸化滤液,并用0.22 μm 滤膜进行二次过滤,然后用高效液相色谱进行有机酸的检测.以草酸、乙酸、抗坏血酸、柠檬酸、酒石酸、琥珀酸和苹果酸标准品的出峰时间和峰面积作为对照,对培养液中有机酸的成分和浓度进行分析.色谱条件为:0.01 mol/L 的磷酸二氢钾缓冲液(pH 为2.8)与甲醇混合液(缓冲液与甲醇的体积比为95∶5)作为流动相,色谱柱为Agilent SB-C18,进样量为200 μL,柱温设置为25 ℃,流速为1 mL/min,分析波长为210 nm.
1.6 Cu2+去除率的测定
滤液中的Cu2+浓度通过火焰原子吸收法进行测量,测量前使用0.22 μm 滤膜对滤液进行二次过滤.培养液中Cu2+的去除率按照公式(2)计算.
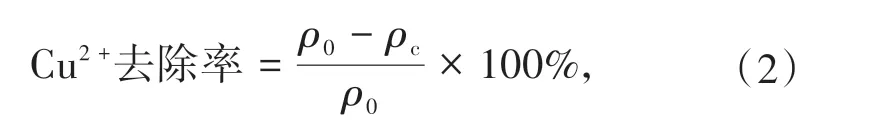
式中,ρ0为培养初期培养液的Cu2+浓度,ρc为培养结束时培养液的Cu2+浓度.
1.7 数据分析
使用Excel 2019 进行数据整理和计算;使用Origin 2021 绘图;使 用IBM SPSS Statistics 26 进 行单因子方差分析,显著性水平设置为α=0.05,多重比较方法选择Duncan′s multiple range test,用不同的小写字母表示处理之间存在显著差异(P<0.05);使用R 语言的corrplot 和Hmisc 程序包进行相关性分析,用*表示显著(P<0.05),用**表示极显著(P<0.01).
2 结果与分析
2.1 Cu2+胁迫对真菌TDC-1生物量的影响
如图1 所示,真菌的干重随着Cu2+胁迫浓度的升高而降低,与未受胁迫的处理组(CK)相比,5、25和50 mg·L-1的Cu2+胁迫对真菌干重无显著影响(P>0.05),其 生 长 抑 制 率 分 别 为3.35%、12.44% 和10.72%;而100 和150 mg·L-1的胁迫浓度使真菌干重显著降低(P<0.05),其生长抑制率分别为31.73%和39.29%;当胁迫浓度为200 mg/L 时真菌干重最小,其生长抑制率高达82.62%.
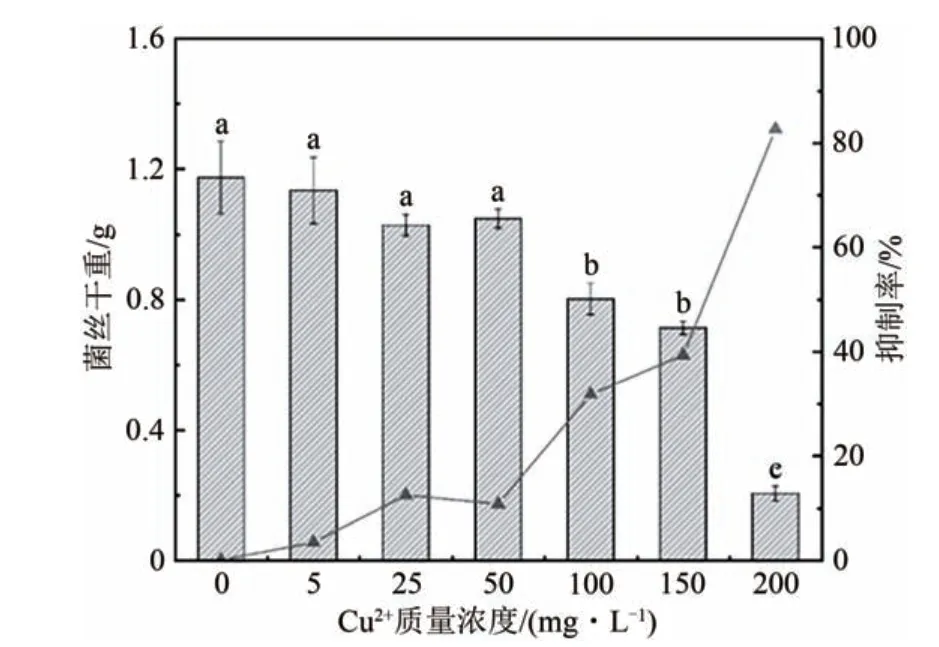
图1 Cu2+胁迫对真菌TDC-1干重的影响Fig.1 Effect of Cu2+stress on the dry weight of fungus TDC-1
2.2 Cu2+胁迫对TDC-1 菌丝可溶性蛋白质、MDA 含量和SOD活性的影响
如图2(a)所示,菌丝可溶性蛋白质含量随着Cu2+胁迫浓度的升高呈现下降趋势.与CK 相比,5~50 mg·L-1的Cu2+胁迫对菌丝的蛋白质含量无显著影响(P>0.05),而100~200 mg·L-1的胁迫下菌丝的蛋白质含量显著降低(P<0.05),其中,当胁迫浓度为150 和200 mg·L-1时菌丝的蛋白质含量分别降低了49.91%和55.51%.
由图2(b)可以看出,Cu2+胁迫引起了真菌TDC-1 的MDA 含量变化,并且随着胁迫浓度的升高,其MDA 含量也在不断升高.其中,除5 和50 mg·L-1的Cu2+胁迫处理组对真菌细胞的MDA 含量无显著影响(P>0.05),其余处理组的真菌MDA 含量与CK 相比有显著的增加(P<0.05),同时在胁迫浓度为200 mg·L-1时观察到了最大的MDA 含量增加,为CK的2.51倍.
如图2(c)所示,Cu2+胁迫下真菌菌丝的SOD 活性显著增加(P<0.05),同时5~150 mg·L-1处理组之间的SOD 活性无显著差异(P>0.05).然而,真菌在200 mg/L Cu2+胁迫下未检测到SOD活性.
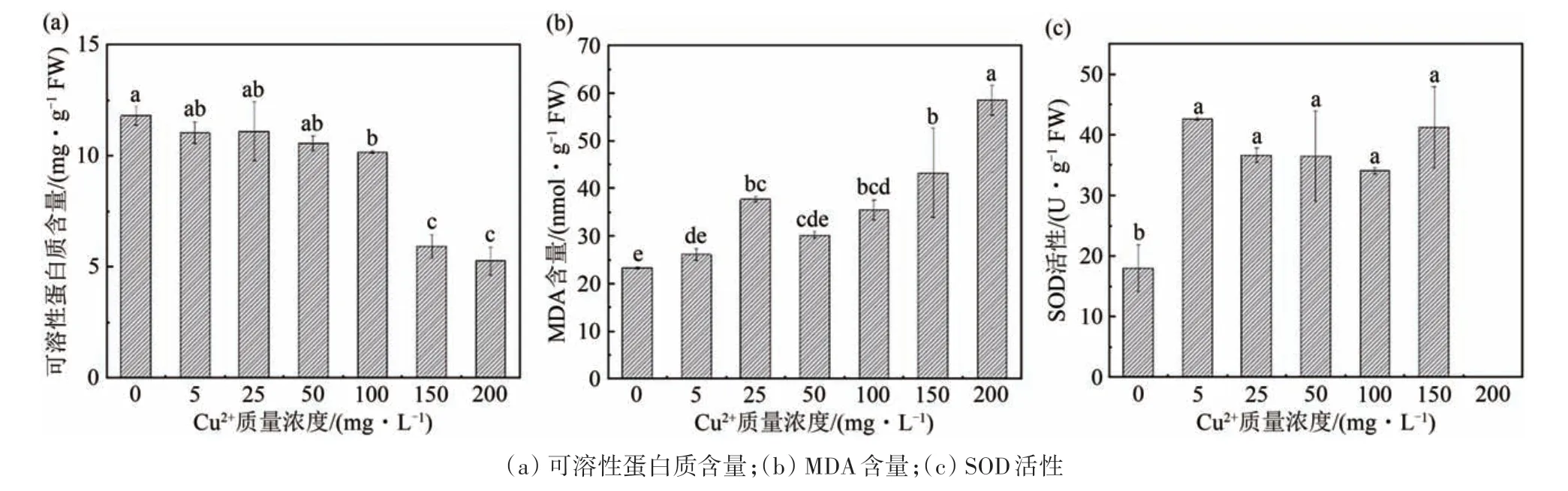
图2 Cu2+胁迫对真菌TDC-1生化指标的影响Fig.2 Effect of Cu2+stress on the biochemical indexes of fungus TDC-1
2.3 Cu2+胁迫对真菌TDC-1形态的影响
图3 展示了不同浓度Cu2+胁迫下真菌TDC-1 的形态.低浓度(5 mg·L-1)的Cu2+对真菌TDC-1 几乎没有影响,随着胁迫浓度(25~150 mg·L-1)的升高,菌丝体受到损伤的同时开始出现菌丝缩小、断裂的现象,并且在高浓度(200 mg·L-1)时发生菌丝膨大以及真菌破裂死亡的现象.

图3 Cu2+胁迫对真菌TDC-1形态的影响Fig.3 Effect of Cu2+stress on the morphology of fungus TDC-1
2.4 Cu2+胁迫对培养液中pH和有机酸含量的影响
对培养液pH 的测定结果显示,随着Cu2+胁迫浓度的升高,培养液的pH 值出现先增大后降低的现象(图4(a)),并且在胁迫浓度为50 mg·L-1时达到了最大值(6.21),在150 mg·L-1时有最小值(4.37).同时,对培养液中7 种有机酸的检测中仅检出了3 种有机酸,分别为草酸、乙酸和琥珀酸(图4(b)),其中,在Cu2+胁迫浓度为50 mg·L-1时观察到了3 种有机酸的最小值,在200 mg·L-1处理组中观察到了3种有机酸的最大值.与CK 相比,50 mg·L-1处理组的草酸、乙酸和琥珀酸含量分别降低了72.79%、57.06%和55.23%;而200 mg·L-1处理组的草酸和琥珀酸含量分别提升了213.30%和534.65%.就有机酸的总量而言,与CK 相比,50 mg·L-1处理组的总量降低了61.31%,而200 mg·L-1处理组的总量增加了184.72%.
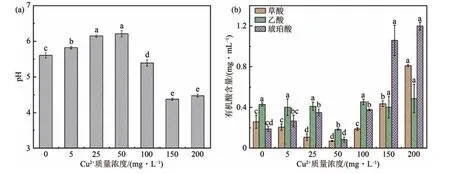
图4 Cu2+胁迫对培养液中pH和有机酸含量的影响Fig.4 The effect of Cu2+stress on pH and organic acid content in culture broth(a)pH;(b)有机酸含量
2.5 不同胁迫浓度下真菌对Cu2+去除率的变化
对培养液中Cu2+的测定发现,随着初始Cu2+浓度的升高,去除率也在逐渐下降(图5).其中,真菌在Cu2+胁迫浓度为5、25、50 和100 mg·L-1的胁迫下有超过60% 的去除率,分别为99.24%、88.73%、74.65%和68.06%.
2.6 不同浓度Cu2+胁迫下真菌生理生化指标和有机酸的相关性分析
图6展示了胁迫下真菌生理生化指标和有机酸之间的相关性.其中,胁迫浓度与pH、菌丝干重和蛋白质含量呈极显著负相关,与MDA、草酸和琥珀酸浓度呈极显著正相关;培养液中的pH 与草酸和琥珀酸的含量呈极显著负相关,与蛋白质含量呈极显著正相关;MDA 与菌丝干重和蛋白质含量呈极显著负相关,与琥珀酸和草酸含量呈极显著正相关.

图6 不同浓度Cu2+胁迫下真菌生理生化指标和有机酸的相关性分析Fig.6 Correlation analysis between physiological and biochemical indexes and organic acids of fungi under different concentrations of Cu2+Stress
3 讨论
真菌干重的大小可在一定程度上反映Cu2+胁迫对真菌TDC-1 的影响程度,真菌TDC-1 的生长抑制率(图1)表明:TDC-1至少可以耐受50 mg·L-1的Cu2+胁迫.SEM 的图像分析(图3)则发现,50 mg·L-1的Cu2+胁迫下TDC-1 形态良好仅部分菌丝出现缩小的现象,而随着Cu2+浓度的升高,菌丝缩小加剧,并出现膨大死亡的现象.同时,对培养液中Cu2+的测量(图5)发现,TDC-1 在100 mg·L-1的胁迫浓度下仍有较好的Cu2+去除率.因此,本研究说明:真菌TDC-1能够较好地耐受浓度50 mg·L-1以下的Cu2+胁迫,并且有着较好的Cu2+去除作用.
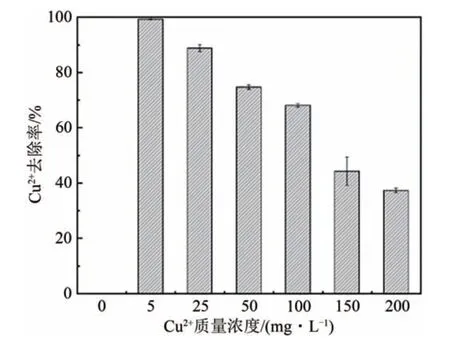
图5 不同胁迫浓度下真菌TDC-1对Cu2+的去除率Fig.5 Removal rate of Cu2+by fungus TDC-1 under different stress concentrations
生物体内的蛋白质有参与重金属的解毒,增强生物对各种胁迫耐受的能力,而不同的生物在胁迫下所表达出的可溶性蛋白质有所不同,通过对可溶性蛋白质总量的分析,可以更好地了解真菌对Cu2+胁迫的抵御机制[7].真菌TDC-1在Cu2+胁迫下总体蛋白质含量呈下降趋势(图2(a)),可能是可溶性蛋白质在抵御Cu 胁迫中并非起到主导作用的原因[8].此外,真菌在重金属胁迫下活性氧和蛋白质酶含量会增加,从而导致蛋白质破裂和降解的速率加快,也可能会导致蛋白质含量下降[9].
MDA 是细胞膜受损后的产物,因此MDA 的含量成为了判断真菌细胞膜受损程度的手段之一[10].研究发现,随着Cu2+胁迫浓度的升高,真菌TDC-1 受到的损伤越大(图2(b)),Cu2+浓度超过100 mg·L-1就能观察到较明显的损伤现象(图3).活性氧自由基(ROS)是真菌在受到外界胁迫时细胞产生的物质之一,如果不对多余的ROS 进行清除,真菌的生长发育就会受到影响,而SOD 可以通过清除ROS 以应对非生物胁迫[11].实验发现,Cu2+胁迫下,菌丝体内的SOD 活性增加(图2(c)),但SOD 的活性随着胁迫浓度的升高有下降的趋势,表明TDC-1 对胁迫的耐受有一定的限度[12].
在有毒金属矿物存在的情况下,真菌在生长过程中会分泌大量的有机酸(如乙酸、柠檬酸和草酸)以应对胁迫[13].有机酸可以通过螯合作用结合重金属使其从离子态转化为无毒或是低毒性的螯合态[14].研究发现,草酸和琥珀酸的含量与胁迫浓度呈极显著的正相关,说明有机酸的分泌是TDC-1 抵抗Cu2+胁迫的重要手段之一;此外,实验还发现,有机酸的分泌量与培养液的pH 有显著的相关性,这与其他学者的研究结果类似[15].
当胁迫浓度较低时(0~50 mg/L),TDC-1 受到的损害较小,生物量和菌丝形态与CK 相比无显著改变,此时抗氧化酶系统可能是其耐受Cu2+的主要机制,而有机酸则在真菌受到胁迫和吸附重金属离子的过程中含量降低[16],溶液中的pH 也因此增加。当胁迫浓度较高时(50~200 mg/L),TDC-1 受到的损害增大,生物量降低并且发生严重的形态改变,而SOD 活性也有所降低,此时有机酸可能是其耐受Cu2+的主要机制,因此培养液中有机酸含量大量增加,pH 降低.但关于真菌TDC-1 有机酸分泌的具体机制,还需要代谢和基因组学的验证.
综上所述,真菌TDC-1 能够耐受至少50 mg·L-1的Cu2+胁迫,并且对培养液中的Cu2+有较好的去除效率,是优秀的铜矿区修复微生物物种.此外,真菌TDC-1 主要依赖抗氧化系统和分泌有机酸来应对Cu2+胁迫,SOD活性的提高和有机酸的分泌可能是其减轻铜毒害、提高铜耐受性的潜在机制.

