竹节参皂苷成分对对乙酰氨基酚诱导急性肝损伤的保护作用
邓旭坤,戴晨曦,段欢,刘钊,阿尔斯拉·玉苏甫,舒广文*
(1 中南民族大学 药学院& 民族药学国家级实验教学示范中心,武汉 430074;2 中南民族大学 学报编辑部,武汉 430074)
对乙酰氨基酚(acetaminophen,APAP),又称扑热息痛,是国内、外常用的非甾体抗炎止痛药,广泛用于感冒、疼痛、发热病症的治疗[1].目前市场上已知的畅销感冒药物,如快克、泰诺、白加黑等的主要成分均为APAP,而这些感冒药大多为OCT 药物由患者自行购买或使用.临床报道显示:由于患者用药知识的匮乏,超剂量或者同时服用多种主含成分相近的感冒药,会引起APAP 摄入过量而导致严重的药物性肝损伤(drug-induced liver injury,DILI).目前临床上治疗APAP 肝损伤的有效药物和措施不多[2].因此,寻找理想的解决APAP 超剂量服用所致的肝损伤是一个亟待解决的问题.
竹节参(Panax japonicusC.A.Mey.)是五加科人参属多年生植物,由于其同时具有人参补气和三七补血的功效,素有“草药之王”的称号[3].竹节参主要含有多糖和皂苷两大活性成分,前期的研究发现竹节参多糖具有增强小鼠抗肿瘤免疫反应的能力[4],同时竹节参总皂苷(total saponins fromPanax japonicusC.A.Mey.,PJST)可改善乙醇诱导的小鼠肝损伤[5],还对高脂饲料诱导的小鼠肝纤维化也有抑制作用[6].但PJST在干预APAP诱导的肝损伤方面的研究和报道较少,故本文从体内和体外研究PJST 干预APAP引起急性肝损伤的作用及其潜在的分子机制.
1 材料
1.1 药物
竹节参采集于湖北恩施土家族自治州,经中南民族大学药学院万定荣教授鉴定,为五加科人参属植物竹节参,凭证标本(NO. SC-2012054)现保存在中南民族大学药学院.竹节参总皂苷(PJST)的提取制备按照参考文献[7]进行,1 kg的竹节参根茎获得约130 g的PJST.
1.2 动物
SPF级昆明种小鼠(雌雄各半,6~8周龄,18~22 g)40 只,由湖北省实验动物研究中心提供,许可证号为SCXK(鄂):2016-0089.在本文中,动物实验管理的相关方案均已通过中南民族大学实验动物伦理委员会(批准号:2018-SCUEC-AEC-014)的审批.
1.3 细胞株及细胞培养
人HepG2 肝癌细胞购自中国典型培养物保藏中心(武汉大学),使用DMEM 培养基(含有10%FBS、100 U·mL-1青霉素和100 U·mL-1链霉素)于培养箱(37 ℃,5%CO2)中常规培养.
1.4 药品与试剂
人参皂苷Re、人参皂苷Ro、竹节参皂苷V、竹节参皂苷Ⅳ、竹节参皂苷Ⅳa 的标准品购自成都普瑞法科技公司;对乙酰氨基酚(APAP)购自上海源叶生物科技公司;胎牛血清(FBS)购自武汉普诺赛生物公司;DMEM、甲基噻唑基四唑(MTT)购自美国Hyclone公司.
肝功能检测试剂盒丙氨酸氨基转移酶(ALT)、乳酸脱氢酶(LDH)、天冬氨酸氨基转移酶(AST)购自南京建成生物技术研究所;炎症因子ELISA 试剂盒白介素-6(IL-6)、白介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)购自武汉爱博泰克生物科技公司;核纤层蛋白B(Lamin B)、核因子B 亚基p65 亲和肽(NF-κB p65)、Ser276 位磷酸化核因子B 亚基p65 亲和肽(P-NF-κB p65)、HPR 标记山羊抗兔IgG(H+L)购自武汉三鹰生物科技公司;BCL2-Associated X(Bax)、B 淋巴细胞瘤-2(Bcl-2)、β-Actin、细胞核和细胞质蛋白提取试剂盒、超敏ECL 化学发光试剂盒(BeyoECL Plus);Hoechst 33258 荧光染料、DAPI 染色液(DAPI dihydrochloride,staining solution)和TUNEL 细胞凋亡检测(一步法)试剂盒购自上海碧云天生物技术有限公司.
2 方法
2.1 竹节参总皂苷提取物的主要成分分析
参考文献[8]中的方法,对竹节参总皂苷进行成分和含量的分析.
色谱条件:Agilent C18柱(4.6 cm×25 cm,5 μm);流动相:乙腈(A)-0.2%磷酸水溶液(B),梯度洗脱:0~5 min,5%~5%A;5~20 min,5%~30%A;20~30 min,30%~30% A;30~50 min,30%~85% A;50~60 min,85%~85% A;流速1.0 mL·min-1;检测波长203 nm;柱温30 ℃;进样量20 μL.
2.2 竹节参总皂苷对APAP 诱导HepG2 细胞凋亡的干预作用
取对数生长期细胞铺板,待细胞贴壁后,加入不同剂量的PJST(终浓度为30 μg·mL-1,100 μg·mL-1)孵育24 h.再加入APAP(终浓度为10 mmol·L-1)孵育24 h.在倒置显微镜下,观察并进行细胞形态学分析,采用MTT 法检测细胞活力[9],Hoechst 33258 荧光染色法对HepG2细胞的凋亡形态进行研究.
2.3 动物实验及生化指标检测
取6~8周龄昆明种小鼠40只,雌雄各半,随机分为空白组、模型组、PJST低、高剂量组(50、100 mg·kg-1).各组小鼠灌胃给药(空白组和模型组给予0.9%NaCl 溶液,给药组给予对应剂量的PJST),每天1 次,连续7 d.末次给药2 h 后,除空白组外每组小鼠腹腔均注射APAP溶液(400 mg·kg-1),12 h后将小鼠摘眼球取血于离心管,室温放置30 min后,离心(3000 r·min-1)15 min,吸取上清液按试剂盒说明书规定的操作方法,测定小鼠血清中ALT、AST 及LDH 的含量.然后采取颈椎脱臼法处死小鼠,取部分肝小叶组织于4%甲醛溶液中固定用于免疫组化,剩余组织立即放入-80 ℃冰箱保存用于后续指标测定,用ELISA试剂盒测定肝组织中IL-1β、IL-6及TNF-β的含量.
2.4 组织病理学分析,细胞凋亡染色和免疫组化染色
将甲醛固定后的肝组织包埋在石蜡中制成蜡块并切成5 μm 厚的切片.按照参考文献[10],对组织切片进行HE 染色、Hoechst 33258 染色和免疫组化染色.TUNAL 的染色根据试剂盒说明书的指示进行.
2.5 细胞核蛋白抽提
使用细胞核和细胞质蛋白抽提试剂盒提取细胞核蛋白.首先使用细胞浆蛋白抽提试剂,在低渗透压条件下,细胞涨破释放细胞浆蛋白,后离心得到细胞核沉淀.最后通过高盐的细胞核蛋白抽提试剂抽提得到细胞核蛋白.
2.6 Western-blot分析
取上述冷冻的肝脏组织适量和抽提的细胞核蛋白,参考文献[11]中的方法进行免疫印迹的检测和分析.
2.7 统计分析
所有实验数据均以±s表示.使用GraphPad Prism 6.0,通过单因素方差分析(ANOVA)进行统计学分析;采取Image-Pro plus 6.0 对Western-bolt 图像的灰度值进行对比分析,P<0.05 说明组间差异具有统计学意义.
3 结果
3.1 竹节参总皂苷提取物的成分分析
采取峰面积归一化法计算出竹节参总皂苷提取物中各个皂苷成分的相对含量,如图1所示,竹节参总皂苷中主要含有一下几个主要成分:人参皂苷Re、人参皂苷Ro、竹节参皂苷V、竹节参皂苷Ⅳ、竹节参皂苷Ⅳa,其相对含量分别为87.3、77.2、441.0、227.1、75.0 μg·mg-1.
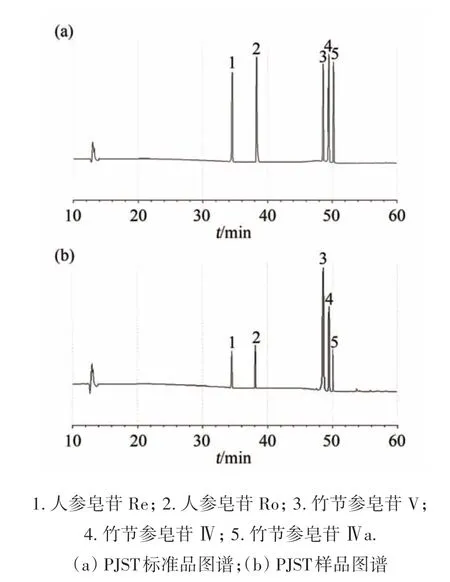
图1 竹节参总皂苷的成分分析(HPLC法)Fig.1 Component Analysis of PJST(HPLC)
3.2 PJST对APAP诱导的HepG2细胞凋亡的影响
形态学分析和MTT 细胞活力试验显示(图2(a)、图2(b))PJST 改善了APAP 诱导的HepG2 细胞死亡(P<0.01).此外如图2(c)、图2(d)所示,Hoechst 33258染色试验表明APAP 10 mmol·L-1时,HepG2细胞显示出明显的核固缩、边集、核碎裂的细胞凋亡形态,而PJST 的预保护给药抑制了APAP 引起的HepG2 细胞凋亡.这些结果表明,PJST 能够缓解APAP对HepG2细胞的毒性作用.
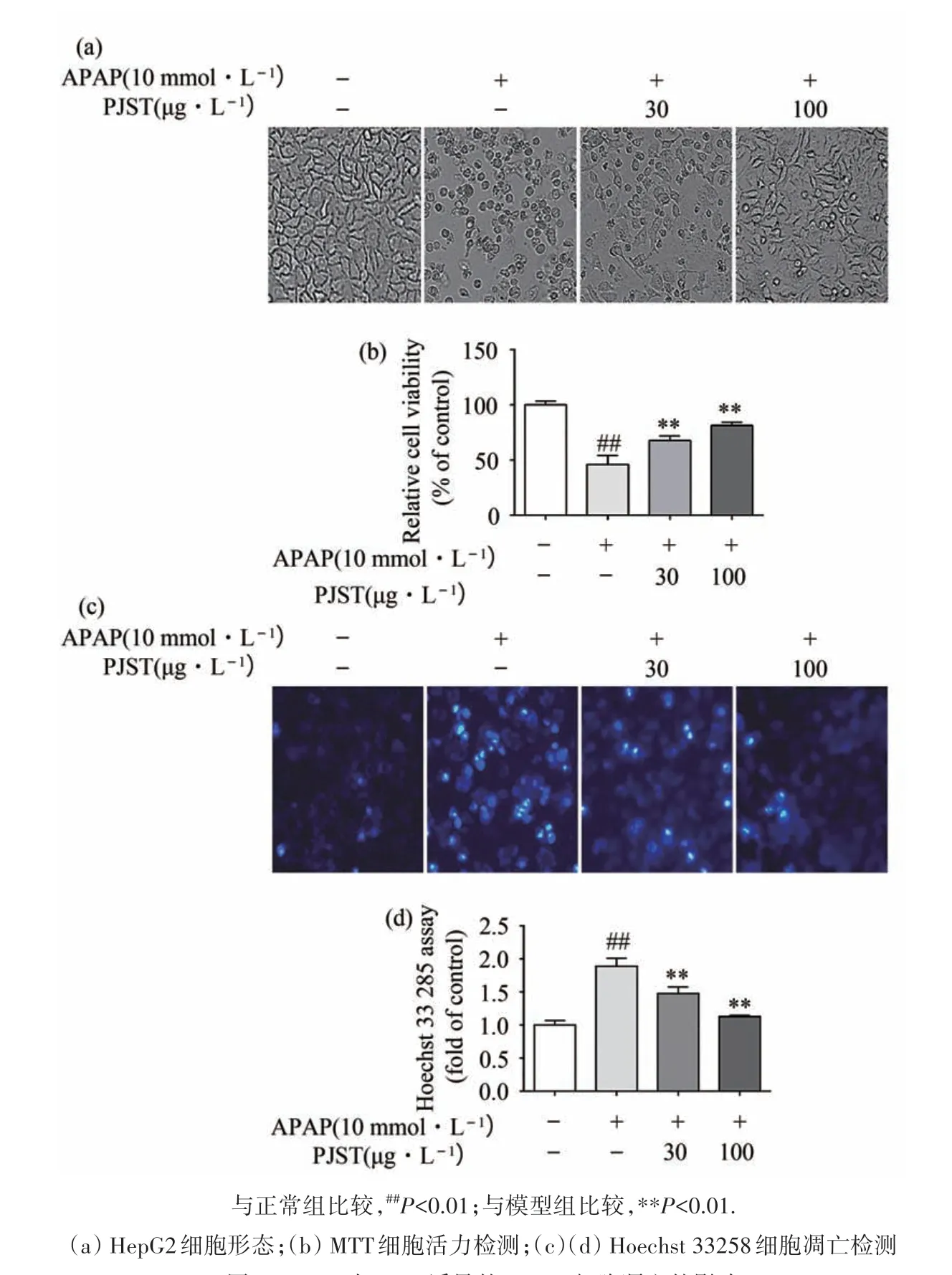
图2 PJST对APAP诱导的HepG2细胞凋亡的影响Fig.2 Effect of PJST on APAP-induced Apoptosis of HepG2 cells
3.3 PJST对APAP诱导小鼠肝毒性的影响
小鼠血清中的ALT、AST和LDH能直接反映小鼠的肝损伤程度.如图3(a)、图3(b)和图3(c)所示,注射APAP后血清ALT、AST和LDH显著升高,而PJST可以显著地减轻这些异常(P<0.01).此外,APAP破坏了正常的肝组织,病理学分析显示模型组小鼠肝脏出现大量的炎性细胞浸润以及出血的情况,而这些炎症被PJST所改善(图3(d)).APAP摄入过量同时也会引起肝细胞的大量凋亡性死亡,如图3(e)、图3(f)所示,Hoechst 33258的小鼠肝脏染色结果与HepG2细胞染色结果相对应,模型组小鼠中的肝细胞也显示出明显的核固缩、边集、核碎裂的细胞凋亡形态,而PJST给药组小鼠的肝细胞凋亡情况得到了改善;TUNAL染色作为检测细胞凋亡的经典方法,TUNAL 染色法的结果(图3(g)、图3(h))也进一步证明了PJST可以预防和保护APAP诱导小鼠的肝毒性.

图3 PJST对APAP诱导小鼠肝毒性的影响Fig.3 Effect of PJST on APAP-induced hepatotoxicity in mice
3.4 PJST对APAP诱导肝损伤小鼠肝细胞中Bax和Bcl-2表达的影响
Bax 和Bcl-2 的表达是细胞发生凋亡程度的指标之一,本文采用Western blot 和免疫组化的方法检测了Bax 和Bcl-2 在各组小鼠肝组织中表达的差异情况,结果见图4(a)、图4(b),图中显示模型组小鼠肝脏细胞中Bax 的表达明显高于空白组小鼠,而PJST的预处理组小鼠肝组织中Bax的表达显著低于模型组.Bcl-2 的结果与之相反,在模型组小鼠肝细胞中,Bcl-2 的表达显著降低,而在PJST 给药保护组中,Bcl-2 的表达被恢复;免疫组化染色的结果更加直观的验证了以上现象(如图4(c)、图4(d)).以上结果充分说明APAP 会提高小鼠肝脏组织当中Bax的表达,抑制Bcl-2 的表达而引起肝细胞的凋亡,经过PJST 的预保护,可以阻止这一现象的发生,起到肝保护作用.
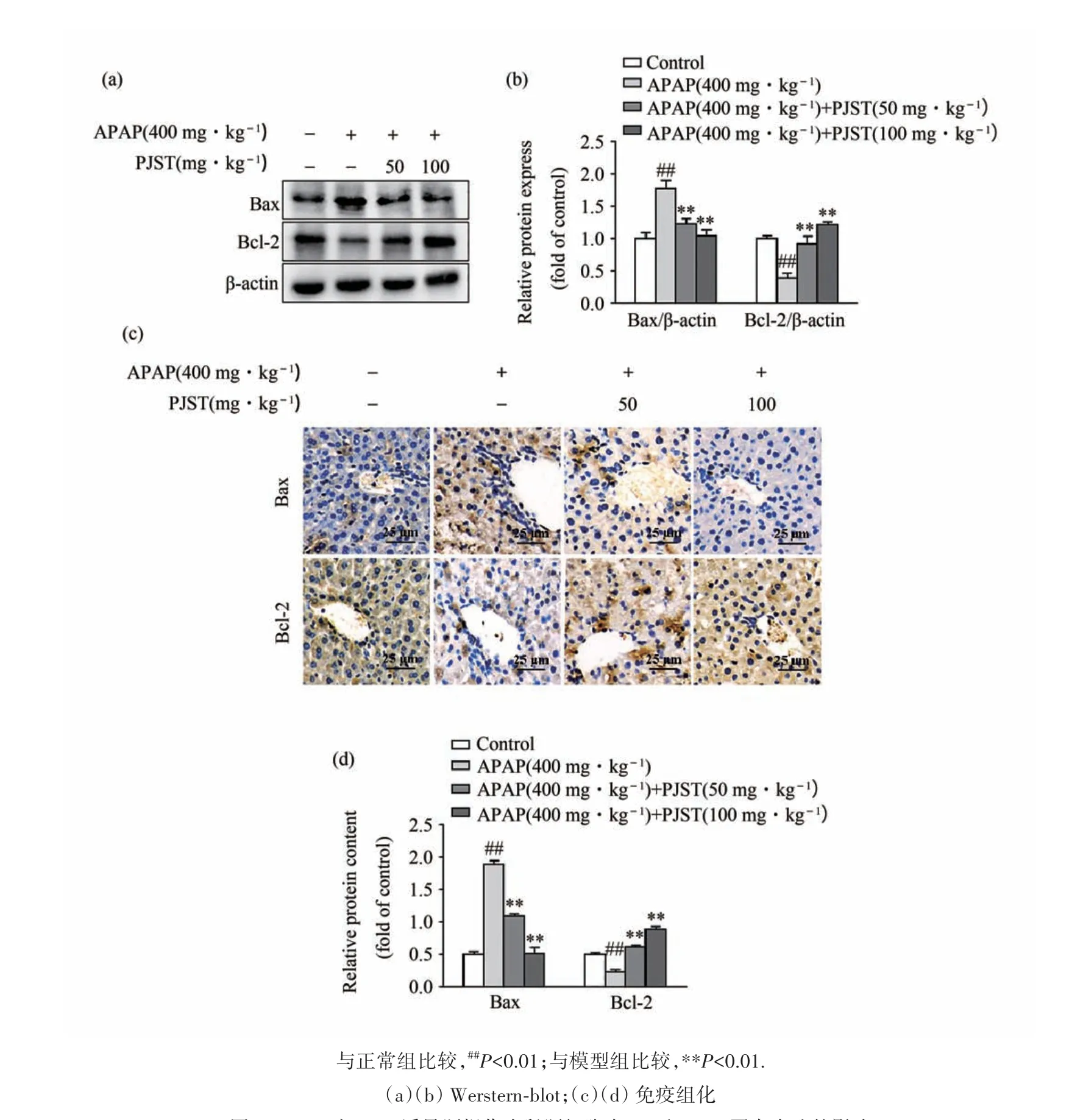
图4 PJST对APAP诱导肝损伤小鼠肝细胞中Bax和Bcl-2蛋白表达的影响Fig.4 Effect of PJST on the expression of Bax and Bcl-2 protein in APAP-induced liver injury mice
3.5 PJST 对APAP 诱导肝损伤小鼠炎症反应的影响
APAP 诱导的急性肝损伤会引起肝内炎症并影响肝组织中炎症因子的产生与释放.如图5(a)、图5(b)、图5(c)所示,模型组小鼠肝组织中炎症因子TNF-α、IL-6 和IL-1β 水平较空白组相比出现显著上调的情况(P<0.01),而PJST 预保护组小鼠肝脏内的TNF-α、IL-6 和IL-1β 水平被显著抑制了(P<0.05 或P<0.01). Western-blot 检测了肝组织中P-NF-κB p65 和核内NF-κB p65 蛋白的表达水平结果见图5(d)和图5(e),可见在模型组小鼠肝组织中,P-NF-κB p65 以及细胞核内NF-κB p65 的表达水平较空白组显著增加(P<0.01),而PJST 可以显著下调P-NF-κB p65 和核内NF-κB p65 的表达水平(P<0.01).以上结果说明APAP 可以通过促进肝组织内炎症因子TNF-α、IL-6 和IL-1β 的产生与释放,并上调肝组织细胞P-NF-κB p65 及核内NFκB p65 的表达水平,而引发小鼠肝脏的炎症反应产生肝损伤.PJST 通过对抗APAP 的上述作用,而有效缓解其诱导小鼠的肝脏炎症反应而发挥肝保护作用.
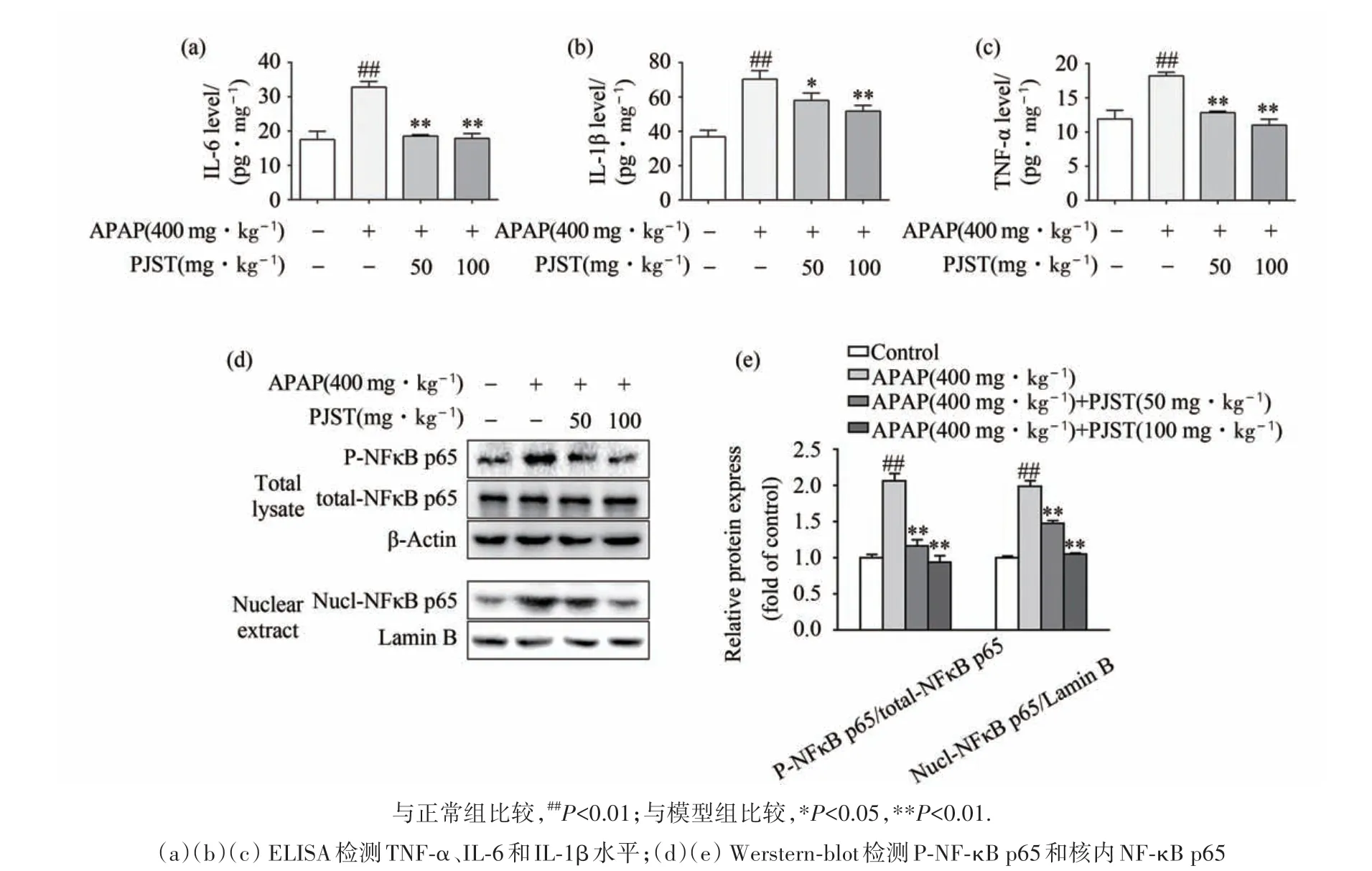
图5 PJST对APAP诱导肝损伤小鼠炎症反应的影响Fig.5 Effect of PJST on inflammatory response in APAP-induced liver injury mice
4 讨论
过量服用APAP 会产生大量的APAP 代谢产物N-乙酰-P-苯醌亚胺(NAPQI),该产物会在耗竭肝脏中的谷胱甘肽(GSH)后与细胞生物大分子反应并形成共价键,导致肝细胞内线粒体损伤,炎症以及细胞凋亡的发生[12].近年来,从植物来源的天然产物中寻找潜在的治疗肝损伤的药物的研究日益成为热点方向.竹节参因其较高的药用价值而逐渐成为药用植物学家研究的关注对象,作为其主要活性成分竹节参皂苷具有较高的镇静、镇痛、抗炎和抗氧化的活性[13-14].在此基础之上,本文构建了APAP 诱导的肝损伤模型,以评估竹节参总皂苷的保肝护肝作用及其可能机制.
血清中ALT、AST 和LDH 水平是评价动物肝功能的经典指标[15].本文中APAP 引起了小鼠血清中ALT、AST和LDH水平的显著增加,PJST的预处理能显著抑制APAP 诱导的上述肝功能指标的异常升高.组织病理学的结果也进一步说明在组织形态学方面PJST发挥了良好的保护作用.
肝细胞凋亡在APAP 肝损伤模型中起着重要作用,病理情况下的肝细胞凋亡会加速肝脏衰竭.Hoechst 33258 荧光染色和TUNEL 法是常见的细胞凋亡检测方法.Bcl-2 家族是一类调控细胞凋亡的关键蛋白,成员众多,其中Bax 是一种促凋亡蛋白,通过诱导线粒体膜透化并释放细胞色素c 诱导细胞凋亡;而Bcl-2 具有明显抑制细胞凋亡的作用,可增强肝细胞对大多数DNA 损伤因子的抵抗性[16].在APAP 诱导的HepG2 细胞死亡实验和APAP 诱导的小鼠肝损伤实验中均出现凋亡情况.同时,体内实验中模型组小鼠肝组织中Bax的表达上调而抗Bcl-2的表达受到抑制,以上情况显示APAP 诱导的肝损伤启动了肝细胞的凋亡性死亡.而PJST 的预处理组细胞凋亡明显减少,Bax的异常表达被抑制,Bcl-2的表达也恢复到了正常水平,由此证明PJST的预保护可以有效预防APAP诱导的肝细胞凋亡.
APAP 诱导肝细胞内的线粒体损伤,会导致细胞内容物(如核蛋白、核DNA 片段、ATP、尿酸等)的释放[17].这些损伤相关分子模式(DAMPs)的存在可能通过toll 样受体激活NF-κB p65.NF-κB p65 信号通路的传导会增强一系列促炎细胞因子(如TNF-α、IL-1 和IL-6)的表达,而这些炎症因子反过来又会加剧APAP 诱导的肝损伤造成恶性循环[18].本研究结果显示,APAP模型组中这些炎性细胞因子的表达显著高于空白组,上调P-NF-κB p65,并且促进NF-κB p65的入核,而PJST 预保护组不仅抑制了上述炎症因子的上调,也下调了NF-κB p65 的磷酸化水平和NF-κB p65 的核内表达.以上结果表明PJST 可能通过抑制肝脏内的炎症反应产生了对APAP 诱导肝损伤的干预效果.
本文结果表明:PJST 可以通过减少肝细胞的凋亡和炎症来抵抗APAP 诱导的肝损伤.PJST 通过降低肝组织中Bax 的表达并上调Bcl-2 的表达作为抗凋亡的保护机制;同时,PJST 还通过抑制NF-κB p65的磷酸化和入核,降低肝组织中炎症因子的表达水平作为抗炎的保护机制.综上,PJST 可能是通过抑制凋亡和抗炎作用发挥干预APAP DILI 的作用,这为竹节参皂苷在抗APAP DILI的药物研发和应用中提供相关的实验依据.

