沉默长链非编码RNA NR_027324对低糖缺氧损伤大鼠H9C2心肌细胞凋亡的影响
孟庆坤 谭 昊 顾 卉 骆佳莹 王菁菁 王传合 韩 苏 孙志军*
心肌梗死是一种致命性疾病,是人类致死的重要原因[1]。在心肌梗死病理生理变化过程中,心肌细胞缺血缺氧引起的心肌细胞凋亡对疾病进展及预后起重要作用。而心肌细胞的凋亡与基因表达的调节密切相关[2]。长链非编码RNA(lncRNA)是一类不具备编码蛋白质的,转录长度>200 nt的非编码RNA[3],在心肌梗死的病理生理过程中发挥重要作用[4-8]。基于之前的研究发现,lncRNA在大鼠心肌梗死边缘区有大量差异表达,以及通过生物信息学分析发现lncRNA存在多种潜在病理机制作用[9]。为了模拟心肌缺血缺氧状态,本研究采用低糖缺氧处理大鼠H9C2细胞,选取lncRNA芯片中差异表达显著的NR_027324作为研究对象,验证在低糖缺氧H9C2细胞模型中NR_027324的变化,以及与凋亡的关系。通过观察沉默NR_027324对心肌细胞凋亡的影响,以探讨NR_027324调节心肌细胞凋亡的作用机制,为防治心肌梗死后心肌细胞凋亡提供理论基础。
1 材料与方法
1.1 材料
大鼠H9C2心肌细胞购自万类生物技术有限公司。si-RNA载体由万类生物技术有限公司合成。转染试剂Lipofectamine TM2000:Invitrogen,Thermo Fisher Scientific,Inc.,美国。DMEM培养基:Gibco;Thermo Fisher Scientific, Inc.,Waltham,MA,美国。胎牛血清:FBS;EverGreen,浙江天杭生物科技有限公司。TRIpure试剂(Cat. No. RP1001):北京百泰克生物技术有限公司。Super M-MLV 反转录酶(Cat. No. PR6502):北京BioTeke Corporation。SYBR GREEN mastermix(Cat. No. SY1020):北京索莱宝科技有限公司。特异性引物:上海生工生物科技。全蛋白提取试剂盒(cat. no. WLA019)、BCA蛋白浓度测定试剂盒(cat.no.WLA004):万类生物技术有限公司。Bax,Bcl-2,cleaved caspase-3,cleaved caspase-9抗体:万类生物技术有限公司。辣根过氧化物酶标记的二抗:万类生物技术有限公司。ECL化学发光试剂盒:万类生物技术有限公司。乳酸脱氢酶测定试剂盒(cat.no. WLA072):万类生物技术有限公司。
1.2 方法
1.2.1 细胞的培养和低糖缺氧处理、si-RNA转染和分组 采用含10%胎牛血清的高糖DMEM培养基于37 ℃、5%CO2培养箱中培养H9C2细胞,3 d后换液,当细胞融合度达到50%时,胰酶消化后,进行传代。si-RNA分子序列设计合成:选取NR_027324序列进行分析,依据si-RNA原则设计3条lncRNA NR_027324干扰序列,并设计一条阴性对照序列。qRT-PCR检测si-RNA转染效率。细胞转染:将对数生长期H9C2细胞接种于6孔板中(每孔1×105个细胞),并在37 ℃,5%CO2下孵育24 h。采用脂质体转染法,用20 nmol/L最终剂量的小干扰RNA(si-Lnc)或小干扰RNA阴性对照(si-Lnc-NC),使用Lipofectamine 2000根据制造商的规程,瞬时转染细胞,孵育24 h。
实验分组:对照组(Con):在高葡萄糖(4.5 g/L)的DMEM培养基中添加10%胎牛血清,温度37 ℃和5%CO2。低糖缺氧组(oxygen and glucose deprivation,OGD):在低葡萄糖(1.0 g/L)DMEM中培养,将其置于含1% O2、94%N2和5%CO2的低氧培养箱中培养6 h。沉默NR_027324阴性对照+低糖缺氧组(si-Lnc-NC+OGD):转染小干扰RNA阴性对照(si-Lnc-NC)后,给予低糖缺氧培养6 h。沉默NR_027324+低糖缺氧组(si-Lnc+OGD):转染小干扰RNA(si-Lnc)后,给予低糖缺氧培养6 h。
1.2.2 逆转录定量聚合酶链反应(qRT-PCR)分析使用TRIpure试剂提取总RNA。使用Nanodrop 2000系统(Thermo Fisher Scientific,Inc,美国)测量RNA的浓度和纯度。根据制造商的规程,使用Super M-MLV反转录酶合成互补DNA(cDNA)。根据制造商的规程,使用SYBR GREEN mastermix对cDNA样品进行扩增。利用韩国BIONEER公司生产的ExicyclerTM 96荧光定量仪进行荧光定量分析。mRNA和lncRNA的PCR反应条件如下:在94 ℃下持续5 min,然后进行40个循环,分别是94 ℃下持续10 s和60 ℃下持续20 s。另外,对每个孔使用双蒸水(ddH2O)作为非模板对照。使用β-actin用于标准化NR_027324的表达水平。相对表达通过2-△△Ct法定量,并进行了3次重复。取3次结果的中位数计算相对表达水平。PCR引物序列见表1。

表1 PCR引物序列
1.2.3 乳酸脱氢酶(LDH)检测 分别转染后,收集各组细胞上清液,采用LDH测定试剂盒,按照说明书的方案检测LDH以确定细胞损伤,在490 nm的酶联免疫检测仪(ELX-800,BIOTEK,美国)测量每一孔的吸光度,每组重复3次。
1.2.4 噻唑蓝比色法(MTT)检测 按实验分组将细胞接种于96孔板中,每孔细胞量5×103个,每组设置5个复孔,并设置一对照孔,只加培养基。待细胞贴壁后进行细胞转染,置于37 ℃培养24 h,分别按分组进行低糖缺氧处理。到达时间点后,弃去培养基,每孔加入20 μl MTT试剂,37 ℃、5%CO2孵育4 h,弃孔内上清液,然后每孔加入150 μl二甲基亚砜(DMSO),避光静置10 min,在570 nm的酶联免疫检测仪测量每一孔的吸光度,计算5孔的平均值。计算细胞成活率。细胞成活率=OD值实验组/OD值对照组。
1.2.5 蛋白质免疫印迹法检测蛋白表达 收集各组细胞,使用全蛋白提取试剂盒裂解总蛋白。使用BCA蛋白浓度测定试剂盒测量蛋白质的浓度和纯度。每泳道40 μg的蛋白质样品在SDS-PAGE凝胶上分离(10%),并转移到聚偏二氟乙烯膜(PVDF)上。在室温下,将膜在5%脱脂牛奶中封闭2 h,然后与一抗孵育在4 ℃下过夜。然后将膜用TBST洗涤3次,与辣根过氧化物酶标记的二抗在37 ℃下孵育45 min,然后进一步用TBST洗涤6次。随后,使用ECL化学发光试剂盒检测印迹,并用凝胶图象处理系统(Gel-Pro-Analyzer软件)分析目标条带的光密度值。
1.3 统计学分析
采用SPSS 26.0统计软件进行数据分析,所有符合正态分布的计量资料以±s表示,组间比较采用单因素方差分析,两两比较行事后比较-最小显著性差异法t检验(post-hoc LSD-t检验),双侧,P<0.05为差异有统计学意义。
2 结果
2.1 低糖缺氧H9C2细胞中NR_027324的相对表达量,LDH、细胞成活率变化
与对照组相比,低糖缺氧组NR_027324表达量明显上调,差异有统计学意义(P<0.001)。低糖缺氧组较对照组LDH升高(P<0.001),成活率下降(P<0.001)。见表2。
表2 低糖缺氧处理H9C2细胞的NR_027324表达、LDH、细胞成活率变化(±s)
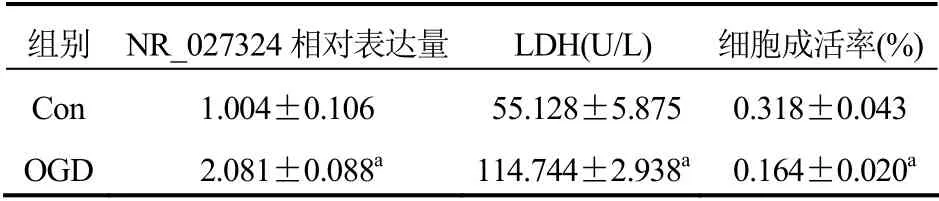
表2 低糖缺氧处理H9C2细胞的NR_027324表达、LDH、细胞成活率变化(±s)
注:与对照组比较,aP<0.001;Con,对照组;OGD,低糖缺氧组
组别 NR_027324相对表达量 LDH(U/L) 细胞成活率(%)Con 1.004±0.106 55.128±5.875 0.318±0.043 OGD 2.081±0.088a 114.744±2.938a 0.164±0.020a
2.2 沉默NR_027324后,低糖缺氧H9C2细胞中NR_027324的相对表达量,LDH、细胞成活率变化
与沉默NR_027324阴性对照+低糖缺氧组比较,沉默NR_027324+低糖缺氧组中NR_027324的相对表达量显著下降76.78%(P<0.001)。沉默NR_027324+低糖缺氧组中LDH与沉默NR_027324阴性对照+低糖缺氧组比较进一步升高(P<0.001);成活率下降(P<0.001)。沉默NR_027324阴性对照+低糖缺氧组与低糖缺氧组(不进行转染)比较NR_027324的相对表达量、LDH、成活率比较,差异无统计学意义(P>0.05)。见表3。
表3 沉默NR_027324后低糖缺氧H9C2细胞的NR_027324表达、LDH、细胞成活率变化(±s)
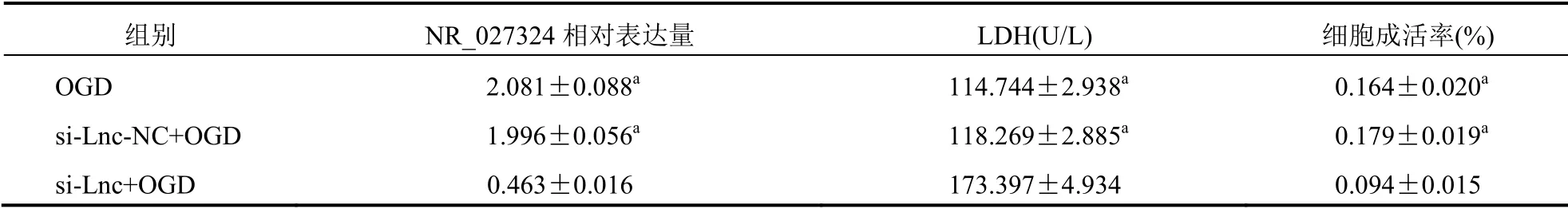
表3 沉默NR_027324后低糖缺氧H9C2细胞的NR_027324表达、LDH、细胞成活率变化(±s)
注:与si-Lnc+OGD组比较,aP<0.001;OGD,低糖缺氧组;si-Lnc-NC+OGD,沉默NR_027324阴性对照+低糖缺氧组;si-Lnc+OGD,沉默NR_027324+低糖缺氧组
组别 NR_027324相对表达量 LDH(U/L) 细胞成活率(%)OGD 2.081±0.088a 114.744±2.938a 0.164±0.020a si-Lnc-NC+OGD 1.996±0.056a 118.269±2.885a 0.179±0.019a si-Lnc+OGD 0.4images/BZ_106_903_2939_908_2939.png63±0.016 173.397±4.934 0.094±0.015
2.3 低糖缺氧H9C2细胞中凋亡相关蛋白表达以及沉默NR_027324后凋亡相关蛋白表达
蛋白质免疫印迹法检测结果显示与对照组比较,低糖缺氧组H9C2细胞促凋亡相关蛋白Bax,cleaved-caspase3和cleaved-caspase9表达增加,抑制凋亡蛋白Bcl-2表达下降。沉默NR_027324+低糖缺氧组与沉默NR_027324阴性对照+低糖缺氧组比较,H9C2细胞促凋亡相关蛋白Bax,cleaved-caspase3和cleaved-caspase9表达增加,抑制凋亡蛋白Bcl-2表达下降。沉默NR_027324阴性对照+低糖缺氧组与低糖缺氧组(不进行转染)比较,凋亡相关蛋白差异变化不明显。见图1。
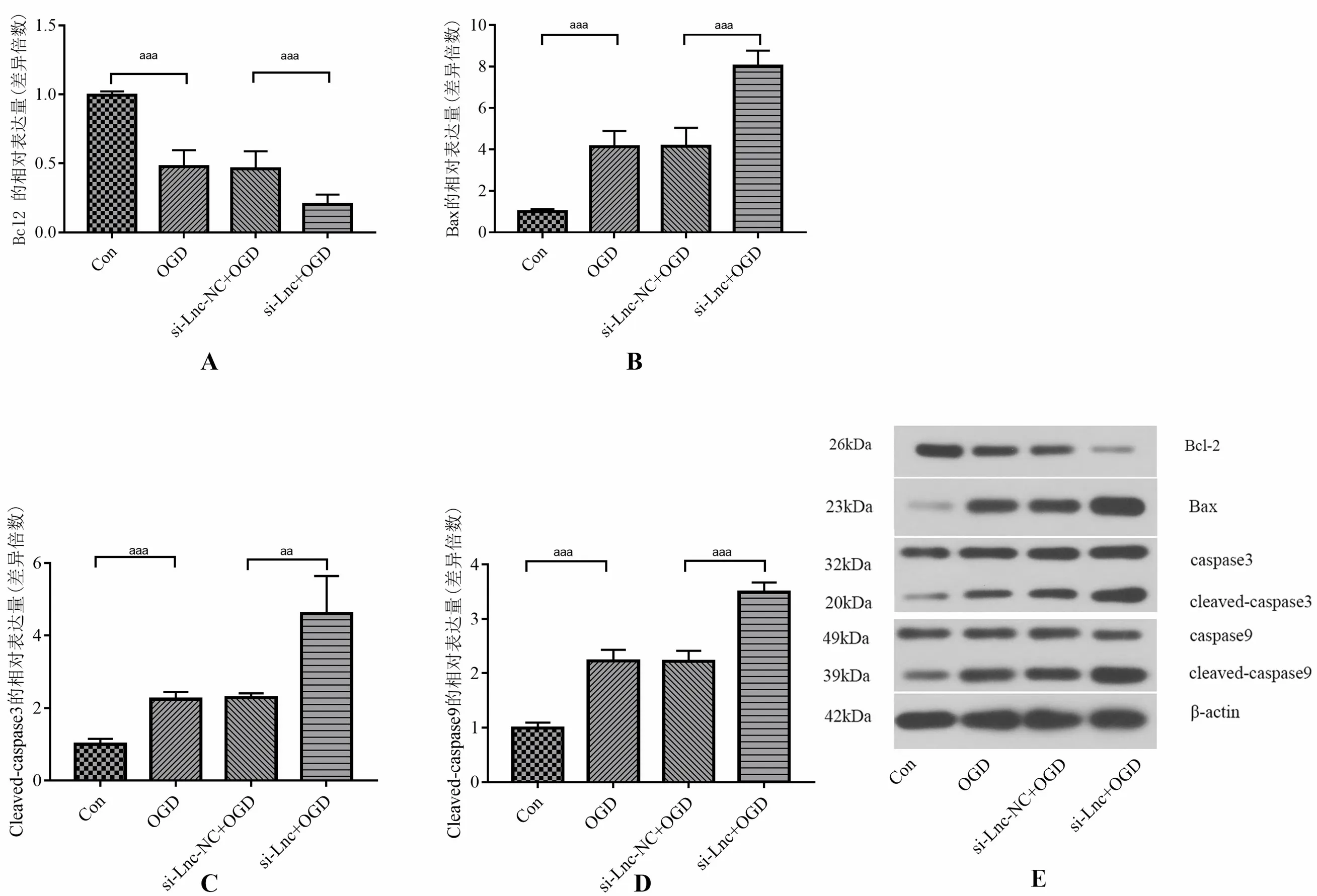
图1 低糖缺氧处理H9C2细胞及转染小干扰RNA沉默NR_027324后凋亡相关蛋白表达(蛋白质免疫印迹法)
3 讨论
有研究表明,原代大鼠心肌细胞经过低糖缺氧损伤(oxygen and glucose deprivation, OGD)干预4 h后,细胞成活率降低,LDH释放增多[10]。本研究结果与上述研究结果趋于一致,低糖缺氧损伤的H9C2细胞中,与对照组比较,LDH明显升高,MTT提示细胞成活率下降。本研究中蛋白质免疫印迹法检测结果显示低糖缺氧大鼠H9C2细胞中促凋亡相关蛋白Bax,cleaved-caspase3和cleaved-caspase9表达增加,抑制凋亡蛋白Bcl-2表达下降,提示凋亡激活。心肌细胞凋亡是心肌梗死中导致心肌细胞损伤的重要原因。多种凋亡相关基因的异常表达可促进或抑制心肌细胞凋亡,如Bax、Bcl-2和caspase-3、caspase-9等[11]。Caspase是一类与凋亡密切相关的蛋白水解酶家族,活化的cleaved caspase-9 是线粒体细胞凋亡途径的启动者,进而激活细胞凋亡的执行者cleaved caspase-3蛋白,诱导细胞凋亡[12]。在之前的研究通过芯片技术分析心肌梗死边缘区的lncRNA表达谱,发现lncRNA在心肌梗死边缘区有大量差异表达[9]。其中lncRNA NR_027324表达上调,重注释分析提示其为H19基因的一段。有研究结果显示H19基因对心肌细胞缺氧损伤具有保护作用[13-14]。本研究采用低糖缺氧环境中培养H9C2细胞的方法模拟大鼠心肌梗死边缘区缺血缺氧状态,研究NR_027324在其中发挥的作用。结果显示,给予沉默NR_027324处理后,低糖缺氧损伤的H9C2细胞中Bax,cleavedcaspase3和cleaved-caspase9表达进一步增加,抑制凋亡蛋白Bcl-2表达进一步下降。对低糖缺氧损伤的H9C2细胞进一步沉默NR_027324后,LDH进一步升高提示细胞损伤进一步加剧,MTT法检测细胞成活率进一步下降。我们认为,NR_027324与低糖缺氧的心肌细胞凋亡明确相关,沉默NR_027324后能够促进凋亡发生。进而推论NR_027324可能是一种保护性lncRNA,抑制低糖缺氧H9C2细胞中的凋亡过程。心肌细胞经过6 h的低糖缺氧干预后,NR_027324表达上调,给予沉默其表达后,凋亡相关蛋白表达增加,使LDH释放增多、细胞成活率进一步下降,反之,低糖缺氧损伤后的NR_027324表达上调可能是细胞应对缺血缺氧导致凋亡增加的一种应激性自我保护机制。内源竞争RNA(competing endogenous RNAs, ceRNA)是lncRNA通过内源竞争结合的方式调节miRNAs的表达,进而发挥在转录后翻译水平调控靶基因表达的一种作用方式。重注释分析提示NR_027324为H19基因的一段,通过生物信息学分析预测miR-103-3p可能为其结合靶点。而在大鼠心肌细胞中miR-103-3p能够下调Atg5的蛋白表达[15]。我们大胆推测NR_027324可能通过ceRNA的方式调节miR-103-3p表达,继而调节下游靶点ATG5的表达,来调节心肌细胞凋亡。上述推论尚需进一步研究证实。
综上所述,NR_027324能够调节低糖缺氧的大鼠心肌细胞凋亡过程。在低糖缺氧的大鼠心肌细胞中,lncRNA NR_027324可能是减少心肌细胞凋亡的一个可能的治疗靶点。不可忽视的是,随着心肌梗死的时间演变,凋亡也存在动态变化,lncRNA在其中发挥的作用可能也有着动态的变化,需要进一步研究证实。

