不同市售低温巴氏杀菌乳的稳定性研究
黄 娟,黄燕燕
1 广东燕塘乳业股份有限公司,广东广州 511356
2 华南理工大学食品科学与工程学院,广东广州 510640
3 佛山科学技术学院食品科学与工程学院,广东佛山 528225
0 引言
乳及其制品一直是公认的营养补给品,为人体生命活动提供了充分的营养。新冠肺炎疫情以来,乳制品的消费力度也呈现明显的增长趋势,成为多数群体日常饮食的一部分。低温巴氏杀菌乳因其更新鲜,保留更多生物活性物质等优点倍加受到人们的青睐,而其的感官品质特点成为人们在选购时的重点考量目标。
低温巴氏杀菌乳中含有大量粒度大小不等的脂肪球,在1~10 μm之间,若不做任何处理直接冷藏放置,这些脂肪球上浮会在低温巴氏杀菌乳表面形成一层奶油层,使低温巴氏杀菌乳产生显著的分层现象[1,2]。故工业化生产低温巴氏杀菌乳时会增加均质工艺,该工艺可以有效击碎低温巴氏杀菌乳中的脂肪球,使得其直径减小到1 μm以下,上浮力减小甚至消失,从而有效防止低温巴氏杀菌乳货架期间出现分层,达到使低温巴氏杀菌乳均一化的效果[1,2]。然而,高脂肪含量的低温巴氏杀菌乳因击碎的小脂肪球之间的距离更近,受布朗运动等发生碰撞的影响,脂肪滴变大的可能性也大大提高,脂肪滴的上浮力增大,产品的脂肪上浮量也将随之加大,同时,产品受均质机探头、压力差异、杀菌温度、产品包装类型、颠倒运输、终端保藏时间和保藏温度都会一定程度上导致脂肪上浮量的差异,现有研究报道产品均质压力[2]、杀菌温度[3]、嗜冷菌脂肪酶[4]和稳定体系构建[5,7]与乳制品脂肪上浮之间的关联,未见产品包装形式、保藏温度等对脂肪上浮影响方面的研究报道。
本研究针对上述问题,调研了不同脂肪含量、不同包装形式、不同杀菌温度的低温巴氏杀菌乳在不同保藏温度和保藏时间条件下的脂肪上浮情况,为保证终端低温巴氏杀菌乳的感官品质提供了基础理论依据。
1 材料与方法
1.1 材料
市售巴氏杀菌乳:广东燕塘乳业股份有限公司:新广州屋顶盒装75 ℃杀菌鲜牛奶,3 个生产批次分别为2021.6.30、2021.7.6、2021.7.7,分别标记为A1/屋顶盒、A2/屋顶盒、A3/屋顶盒;唯绿屋顶盒装80 ℃杀菌鲜牛奶(2021.6.30),标记为B/屋顶盒;PET瓶装A2鲜牛奶,2 个生产批次分别为2021.7.6、2021.7.7,分别标记为C1/PET、C2/PET;蒙牛每日鲜语PET瓶装巴氏杀菌乳(2021.4.7),标记为D/PET;光明优倍屋顶盒装75 ℃巴氏杀菌乳(2021.7.27),标记为E/屋顶盒;香满楼PET瓶装巴氏杀菌娟姗牛乳(2021.7.3),标记为F/PET。
主要设备有:FOSS多功能乳品分析仪(型号:MilkoScan FT1),福斯分析仪器公司;Tower多重光散射仪,北京朗迪森科技有限公司。
1.2 方法
1.2.1 均质效果及脂肪上浮率测试方法
用分液漏斗或量筒量取500 mL巴氏杀菌乳在冰箱内分别贮存于4~6 ℃和10~12 ℃,48 h,然后将上层1/10的乳吸出,并将下层9/10的乳混匀,分别测定上层及下层的脂肪含量,最后根据公式算出均质指数[1]。脂肪上浮率的测试及计算方法同均质指数,只是保藏温度和天数要求不同,便于特性描述,统称为脂肪上浮率。
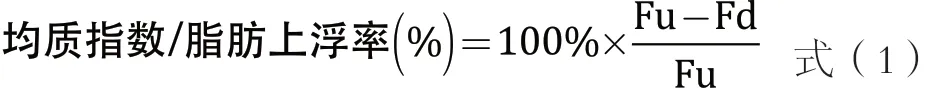
式(1)中,Fu为上层脂肪;Fd为下层脂肪。脂肪检测采用FOSS多功能乳品分析仪,快速分析读取,仪器分析样品前均经过有效校准。
1.2.2 不稳定性相关参数分析评价
代表性选取上述市售巴氏杀菌乳产品A1/屋顶盒(保藏8 d)、A1/屋顶盒(保藏2 d)、B/屋顶盒(保藏8 d)、C1/PET(保藏2 d)、C1/PET(保藏1 d)、F/PET(保藏5 d),分别标记为样品1、样品2、样品3、样品4、样品5、样品6。参考文献[7~9]所述方法,无菌环境下小心移取30 mL沿瓶壁小心注入到无菌样品瓶中,设置好程序后,将装了产品的样品瓶放至样品池中,设置稳定性分析参数:10 ℃恒温条件下扫描测试48 h,间隔1 h扫描1 次,根据扫描得到的背散射光曲线、TSI曲线、颗粒粒径(系统计算时设置连续相的折光率为1.33,分散相的折光率为1.45)及根据公式推算样品的均一性特征性参数对样品的稳定性进行分析评价。其中样品的均一性参数通过首次扫描取得的背散射光值(高度=10 000~30 000 μm范围)的样本标准偏差表示,标准偏差越大样品均一性越差,反之,样品标准偏差越小样品均一性越高。
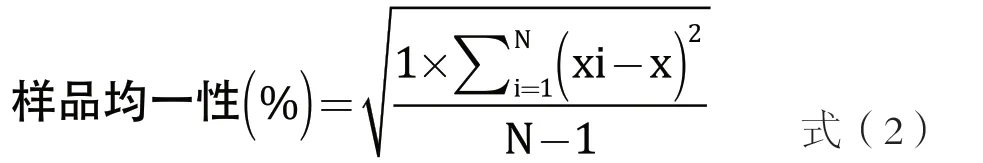
式(2)中,Xi为样本某一高度层首次扫描的背散射光值;X为所截选的10 000~30 000 μm较为稳定的区间的背散射光的平均值;N为选定样本区间扫描的总次数。
2 结果与分析
2.1 不同条件对巴氏杀菌乳脂肪上浮率的影响
2.1.1 不同贮藏条件对脂肪上浮率的影响
基于表1作图1,如图1所示,巴氏杀菌乳产品储藏于10 ℃时的脂肪上浮率高于4 ℃时的情况,其中C1、C2、E、F上浮情况较其他产品高;随着保藏时间的推移,脂肪上浮程度加剧,4 ℃和10 ℃保藏12 d脂肪上浮率最高,分别达到18.13%、22.45%;其中贮藏在透明PET瓶装包装中的巴氏杀菌乳的乳脂率比屋顶盒包装的高且脂肪上浮情况更显著,推测是PET瓶装材料的不避光性、乳脂率高以及乳液面的横截面更窄等综合因素造成的以上结果。
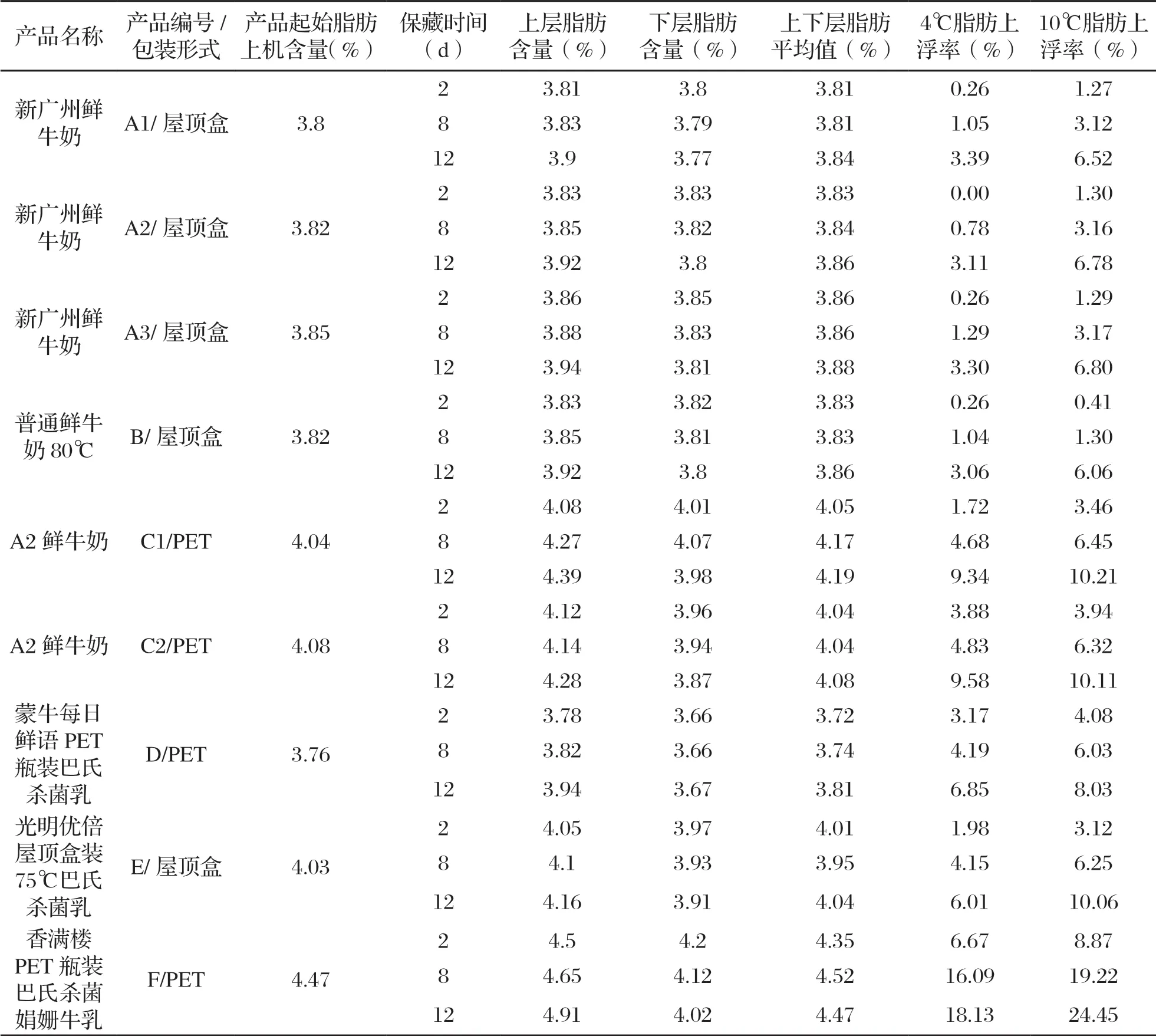
表1 保藏在4 ℃、10℃条件下的巴氏杀菌乳的脂肪上浮率
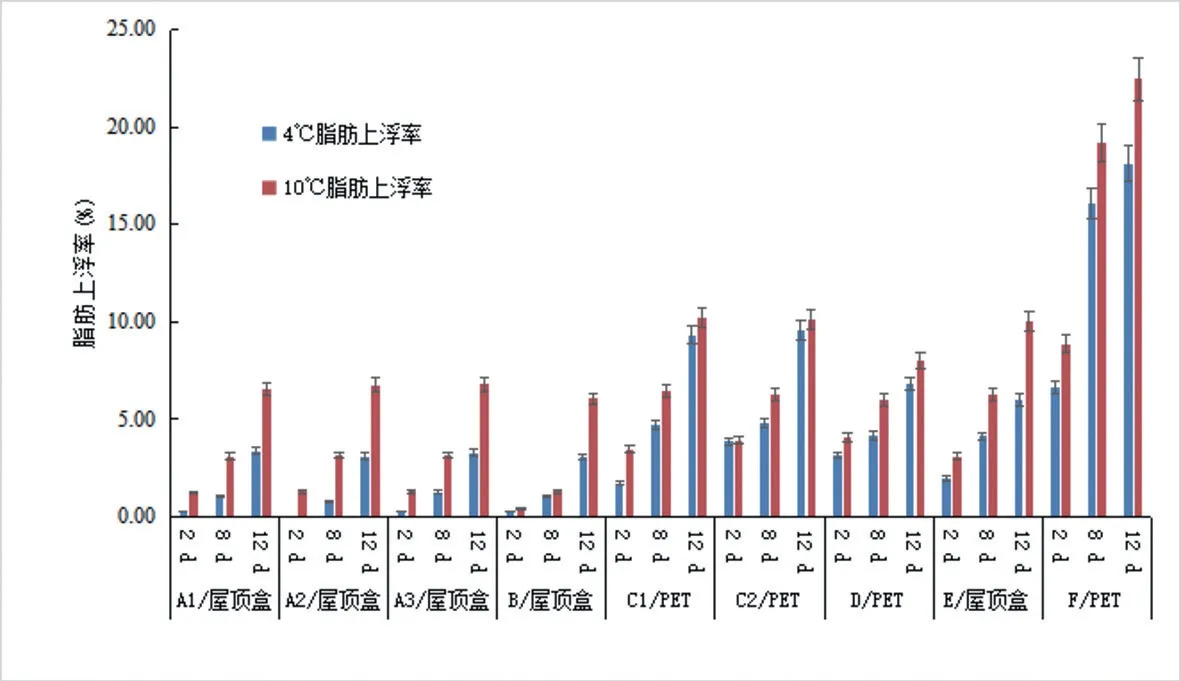
图1 不同贮藏条件对巴氏杀菌乳的脂肪上浮率的影响
2.1.2 不同杀菌温度对巴氏杀菌乳脂肪上浮率的影响
如图1所示,包装形式规格相同的乳脂率水平相当的A1/屋顶盒、A2/屋顶盒、A3/屋顶盒(75℃杀菌的新广州鲜牛奶)和B/屋顶盒相比较(80℃杀菌的普通鲜牛奶),B/屋顶盒产品的脂肪上浮率显著低于A1/屋顶盒、A2/屋顶盒、A3/屋顶盒。推测在60~95 ℃相对较低的巴氏杀菌温度范围内,脂肪上浮速度随温度的升高而降低,可能杀菌温度低的产品中的蛋白质变性程度更低,与脂肪、多糖、乳矿物盐等物质形成的复合体更不稳定。
2.1.3 不同脂肪含量对巴氏杀菌乳脂肪上浮率的影响
不计较各产品的包装形式及杀菌温度,以各产品的初始乳脂率为横坐标轴,以产品的脂肪上浮率为纵坐标轴,不同保藏天数和保藏温度对应的产品脂肪上浮率数据分别通过二项式拟合生成如图2(基于表1数据)所示的曲线。从中可以看出,随着脂肪含量的增加,脂肪上浮率整体均呈现加剧的趋势;同等保藏天数的情况下,保藏温度为10 ℃的脂肪上浮情况更严重;同等保藏温度条件下,保藏时间越久脂肪上浮情况越严重。推测是脂肪含量高,脂肪球之间的间距更小,分子运动过程中更容易聚集成粒径更大的脂肪球,脂肪球的浮力相应增大,出现更显著的上浮现象。
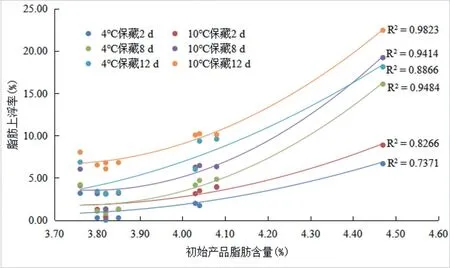
图2 脂肪含量对巴氏杀菌乳的脂肪上浮率的影响
2.2 对产品不稳定性相关参数的影响
如图3所示,横坐标轴表示样品测试室高度,其中有信号段表示牛奶样品液面所占的高度,纵坐标轴△T和△BS分别表示透射光和背反射光的强度变化值,曲线表示不同时间观察点牛奶体系的背反射光强度变化情况。全部样品的背散射光的参比谱图均显示有底部的波谷和顶部的波峰,分别提示对应底部的背散射光变小,存在脂肪上移至其他区域至底部变澄清的趋势;而顶部的背散射光则是变大,存在脂肪迁入堆积在顶部至顶部脂肪微粒聚集成大粒径脂肪球的趋势。在样品观察时间的48 h内,所有样品测试室底部0~1.4 mm 处的BS(%)随时间的推移形成一个向上的小凸峰,但峰值并不呈递增趋势,而是处于波动状态;底部1.4~4.0 mm 处,BS(%)随时间逐渐降低,峰值由0%逐渐降低至-(5.00~10.00)%;中间段4.0~41.0mm 的BS(%)随时间降低很小,仅为-(0.48~1.00)%,但近样品测试室顶部的变化率要远远高于近底部的变化率;顶部41.0~44.0 mm的BS(%)则随时间的推移逐渐增加由0%逐渐增加至(8~25)%,样品5的顶部BS(%)增加水平最低,其次是样品6、样品4、样品2、样品3、样品1,该结果提示对应产品的顶部不稳定性指数情况排序:样品5<样品6<样品4<样品2<样品3<样品1,与表3结果基本一致。
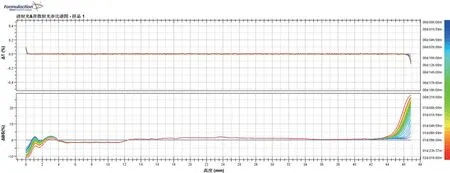
图3 样品1代表性巴氏杀菌乳产品的透射光及背散射光变化曲线
根据反射物理模型,说明底部0~1.4 mm 处的峰有可能是由于蛋白质沉淀所引起的;底部1.4~4.0 mm处的脂肪颗粒聚集并产生一定的上浮现象,造成底部的体积浓度(φ)减小以及平均粒径(d)减小;中间段4.0~41.0 mm 的脂肪颗粒主要以聚集为主、上浮现象不是很显著,但近测试室底部的样品变化强度要低于接近顶部的变化;由于底部及中间段的粒径较大的脂肪颗粒迁移至顶部,造成顶部41.0~45.0 mm 处的局部φ和d均增加,但可能由于φ增加程度较d 增加程度更为显著,导致观察时间内BS(%)逐渐增加[3]。
2.2.1 不稳定性指数的影响
据表3作图,如图4所示,全部样品的不稳定性指数TSI均大于0.5,处于较不稳定的状态,其中,样品5[C1/PET(保藏1 d) ]的相对稳定性最佳,其次是样品4[C1/PET(保藏2 d)]、样品6[F/PET(保藏5 d)]、样品3[B/屋顶盒(保藏8 d)]、样品2[A1/屋顶盒(保藏2 d)]、样品1[A1/屋顶盒(保藏8 d)],同类产品对比可知:样品2的整体不稳定性指数低于样品1,但差异不显著;样品5的整体不稳定性指数低于样品4;提示产品保藏时间越久乳浊液体系越不稳定。样品6的整体不稳定指数最接近于样品3,且顶部和底部不稳定性指数低于样品1、样品2和样品3,中部不稳定性高于其他组别,提示可能存在样品6顶部聚集大量脂肪以及底部移走部分脂肪后形成的顶部和底部体系更稳定,中部受脂肪迁进迁出滞留影响较大,而其他样品脂肪聚集迁移速度慢,未达稳定状态前有持续脂肪上浮的现象。
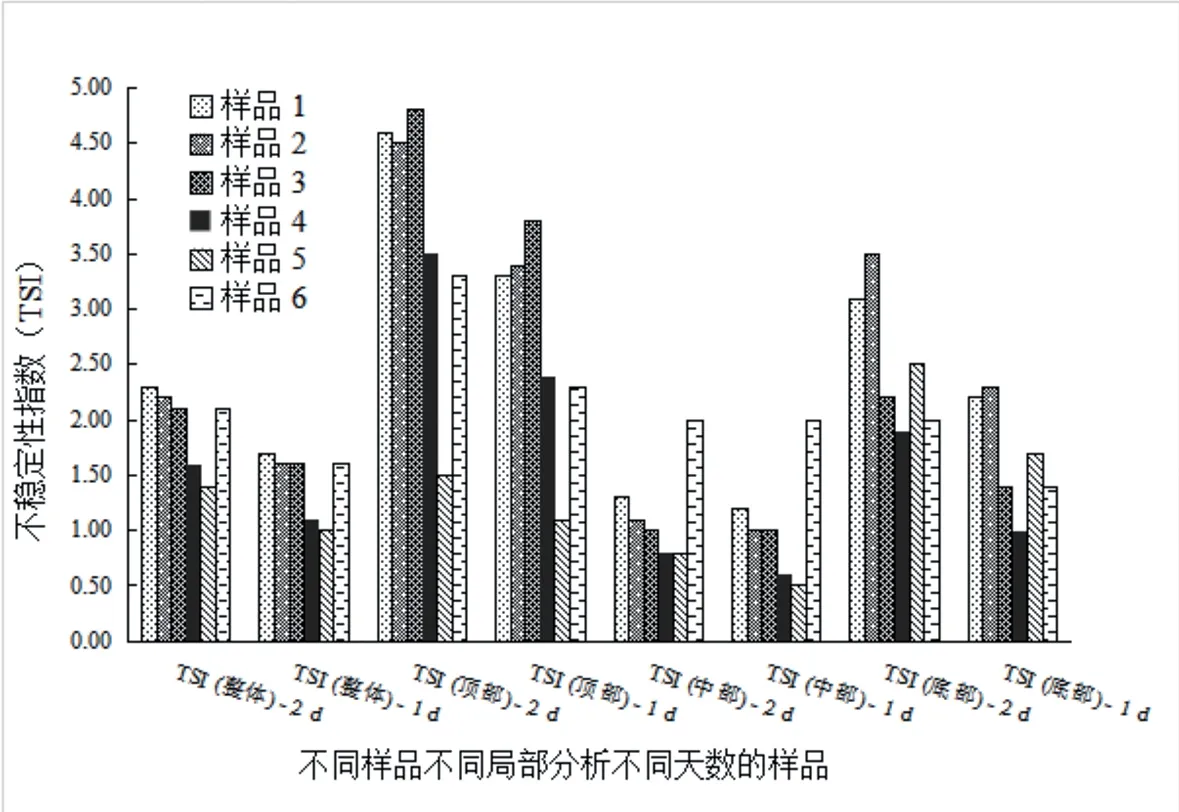
图4 10℃加速贮藏条件下对巴氏杀菌乳不稳定性指数的影响
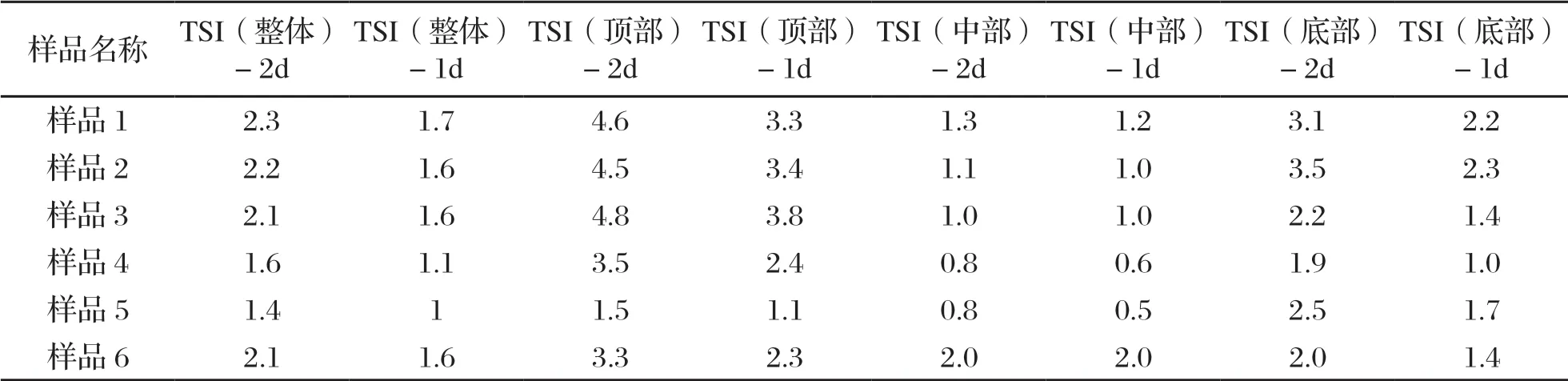
表3 保藏在10 ℃条件下的巴氏杀菌乳的不稳定性指数分析
2.2.2 粒径的影响
提取背散射光图谱中的原始首次扫描曲线并提取相应的扫描数据做统计学分析后,显示样品1粒径最小为0.175 μm,样品6粒径最大为0.201 μm,其他样品粒径相近为0.179~0.181 μm。样品1~样品6的平均粒径分别为0.17 μm、0.18 μm、0.18 μm、0.18 μm、0.18 μm、0.20 μm,图5显示样品1和样品6的粒径随时间变化的程度较大,提示样品1和样品6体系的稳定性比其他体系差,样品粒径过大或过小均存在不稳定风险。
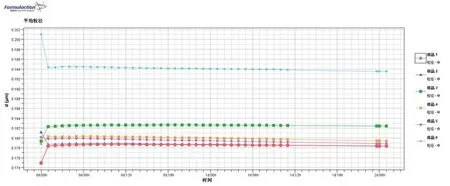
图5 10 ℃保藏温度条件下样品粒径随保藏时间推移的变化
2.2.3 初始样品均一性的对比
如表4所示,初始样品1的选定区间背散射光值的标准偏差最大,提示均一性最差,其次是样品5、样品2、样品6、样品4、样品3。提示样品越新鲜样品的均一性越好,放置时间越久受脂肪上浮和蛋白质沉淀影响样品越不均匀。

表4 初始各巴氏杀菌乳样品的均一性(以样本标准偏差值给出)
2.2.4 初始样品分散率的对比
经多重光分析处理得初始样品1~6的分散率分别为28.59%、27.6%、27.88%、27.96%、27.76%、24.88%,样品1的分散度最高,样品6的分散度最低。其他样品分散率无显著性差异。
3 结论与展望
通过对部分市售巴氏杀菌乳产品进行脂肪上浮宏观和多重光散射的微观对比分析后,最终确认了产品的稳定性的影响因素有脂肪含量、保藏时间、保藏温度、产品粒径、杀菌温度。其中,产品的新鲜度影响最大,代表因素是保藏时间和保藏温度,其次是脂肪含量、产品粒径及杀菌温度。现代化的加工手段虽然可以延长货架期,但是脂肪上浮仍然带给消费者不良的感官感受,未来随着牧业、乳业、物流等产业链的高速发展,乳制品追求极致新鲜是乳品行业公认的最高目标,奶源和加工厂均在消费者身边,做更短保质期的巴氏杀菌乳将是未来的发展趋势。未来应当着力控制产品终端的温度,缩短低温巴氏杀菌乳的货架时间,标准化产品的脂肪含量,以提高终端巴氏杀菌乳产品的综合感官品质。

