溶胶-水热法制备TiO2及其晶型结构的调控
游 兰,郑汶江,邹 伟
(四川轻化工大学化学工程学院,四川 自贡 643000)
引 言
二氧化钛(TiO2)作为一种光催化剂,具有无毒、成本廉价、无二次污染等优点,被广泛应用于废水处理、空气净化、太阳能电池、紫外线吸收和杀菌消毒等领域[1-2]。由于其特殊的纳米晶体结构,在催化反应时能表现出优异的光稳定性和反应活性,可以充分利用太阳能,既高效节能又环保。TiO2的光催化活性与其晶体结构有关[3-7],目前常用的制备方法包括溶胶-凝胶法(SG)、水热法(HT)和溶剂热法(ST)[8-10]。
SG 法是通过将无机钛盐或有机钛醇盐溶于有机溶剂中形成均相溶液,控制钛盐水解、缩聚反应形成溶胶,溶胶陈化形成凝胶,进一步加热干燥并煅烧制得TiO2晶体。张伟等[11]以异丙醇和钛酸四丁酯为原料,经溶胶-凝胶法(SG)制备了多壁碳纳米管/二氧化钛(MWNT/TiO2)复合纳米光催化剂,研究了煅烧时间、煅烧温度、溶胶体系pH 值等因素分别对MWNT/TiO2光催化性能的影响。但该制备方法在煅烧过程中会出现团聚,晶相发生了不可控转变等现象。HT法以含水溶液为反应溶剂,以固体粉末或新制备的凝胶作为前驱体,通过对反应体系加热产生蒸气压,形成高温、高压的反应环境,使难溶或不溶的物质溶解并重结晶。该过程无需高温煅烧晶化,能够避免再次团聚的现象。阎文静等[12]以丙酮溶液水解TiCl4,采用水热法研究了反应时间、温度等条件对氟掺杂TiO2结构和光催化性能的影响。但由于钛源极易水解,在制备过程中难以控制水解速率,未能达到晶型结构和比例调控的目的。ST 法是以有机溶剂作为反应介质,在高压反应釜中进行。与HT 法相比,ST 法可选择的原料范围大,在亚临界或超临界状态下,非水溶剂特定的物理化学性质使制备目标产物的范围扩大。Yu 等[13]采用溶剂热法,将纯的TiO2(纯度99.9%)和蒸馏水放入高压釜,在375 ℃下反应24 h,首次得到了锐钛矿和金红石的混合相。任峻廷[14]通过ST 法制备出纳米TiO2,并探究了溶剂热温度、煅烧温度、煅烧时间等不同制备条件对其光催化性能的影响。代国宾等[15]采用ST热法制备了白色TiO2花状纳米球,研究了不同的TiO2前驱体预处理条件对退火后TiO2性能的影响。Sun 等[16]在不同溶剂热条件下自组装合成了一系列形状、尺寸和晶体结构连续可调的TiO2,研究了不同实验条件对TiO2纳米结构的影响。除此之外,Ma等[17]采用无定形TiO2与金红石TiO2通过物理混合物煅烧制备锐钛矿-金红石偶联TiO2光催化剂。但在高温条件下,无定形TiO2和锐钛矿向金红石构型的转变难以控制。
因此,通过调整、优化实验参数可控调节晶体结构,对于TiO2光催化领域的发展至关重要。但目前仍然缺乏这方面的系统研究。本文采用溶胶-凝胶法和水热法相结合的溶胶-水热法(SHT),克服溶胶-凝胶法中煅烧过程的缺陷,并且利用高温高压条件增强形成的凝胶的溶解效果。
1 实验部分
1.1 试剂和仪器
钛酸四正丁酯(TNBT,CP,质量分数≥98.0%),国药集团化学试剂有限公司;乙二醇(EG,AR,质量分数≥99.5%),国药集团化学试剂有限公司;丙酮(AR,质量分数≥99.5%),重庆川东化工(集团)有限公司;无水乙醇(GR,质量分数≥99.8%),国药集团化学试剂有限公司;硫酸(AR,质量分数为95.0%~98.0%),重庆川东化工(集团)有限公司;异丙醇(CP,质量分数≥98.5%),国药集团化学试剂有限公司。
DLS-750S型双工位手套箱,成都德力斯实业有限公司;RO 5 型磁力搅拌器,德国IKA 集团;BLGHX-V型光化学反应仪,上海比朗仪器制造有限公司;Thermo Scientific Apreo2C 扫描电子显微镜(SEM),复纳科学仪器(上海)有限公司;Bruker D8 ADVANCE 广角X 射线衍射仪(XRD),德国布鲁克有限公司;3H-2000PM2 型贝士德比表面及微孔分析仪,贝士德仪器科技(北京)有限公司。
1.2 TiO2材料的制备
移取0.10 mL TNBT和10 mL EG,放在手套箱中(真空状态)室温下搅拌8 h,使体系完全均一。随后加入20 mL 丙酮、一定量的无水乙醇(0、0.18、0.88、1.75 mL 与2.63 mL)和98%的硫酸(0.05、0.10、0.15、0.20 mL 与0.25 mL),继续搅拌4 h。将混合物移入聚四氟乙烯内衬的高压釜中,并在设定的反应温度(60、90、120、150 ℃与180 ℃)下反应一定的时间(3、6、9、12、15 h 与20 h)。通过离心收集形成的沉淀物,用异丙醇洗涤数次。固体产物在室温下干燥24 h。
1.3 实验表征
1.3.1 TiO2微球形貌表征
使用Thermo Scientific Apreo2C 扫描电子显微镜对样品进行形貌的测定。将上述所得样品,称取少量粉末分散于无水乙醇中进行超声处理,用移液枪取样品超声后的悬浊液,滴一滴于导电胶上,自然风干/红外灯烘干,烘干后将导电胶粘在样品台上做喷金处理,最后进行样品的形貌测试。
1.3.2 X-射线衍射(XRD)表征
称取一定量的TiO2粉末,用研钵将样品研磨成适合衍射实验用的粉末,将研磨后的样品粉末装填在有开槽的平整玻璃板或者塑料板上,用载玻片轻轻压平,使其上表面平整,看不到明显的颗粒物存在,最后将载有样品的玻璃片放入X-射线衍射仪中,广 角 衍 射-Cu 靶(5°~85°),扫 描 速 度 为8.5(°)/min。
1.3.3 光催化性能测试
称取一定量的TiO2粉末,分散于罗丹明B(RhB)溶液中(1 mg/1 mL RhB),超声后暗态搅拌10 min以保证粉体与溶液充分接触。在光化学反应仪紫外光的作用下,观察不同时间段内RhB 的脱色效果,通过紫外光谱法测定RhB 浓度随时间的变化。
1.3.4 比表面积(SBET)测试
在3H-2000PM2型贝士德比表面及微孔分析仪仪器上测定氮吸附-解吸等温线。分析前,所有样品在200 ℃下脱气120 min,在P/P0= 0.0400~0.3200的范围内,采用Brunauer-Emmett-Teller(BET)方法评价比表面积(SBET)。
2 结果与讨论
2.1 TiO2微球的制备
制备TiO2微球反应过程如式(1)~(4)所示。在TiO2微球制备过程中,乙二醇具有两个重要作用:(1)与TNBT 反应生成钛醇配合物(化学式(1)),为进一步水解产生Ti(OH)4做准备;(2)与丙酮在硫酸的催化下生成水(化学式(2)),为钛醇配合物的水解提供反应底物。钛醇配合物与水反应,生成Ti(OH)4(化学式(3)),其进一步脱水得到TiO2(化学式(4))。
2.2 溶剂乙醇用量对TiO2微球粒径的影响
由于钛醇配合物水溶性较差,为了使其与水更均匀地反应,控制水解速率,采用能同时溶解钛醇配合物和水的乙醇作为溶剂。在H2SO4用量为0.15 mL,反应温度为180 ℃,反应时间为6 h 时,调节溶剂乙醇的用量,研究其对制备的TiO2微球形貌的影响,结果如图1 所示。由图1 可以看出,随着乙醇用量由0 增加至2.63 mL,TiO2的粒径变化不大,主要在200~300 nm 之间。但未添加乙醇作为溶剂时,TiO2的粒径分布较宽,而随着乙醇用量的增加,微球的粒径分布逐渐变窄。这主要归因于乙醇用量的增加,提高了钛醇配合物和水在反应体系中的均匀分散程度,使体系中水解反应更均匀,最终形成的TiO2微球粒径差异程度减小,因此粒径分布更窄。

图1 不同乙醇量下TiO2的粒径分布
2.3 H2SO4用量对TiO2微球形貌的影响
反应体系中,H2SO4的用量主要影响水的生成,进而影响钛醇配合物的水解以及TiO2微球的形貌。在乙醇用量为2.63 mL的条件下,调节H2SO4的用量由0.05 mL 增加至0.25 mL,制备TiO2微球,结果如图2 所示。当H2SO4用量较低(0.05 mL)时,制备得到的TiO2微球表面较光滑,粒径大小均匀;随着H2SO4用量的增加,TiO2微球粒径逐渐增大,粒径大小不均匀,且伴随有大量絮状沉淀围绕着TiO2微球。这是由于H2SO4在反应体系内是作为丙酮和乙二醇缩酮反应生成水的催化剂,随着H2SO4用量的增加,其强吸水性会导致反应生成的水又被浓H2SO4吸收掉,从而无法使水参与到TNBT的水解反应中,导致产生大量未成核的絮状沉淀。当H2SO4量的增加到0.25 mL 时,体系内的水全部被吸收,导致TNBT完全无法水解,未见TiO2微球形成。

图2 不同H2SO4量对TiO2微球形貌的影响
2.4 反应温度对TiO2微球形貌的影响
反应温度对体系的热稳定性影响至关重要,它一方面影响钛醇配合物Ti( )OCH2CH2O2的水解速率,另一方面还影响前驱体TNBT 长大成核的速率。这是因为反应温度升高,Ti( )OCH2CH2O2的水解速率加快,溶液中的钛氧八面体(TiO6)组成的构晶单元(TiO6)n的浓度增大,TiO6的饱和溶解度降低,成核粒子数少而倾向于粒子的长大;相反,当温度低时,TiO6浓度较小,饱和溶解度增大,粒子长大少而倾向于成核。一般认为TiO2纳米晶的成核速率曲线与生长速率曲线并不是完全重合的,在高温下晶体成核速率要远大于晶体的生长速率[18-21]。如图3所示,随着反应温度的升高,所制备的TiO2颗粒为均匀的球体,粒径在2000~3000 nm 之间,相比于以乙醇为变量制备的TiO2粒子的粒径要大10倍左右,但是其分散性更好。

图3 不同反应温度对TiO2微球形貌的影响
2.5 反应时间对TiO2微球的影响
为了更好地理解TiO2微球的成核与生长过程,进一步研究了反应时间对TiO2微球的影响。如图4所示,随着反应时间的不断增加,TiO2颗粒不仅表面发生了明显的变化,而且粒径越来越大。由3 h 时平均粒径为400 nm 的均匀颗粒,逐渐演变为6 h 的600 nm 颗粒,甚至出现了粒径达1000 nm 的颗粒。不同反应时间TiO2的SBET 见表1,反应时间为3 h时TiO2的SBET 仅为25 m2·g-1左右;随着反应时间延长至9~12 h,TiO2微球进一步长大,SBET 也增加到120 m2·g-1左右;15 h以后大部分颗粒变成了雪花状,但是还能分辨出形貌为球形,反应时间增加到20 h时,TiO2颗粒已经完全变成雪花状,并且发生严重的团聚,SBET 增加至237 m2·g-1。这种现象遵循Ostwald 成熟机制[22-25](见图5),溶液中较小的粒子有更高的溶解度和表面能,这些粒子会重新溶解,从而使较大的粒子进一步长大,随着反应时间的增加,颗粒逐渐粘连在一起,也就变成了图4中扫描电镜(SEM)图里面的针状或者雪花状。

图4 不同反应时间下TiO2的SEM图及粒径分布

图5 以反应时间为变量的Ostwald 纳米粒子成熟生长机制
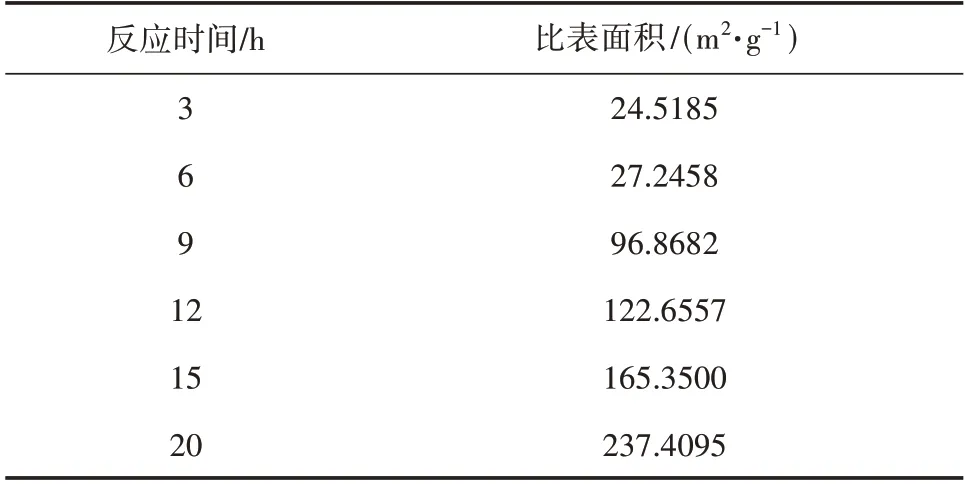
表1 不同反应时间下TiO2的SBET
2.6 不同反应条件对TiO2微球结构的影响
TiO2的制备条件对晶型结构影响如图6 所示。由图6(a)可以看出,在反应温度为180 ℃、反应时间为6 h、H2SO4加入量为0.15 mL 条件下,随着乙醇加入量的增加,TiO2的结晶峰逐渐变强,TiO2的晶体结构由非晶态逐渐转变为锐钛矿(2θ= 25.37°)和金红石(2θ= 27.48°)的混合相,其中锐钛矿含量由43.5%增加到63.6%,金红石含量由56.5%减少到36.4%,结果见表2。乙醇作为反应体系的溶剂,其加入量和反应体系有关,随着乙醇含量的增加,提高了钛醇配合物和水在反应体系中的分散度,使体系中的水解反应更均匀,结晶度逐渐增大。

表2 不同乙醇用量下TiO2不同晶型的含量
催化剂H2SO4的用量对TiO2结构的影响如图6(b)所示。从图6(b)中可以看出,在乙醇加入量为2.63 mL、反应温度为180 ℃、反应时间为6 h条件下,随着H2SO4加入量的增加,TiO2粒子中锐钛矿和金红石的峰强度增加,表明结晶度增大。这是由于,当H2SO4加入量较少时,H2SO4混合在体系生成的水中形成酸溶液。在酸溶液中,Ti(O CH2CH2O)2中第一个—OCH2CH2O—水解被置换成OH-,Ti 原子附近的电负性减弱,第二个H+进攻能力减弱,导致第二个—OCH2CH2O—的水解更难,生成Ti( OH )4单体的浓度低,从而结晶度不高。随着H2SO4加入量增大,反应体系酸性增大,钛醇配合物Ti( )OCH2CH2O2的水解增强,TiO2的结晶得到增强。但是,由图6(b)可知,当H2SO4量增加至0.20 mL 时,TiO2由锐钛矿和金红石的混合相转变为非晶态。这是因为,随着H2SO4加入量的增加,其吸水性逐渐显露,导致体系中的水不够TNBT 水解,从而当H2SO4加入量达到0.20 mL以后,无法得到结晶态的TiO2。
反应温度对TiO2晶体结构的影响如图6(c)所示,当反应温度低于90 ℃时,没有明显的TiO2的结晶峰,表明低温时样品主要以非晶状态存在。当反应温度为120 ℃时,金红石的衍射峰(2θ= 27.48°)出现,金红石含量为100%。随着温度升高到150 ℃,锐钛矿的衍射峰(2θ= 25.37°)也显现出来,此时锐钛矿含量为61.6%,金红石含量为38.4%。随着温度升高至180 ℃,锐钛矿含量继续增大至74.7%,金红石则继续降低至25.3%。不同温度下生成锐钛矿与金红石含量具体见表3。由此可知,温度较低时,TiO2以金红石为主,随着温度升高开始形成金红石和锐钛矿的混合晶型,且锐钛矿的含量随着温度的升高持续增大,这主要是由于金红石结构所需的能量更低,而生成锐钛矿结构所需的能量更高[26-27]。

表3 不同反应温度下TiO2不同晶型的含量
反应时间对TiO2颗粒结构的影响如图6(d)所示。从图6(d)中可以看出,不同反应时间下,TiO2材料均为锐钛矿和金红石相的混合相。随着反应时间的增加,锐钛矿和金红石的衍射峰相对强度基本保持不变,表明反应时间对锐钛矿和金红石的比例影响不大。

图6 不同反应条件对TiO2微球结构的影响
2.7 不同反应条件对TiO2微球催化性能的影响
在反应温度为180 ℃、反应时间为6 h、H2SO4加入量为0.15 mL 条件下,以RhB 为底物,不同乙醇用量制备的TiO2微球的光催化活性如图7(a)所示。从图7(a)中可以看出,随着乙醇加入量的增加,TiO2颗粒的光催化性能显著提升,当乙醇用量为2.63 mL时,RhB 溶液在40 min 的光催化作用下浓度降低至初始浓度的15%。而未使用乙醇作溶剂的条件下制备的TiO2颗粒仅能使RhB 降低至初始值的85%。这是因为在乙醇用量多的条件下,TiO2颗粒晶型结构为锐钛矿和金红石的混合相,具有较强的光催化活性;而不使用乙醇作溶剂时得到的TiO2为非晶态,几乎不具备光催化活性。
在反应时间为6 h、乙醇加入量为2.63 mL、H2SO4加入量为0.15 mL 条件下,不同反应温度制备的TiO2颗粒对RhB 的光催化活性如图7(b)所示。在低反应温度时(60 ℃与90 ℃),TiO2颗粒为非晶态(图6(c)),不具备光催化活性,图中RhB 浓度的降低主要归因于TiO2颗粒对染料分子的吸附;反应温度升高,TiO2颗粒由金红石转变为金红石和锐钛矿的混合相,光催化活性也进一步增强。TiO2是一种宽禁带n 型半导体,其能带结构一般由低能价带(VB)和高能导带(CB)组成,其中价带内填满了电子,导带是空的,它们之间存在禁带。当TiO2吸收能量等于或大于其禁带宽度(Eg)的光子后,处于VB 的电子(e-)被激发跃迁到CB 形成光生电子,同时在价带上产生相应的空穴(h+)。光生电子和空穴在电场作用下分离、迁移到TiO2表面,从而产生具有高度活性的电子-空穴对[28]。尽管金红石和锐钛矿都属于正交晶系,但两者的TiO6八面体的扭曲程度不一样,金红石的八面体为近乎完美的正交晶系,其扭曲很小,而锐钛矿其八面体有严重的扭曲,对称性较差,其电子-空穴分离能力更强,光催化活性更高。当反应温度升高至180 ℃,此时TiO2中锐钛矿与金红石的含量比为3∶2,锐钛矿的晶化程度高,光生电子和空穴电荷越易分离,对RhB 的降解效果最佳。
在乙醇加入量为2.63 mL、H2SO4加入量0.15 mL、反应温度180 ℃条件下,不同反应时间制备的TiO2颗粒的光催化活性如图7(c)所示。从图7(c)中可以看出,随着反应时间的增加,所制备的TiO2对RhB 的光催化活性逐渐增强。这是由于随反应时间的增加,TiO2逐渐由光滑的球状转变为表面粗糙的雪花状,比表面积逐渐增大(图5),这种结构有利于染料分子在TiO2颗粒表面快速吸附,提升了光催化降解反应的速率,因此反应时间为20 h 的TiO2颗粒具有最高的反应活性。

图7 不同反应条件对TiO2微球催化性能的影响
3 结 论
以乙二醇和钛酸四正丁酯反应生成的钛醇配合物为钛源,水解制备TiO2颗粒。通过调控溶剂乙醇、催化剂H2SO4的用量、反应温度和反应时间等条件,实现TiO2形貌和晶型的调控,并对其光催化活性进行研究,得到以下结论:
(1)以乙醇为溶剂,能够提升钛醇配合物与水在体系中分散的均匀性,使体系中水解反应得到有效的控制,提高了TiO2颗粒的粒径均匀性和锐钛矿的含量。
(2)适量H2SO4的使用能催化体系中丙酮和乙二醇的反应,生成可供钛醇配合物水解的水分子,同时酸性条件能促进钛醇配合物的水解。
(3)随着反应温度的升高,制备的TiO2颗粒由非晶态逐渐转变为金红石,最后转变为金红石和锐钛矿的混合晶态,并且锐钛矿的含量随温度的升高而增大,其光催化活性也随之明显增强。
(4)反应时间的延长对TiO2颗粒的晶体结构和比例影响不大,但有利于增大其比表面积,从而进一步促进其光催化性能。
——以金红石为例

