透明质酸对大鼠胃黏膜损伤的保护作用研究
刘 磊,张美霞,廉少杰,康传利,汤丽伟,刘 蔷,张梦益,李 庆
(山东焦点福瑞达生物股份有限公司,山东 曲阜 273100)
胃病的发生与胃黏膜损伤密切相关,胃黏膜受损将加快病情进展。导致胃黏膜损伤的主要因素包括物理因素和化学因素[1]。其中,长期进食过热或过冷的食物、烈酒、浓茶或刺激性药物如消炎痛(吲哚美辛肠溶片)等,均使胃内黏液减少,引起黏膜微循环障碍,削弱脂蛋白膜对胃的保护作用[2]。临床治疗中,西药治疗虽有一定疗效,但停药后易复发,长期使用毒副作用大。天然活性物质因其长效、温和、低毒副作用等诸多优势越来越得到重视。
透明质酸(HA)又称玻璃酸、玻尿酸,广泛存在于生物体内[3],常见形式是透明质酸钠(SH)。研究表明,HA有调控细胞与细胞间的黏附、分化,促进细胞的增生与移动等活性,并参与保湿润滑、伤口愈合、组织修复和再生、胚胎发育等生物进程[4]。因此,HA被认为是最具有生物发展前景的生物活性物质之一[5]。为考察HA对胃黏膜损伤的保护作用,本实验通过设计酒精性急性胃黏膜损伤模型、消炎痛性胃黏膜损伤模型和冰醋酸注射法胃黏膜损伤模型实验并予以实施,为HA的进一步应用提供实验基础及参考依据。
1 材料与方法
1.1 材料与仪器
1.1.1 动物和试剂 SPF级SD健康大鼠,雄性,5~7周龄,购自济南朋悦实验动物繁育有限公司,实验动物生产许可证号:SCXK(鲁)20190003,使用许可证编号:SYXK(鲁)2018 0031,饲养条件符合饲养环境条件标准GB14925-2010要求。
SH由山东焦点福瑞达生物股份有限公司提供,平均相对分子质量为1.05×106,硫酸-咔唑法测定SH含量为98.6 %。无水乙醇(分析纯,国药集团化学试剂有限公司),冰醋酸(分析纯,国药集团化学试剂有限公司);硫糖铝口服混悬液(批号201225,广东华南药业集团有限公司)、吲哚美辛肠溶片(批号210101,广东华南药业集团有限公司)。
1.1.2 仪器和设备 LE203E/02电子天平、ACS-JJTiger电子秤(梅特勒-托利多仪器(上海)有限公司);电子数显卡尺(哈尔滨量具刃具集团有限公司);微量进样器(上海高鸽工贸有限公司);Honeywell EBI环境监控系统。
1.2 实验方法
1.2.1 实验动物饲养及分组处理 实验大鼠饲养在山东省药学科学院新药评价中心,温度为22±2 ℃,昼、夜明暗交替时间为12 h/12 h。动物实行分笼饲养,每笼5只,自由饮水、进食。适应性喂养5 d后分组,每组10只动物,剂量设计见表1。

表1 剂量设计表
根据国家卫健委2020年第9号公告要求,SH正式纳入新食品原料目录,公告中SH推荐食用量≤200 mg/d(约合3.33 mg/kg),根据《对胃黏膜损伤有辅助保护功能检验方法》规定,受试物应有一个人体推荐剂量的5倍剂量组,故设SH低、中、高剂量组为16.7,33.3,100 mg/kg,分别是人体推荐剂量的5倍、10倍和30倍。阳性对照组采取硫糖铝口服混悬液,硫糖铝口服混悬液临床使用最大日剂量为8 g/d,折算大鼠等效剂量约为833 mg/kg。考虑操作的可行性,将大鼠灌胃剂量设为1000 mg/kg。
1.2.2 胃黏膜损伤模型建立
1.2.2.1 酒精性急性大鼠胃黏膜损伤模型:各剂量组动物给予受试物30 d后,全部动物严格禁食24 h(不禁水),此期间禁止给予受试物。除正常对照组外,所有实验组动物给予无水乙醇1.0 ml/只,1 h后麻醉处死全部动物。剖开腹部,暴露完整胃,结扎幽门,灌注适量10 %甲醛溶液,固定20 min,然后沿胃大弯剪开,洗净胃内容物,展开胃黏膜,肉眼下用游标卡尺测量出血点或出血带的长度和宽度,并对胃黏膜损伤进行评分。大体检查完毕,将每只动物胃黏膜损伤最严重的部位切下,固定于10 %甲醛溶液,进行组织病理学检查[6]。
1.2.2.2 消炎痛致大鼠胃黏膜损伤模型:各剂量组动物给予受试物30 d后,全部动物严格禁食24 h(不禁水),此期间禁止给予受试物。除正常对照组外,所有实验组动物一次性腹腔注射消炎痛40 mg/kg(吲哚美辛肠溶片),5 h后麻醉处死全部动物。剖开腹部,暴露完整胃,结扎幽门,灌注10 %甲醛溶液5 ml/只,固定20 min,然后沿胃大弯剪开,洗净胃内容物,展开胃黏膜,肉眼下用游标卡尺测量出血点或出血带的长度和宽度,并对胃黏膜损伤进行评分。大体检查完毕,将每只动物胃黏膜损伤最严重的部位切下,固定于10 %甲醛溶液,进行组织病理学检查[7]。
1.2.2.3 冰醋酸致大鼠慢性胃黏膜损伤模型:动物禁食不禁水24 h后,麻醉后消毒腹部,于剑突下切开腹腔,将胃轻拉出腹腔外,用微量注射器于胃幽门处浆膜下注射30 μl 30 %冰醋酸,缝合切口,术后正常喂食和水。第二天选取术后状态良好的50只动物根据体重按普通拉丁方法分为模型对照组、阳性对照组、SH低剂量组、SH中剂量组和SH高剂量组,另随机选取10只未造模的动物为正常对照组。每组10只动物。各组别动物连续14 d灌胃给予相应受试物后,全部动物禁食24 h后处死,取出整个胃浸泡于10 %的甲醛内,浸泡20 min后沿胃大弯剪开,洗净内容物,取腺胃区展开平铺于玻璃板上,用纸吸干溃疡内的水分,测量其面积和体积[8]。
1.3 测量指标和方法
1.3.1 胃黏膜损伤观察和评分 将胃组织沿胃大湾剪开,洗净内容物,展开胃黏膜,用游标卡尺测量出血点或出血带的长度和宽度,并对胃黏膜损伤进行评分,急性胃黏膜损伤乙醇及消炎痛模型评分标准见表2、表3[9-10]。

表2 急性胃黏膜损伤乙醇模型评分标准

表3 急性胃黏膜损伤消炎痛模型评分标准
按表2、表3所述内容进行如下指标的计算:
(1)损伤发生率(%)=该组出现出血或溃疡的大鼠数量/该组大鼠数量×100 %
(2)损伤积分=出血点分值+长度分值+(宽度分值×2)
(3)损伤积分指数 = 组损伤评分总和/组动物数量
(4)损伤抑制率(%)=(A-B)/ A×100 %
式中:A:模型对照组的损伤积分指数;B:其他实验组的损伤积分指数
1.3.2 动物组织病理学检查 将10 %甲醛溶液固定的组织,常规制片,苏木精-伊红染色法(HE)染色,选择胃黏膜正横切面,包括黏膜全层的区域观察。评分方法以充血、出血、黏膜细胞变性坏死在整个黏膜上皮层的累计程度分为5级[11]。充血权重为1,出血权重为2,上皮细胞变性坏死权重为3,评分标准及病变总积分公式见表4。

表4 急性胃黏膜损伤镜下评分标准
通过表4计算病变总积分:
病变总积分=充血积分+出血积分×2+上皮细胞变性坏死积分×3
1.3.3 溃疡面积和体积测量方法 于带标尺的解剖显微镜下计数溃疡所占的方格数,换算成面积,然后用微量注射器将有色墨水注入溃疡内,将溃疡填满与周边平齐,读取微量注射器上刻度即为溃疡的体积。
1.4 数据统计与分析
实验数据用平均值±标准差表示,采用SPSS Statistics 18软件对数据进行分析,对数据Levene’s检验检测方差齐性,如果方差齐(P>0.05),则进行单因素方差分析(ANOVA):有统计学差异时(P<0.05),采用Dunnett t检验进行组间差异比较;如果方差不齐(P<0.05),则进行Kruskal-Wallis 检验:差异有统计学意义时(P<0.05),采用Mann-Whitney U 秩和检验(M-W法)比较组间差异。组间差异比较在各剂量组与对照组之间进行,所有检验均为双侧检验,α=0.05。
2 结果与分析
2.1 乙醇致大鼠急性胃黏膜损伤模型试验结果
2.1.1 SH对大鼠体质量的影响 在30 d的实验周期内,各实验组大鼠外观体征和行为活动未见异常,无中毒体征及死亡。各受试物灌胃干预30 d后,各组间动物质量未见明显差异(见图1)。

图1 SH对乙醇致大鼠胃黏膜损伤实验初始质量及终末质量的影响
2.1.2 SH对乙醇致大鼠胃黏膜损伤模型评分的影响各组胃黏膜损伤积分指数及抑制率见表5。

表5 乙醇致大鼠急性胃黏膜损伤积分指数及损伤抑制率(n=10)
由表5可见,模型对照组大鼠胃黏膜损伤最严重;与模型对照相比,其余各组胃黏膜损伤情况减轻。SH低、中、高剂量组对乙醇致大鼠急性胃黏膜损伤抑制率虽不如阳性对照组高,但与模型对照组相比,对乙醇引起的胃黏膜损伤仍有较强的保护作用。
2.1.3 组织病理学 各组动物病变总积分见表6,组织病理学检查见图2。

图2 乙醇致大鼠胃黏膜损伤组织病理照片
由表6可见,除正常对照组外,其余组别SD大鼠胃黏膜病变总积分均显著升高,与之相比,SH低、中、高剂量组SD大鼠胃黏膜病变总积分平均值为109,明显降低,与阳性对照组基本持平。

表6 乙醇致大鼠胃黏膜损伤病理学检查病变总积分
由图2可见,正常对照组:动物胃黏膜色泽正常,表面光滑,无出血点和出血带;模型对照组、阳性对照组、SH低、中、高剂量组:动物胃黏膜整体色泽正常,腺区可见出血点及条索状出血带,且随着剂量的增加,腺区出血点及出血带有明显减轻,尤其是SH高剂量组。
2.2 消炎痛致大鼠急性胃黏膜损伤模型保护试验
2.2.1 SH对大鼠体质量的影响 在30 d的实验周期内,各实验组大鼠外观体征和行为活动未见异常,无中毒体征及死亡。各受试物灌胃干预30 d后,各组间动物质量未见明显差异,各组别动物试验期间体重正常增长未见明显异常(见图3)。

图3 SH对消炎痛致大鼠胃黏膜损伤实验初始质量及终末质量的影响
2.2.2 SH对消炎痛致大鼠胃黏膜损伤模型评分的影响 消炎痛致大鼠胃黏膜损伤组损伤积分指数及抑制率见表7。

表7 消炎痛致大鼠急性胃黏膜损伤积分指数及损伤抑制率(n=10)
由表7可见,模型对照组损伤积分指数明显高于SH各剂量组;SH低、中、高剂量组损伤抑制率均较高,尤其是中、高剂量组损伤抑制率高达60.5 %,结果均优于阳性对照组。SH对消炎痛致大鼠急性胃黏膜损伤有保护作用,且随着SH浓度的提高,保护作用增强。
2.2.3 组织病理学 各组动物病变总积分见表8,组织病理学检查病变见图4。
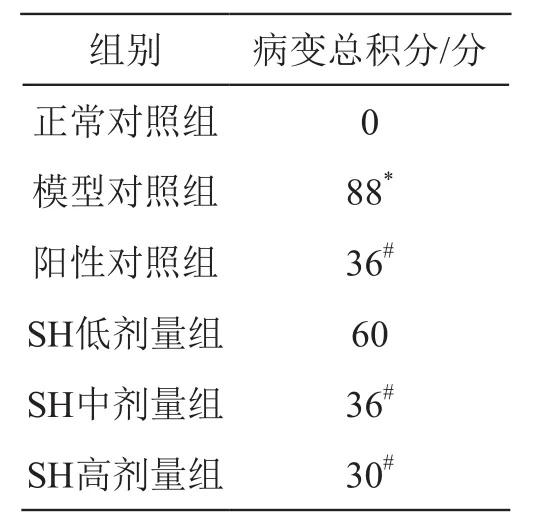
表8 消炎痛致大鼠胃黏膜损伤病理学检查病变总积分
由表8可见,除正常对照组外,其余组别SD大鼠胃黏膜病变总积分均显著升高,模型对照组病变总积分88分,与之相比,SH低、中、高剂量组SD大鼠胃黏膜病变总积分均较低,且随着剂量的增加,病变总积分呈现不断下降的趋势;其中SH高剂量组的结果优于阳性对照组。
由图4可见,正常对照组胃黏膜色泽正常,表面光滑,无出血点及出血带;其他组动物胃黏膜整体色泽正常,腺区可见出血点或条索状出血带,各组胃黏膜损伤发生率均为100 %;且随着剂量的增加,出血点及出血带减少,表明SH对消炎痛致大鼠胃黏膜损伤的治疗有一定的潜力。

图4 消炎痛致大鼠胃黏膜组织病理图片
2.3 冰醋酸致大鼠慢性胃黏膜损伤模型保护试验结果
2.3.1 冰醋酸对各组动物体质量的影响 各组别动物试验期间体重正常增长未见明显异常(P>0.05)(见图5)。

图5 冰醋酸致大鼠慢性胃黏膜损伤实验初始质量及终末质量的影响
2.3.2 动物损伤面积和体积 冰醋酸致大鼠慢性胃黏膜损伤面积和体积见表9 。
表9 冰醋酸致大鼠慢性胃黏膜损伤面积和体积(n=10,±s)

表9 冰醋酸致大鼠慢性胃黏膜损伤面积和体积(n=10,±s)
注:*P<0.05 vs 正常对照组,#P<0.05 vs 模型对照组
组别 面积/mm2 体积/μl正常对照组 0.00±0.00 0.0±0.0模型对照组 25.39±9.29* 18.8±10.9*阳性对照组 14.62±9.11*# 7.6±7.4*#SH低剂量组 24.57±12.10* 12.7±8.7*SH中剂量组 17.59±8.12* 13.9±11.5*SH高剂量组 12.67±9.30*# 9.3±8.8*
由表9可见,模型对照组大鼠慢性胃黏膜损伤面积和体积均是最大值,SH低、中、高剂量组与之相比损伤面积和体积下降趋势明显,其中高剂量组的损伤面积比阳性对照组的损伤面积低。SH各剂量组均有减轻冰醋酸所导致胃黏膜损伤的趋势,且随剂量增加,对胃黏膜的保护作用越明显。尤其是SH 100 mg/kg剂量下可显著(P<0.05)缩小冰醋酸所导致的溃疡面积,并有缩小溃疡体积的趋势。
3 讨论
胃黏膜有润滑、机械保护、抗酸逆流和防止自体消化的作用[12]。胃黏膜易受到环境、饮食、药物、酗酒等因素的影响,一旦胃黏膜受损,很难恢复如初。目前,胃黏膜损伤模型的建立方法主要有冰醋酸法、无水乙醇灌胃法、热灼法、应激法等[13]。本实验采用无水乙醇及消炎痛灌胃法建立急性胃黏膜损伤模型:乙醇可溶解、破坏消化道上皮细胞细胞膜的完整性,从而增加细胞膜通透性,也可刺激黏膜的微循环血管,引起微循环血管收缩、黏膜缺血剂炎症介质和细胞因子产生;消炎痛引起胃黏膜损伤则主要与中性粒细胞浸润,脂质过氧化和引起消化道上皮细胞凋亡等有关[14-15]。采用冰醋酸胃壁注射法建立慢性胃溃疡模型,微量冰醋酸腐蚀胃黏膜,得到很好的胃溃疡模型,同时又不会危及大鼠的生命[16]。
HA主要分布在关节腔、皮肤、眼玻璃体、软骨、脐带和公鸡冠等组织中,且研究发现,对不同来源的HA进行结构测定表明,其结构均一致,未发现种属间差异,只有分子量的差异[11]。研究发现,口服HA可起到美容保健、改善关节功能和骨质疏松、修复胃黏膜损伤、以及促进创伤愈合、改善心血管系统、改善软骨病症状、提高人体免疫力、促血管生成等功效[17-20]。HA正式获批为新食品原料,产品使用范围从原来保健食品原料,扩大到新食品原料,为推广HA的广泛应用奠定了基础。在本研究中,SH对无水乙醇、消炎痛诱发的大鼠急性胃黏膜损伤和冰醋酸诱发的大鼠慢性胃黏膜损伤有一定的保护作用,可改善胃黏膜损伤大鼠胃黏膜组织病理变化,逆转胃黏膜损伤面积和体积,且具有一定的量效关系。研究报道,HA在口腔黏膜、膀胱黏膜、鼻黏膜、皮肤黏膜和角膜损伤中均具有较好的改善效果[21-23],其主要体现在HA可降低损伤黏膜的炎性细胞浸润,增加热休克蛋白70的表达等有关[24-25]。综上,HA对胃黏膜损伤有较明显的保护作用,为HA开发具有胃黏膜损伤保护作用的功能食品、保健食品和药品等提供科学参考价值。

