单核细胞增生李斯特菌SigB 蛋白的原核表达及其多克隆抗体的制备
夏 叶,孙莹慧,李春华,缪德年
(上海市农业科学院畜牧兽医研究所,上海 201106)
单核细胞增生李斯特菌(简称单增李斯特菌,Listeria monocytogenes,Lm),是一种人畜共患的食源性致病菌。单增李斯特菌拥有极强的抗应激能力和生物被膜形成特性,可在高渗透压(10%—20% NaCl)、宽泛的pH(2.5—9.0)和温度(0.4—45.0 ℃)条件下存活并生长,因此广泛存在于水、土壤、食品加工及储存环境中[1]。人和动物食用了单增李斯特菌污染的食品易感染李斯特菌病,引发胃肠炎、流产,甚至败血症、脑膜炎等严重病症[1-2]。SigB 为单增李斯特菌最重要的应激调控因子,与细菌抵抗环境应激密切相关[3]。当细菌遭遇高渗透压、低pH、低温等应激环境时,会通过调节SigB 来调控特定基因的转录水平从而帮助细菌抵抗应激存活下来[4-5]。SigB 影响单增李斯特菌的生物被膜形成能力,形成生物被膜的李斯特菌对抗生素、环境应激以及宿主免疫系统的耐受力大大增加,能更加牢固地附着于食品加工材料表面及肠道内壁等,加大了杀灭单增李斯特菌的难度[6]。SigB 在单增李斯特菌对多种抗生素产生应答并获得耐药性方面也至关重要[7]。此外,SigB 通过调控毒力调控因子PrfA 的P2 启动子间接参与单增李斯特菌的毒力调控,影响细菌对宿主的毒力和致病性[8]。
本研究将sigB基因克隆至原核表达载体并进行蛋白表达和纯化,将纯化的蛋白免疫兔体制备抗SigB蛋白的高效价多克隆抗体,以期为更好地探究单增李斯特菌的抗应激机制、毒力调控机制及其快速诊断方法的建立奠定基础。
1 材料与方法
1.1 菌株、培养基、实验动物和试剂
单增李斯特菌标准菌株10403S、大肠杆菌DH5α 和Rosetta(DE3)以及蛋白表达质粒pET-30a 均由本实验室保存。脑心浸液培养基(BHI)购于北京陆桥技术股份有限公司;酵母浸膏、胰蛋白胨、抗生素和HRP 标记的羊抗兔IgG 购于生工生物工程(上海)股份有限公司;DNA 连接酶和KOD plus Neo polymerase购于东洋坊(上海)生物科技有限公司;2 ×PCR Mix 和DNA Marker 购于北京全式金生物技术股份有限公司;限制性内切酶购于宝日医生物技术(北京)有限公司;核酸电泳染料Goldview 购于上海赛百盛基因技术有限公司;蛋白Marker 和Ni-NTA Beads 购自赛默飞世尔科技(中国)有限公司;细菌基因组提取试剂盒、DNA 胶回收试剂盒及质粒抽提试剂盒购于南京诺唯赞生物科技股份有限公司;NaCl、KCl 等购于国药集团化学试剂有限公司。雌性新西兰大白兔购于浙江中医药大学动物实验研究中心。
1.2 sigB 基因的扩增
根据GenBank 中公布的单增李斯特菌sigB基因序列(Gene ID:986527),以单增李斯特菌参考菌株10403S 的基因组为模板,以BamHⅠ和SalⅠ为酶切位点,应用Vector NTI 软件设计重组蛋白表达质粒引物,引物由铂尚生物技术(上海)有限公司合成。上游引物F:5’-CGGGATCCATGCCAAAAGTATCTCA-3’,下游引物R:5’-GCGTCGACTTACTCCACTTCCTCATTC-3’。根据试剂盒说明书,提取单增李斯特菌10403S的基因组。以基因组为模板,通过PCR 扩增目的基因,PCR 反应条件为:94 ℃5 min;94 ℃30 s,60 ℃30 s,72 ℃45 s,30 个循环;72 ℃延伸10 min。PCR 产物经1%琼脂糖凝胶电泳切胶回收目的片段。
1.3 重组表达质粒pET30a-SigB 的构建
将胶回收PCR 产物和表达质粒pET30a 分别经BamHⅠ和SalⅠ双酶切后置于16 ℃恒温连接仪连接1 h。连接产物转化入DH5α 感受态细胞后涂布卡那霉素抗性(Kan+)平板,37 ℃过夜培养后挑取单菌落接种于Kan+液体LB 培养基,37 ℃振荡培养过夜。提取质粒经PCR 鉴定为阳性的样品送铂尚生物技术(上海)有限公司测序鉴定,保存氨基酸序列未发生改变的阳性克隆备用。
1.4 SigB 蛋白的原核表达
将pET30a-SigB 重组质粒转化Rosetta(DE3)表达菌,于Kan+液体LB 培养基中37 ℃振摇培养至OD600nm约0.6,加入终浓度为0.4 mmol∕L 的IPTG 于37 ℃诱导生长3 h。离心收集菌体,以无菌PBS 重悬菌体后超声裂解(功率300 W,工作4 s,间歇4 s,共20 min),离心取上清即获得可溶性SigB 蛋白。取少量蛋白液进行SDS-PAGE 电泳鉴定重组蛋白表达情况。其余蛋白液用于蛋白纯化。
1.5 SigB 蛋白的纯化
在层析柱中装入约2 mL Ni-NTA Beads,将上述蛋白液缓慢加入平衡后的Ni-NTA Beads,以0.5 mL∕min的速度过柱,重复3 次;用蛋白洗涤液以1—2 mL∕min 的流速洗涤杂蛋白;最后用3 mL 洗脱液对目的蛋白进行洗脱,取微量洗脱液进行SDS-PAGE 电泳,检测纯化效果。
1.6 多克隆抗体的制备
将500 μg 纯化后的SigB 蛋白与等量的弗式完全佐剂混合,用注射推拉法充分乳化至油包水状态,分点注射于兔体脊柱两侧的皮下,进行一免;每间隔2 周,取100 μg 抗原和等量弗式不完全佐剂混匀乳化,分别进行二免、三免和四免。四免后1 周于耳缘静脉采血1 mL,分离血清,测定抗体效价,若效价合格,则采用心脏采血法获得全血。全血充分凝固且析出血清后,取上层血清即为SigB 多克隆抗体。
1.7 多克隆抗体的纯化
将上述血清与生理盐水按1∶1体积混合,加入与总体积等量的过硫酸铵溶液,混匀,4 ℃静置3 h 以上;待使其充分沉淀后,4 ℃、3 000 r∕min 离心20 min,取沉淀。重复上述步骤3 次,最后用PBS 溶解沉淀并透析,即得到纯化的SigB 多克隆抗体。
1.8 多克隆抗体的效价测定
通过间接ELISA 方法测定多克隆抗体的效价[9],当OD450nm>0.2,且P∕N≥2.1 时的最大抗体稀释倍数即为其效价。
1.9 多克隆抗体的Western-blot 检测
将诱导表达后的SigB 重组菌液和不含SigB 蛋白表达质粒的空载菌液分别超声裂解提取蛋白,经SDS-PAGE 后,转印至PVDF 膜上,封闭液4 ℃过夜,以SigB 多克隆抗体作为一抗,羊抗兔HRP-IgG 作为二抗,进行Western-blot 分析,检测制备的SigB 多克隆抗体特异性。
2 结果与分析
2.1 sigB 基因的PCR 扩增
将PCR 扩增产物进行琼脂糖凝胶电泳,结果显示扩增片段大小与预期相符,约796 bp(图1),且经测序验证,扩增片段未发生碱基突变,表明成功克隆出sigB基因。
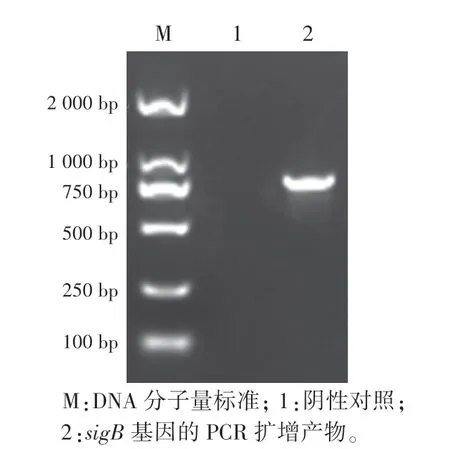
图1 sigB 基因的PCR 扩增Fig.1 PCR amplification of sigB gene
2.2 重组蛋白的诱导表达及纯化
经3 h 的IPTG 诱导表达,获得了可溶性SigB 蛋白,经Ni-NTA Beads 层析纯化后,SDS-PAGE 鉴定,得到的SigB 蛋白大小约30 ku(图2),与预期相符。所得纯化后的目的蛋白纯度较高,质量浓度约1.5 mg∕mL。

图2 SDS-PAGE 分析SigB 蛋白的表达及纯化效果Fig.2 SDS-PAGE analysis of SigB protein expression and purification
2.3 多克隆抗体的免疫效价
将纯化后的重组SigB 蛋白免疫新西兰大白兔,经过4 次免疫后,收获血清并进行过硫酸铵沉淀和透析纯化,即获得纯化的SigB 多克隆抗体。经测定,当抗体稀释度为1∶51 200 时,OD450nm值为0.22,且P∕N≥2.1,即制备的多克隆抗体效价为1∶51 200(图3)。

图3 SigB 蛋白多克隆抗体效价Fig.3 The titer of SigB protein polyclonal antibody
2.4 多克隆抗体的Western-blot 检测
以上述制备的多克隆抗体作为一抗,以HRP 标记的羊抗兔IgG 作为二抗,进行Western-blot 检测。结果显示:经诱导表达的pET30a-SigB 蛋白在30 ku 左右检测出特异性SigB 蛋白条带,而阴性对照未见条带(图4),表明本研究获得的SigB 多克隆抗体具有良好的特异性。
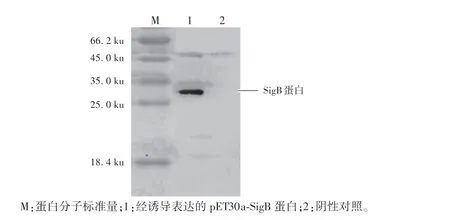
图4 SigB 蛋白多克隆抗体的Western blot 鉴定Fig.4 Western blot analysis of sigB protein polyclonal antibody
3 讨论与结论
单增李斯特菌作为一种重要的食源性病原菌,拥有极强的环境适应能力,因此广泛存在于各种自然环境及食品加工、储存环境中[1]。细菌在遇到应激或环境变化时,会通过改变自身的基因表达水平来适应环境。SigB 为单增李斯特菌最重要的应激调控因子,通过识别特定的启动子序列,与RNA 聚合酶结合形成全酶,从而诱导下游抗应激基因的转录启动[10]。SigB 已被证实参与抵抗温度、酸碱、氧化、胆酸盐、渗透压、碳饥饿等多种环境及能量应激的调控[3]。单增李斯特菌作为侵袭性胞内菌,在入侵宿主细胞过程中受到一系列毒力因子的调控。其中,PrfA 为单增李斯特菌最主要的毒力调控因子,其P2 启动子P2prfA为SigB 依赖型,sigB基因的缺失会影响P2prfA启动子的激活,从而影响细菌的各种毒力表型。Ollinger等[8]通过微阵列基因芯片测序及荧光定量PCR,证实sigB基因的缺失影响hly、plcA、actA、lmo2219 等毒力基因的转录水平。最新研究表明,SigB 与PrfA 的相互作用促进了单增李斯特菌从胞外到胞内的跃迁,影响细菌入侵宿主细胞的过程[11]。可见,SigB 对单增李斯特菌的生存和感染都至关重要,不仅调控单增李斯特菌的抗应激能力,帮助细菌在恶劣环境中存活下来,并且影响细菌的毒力,参与细菌感染宿主细胞的过程。本研究获得了高纯度可溶性SigB 蛋白以及高效价多克隆抗体,可在已有的表型和转录水平基础上,进一步验证SigB 蛋白与P2prfA启动子以及PrfA 的互作关系,探究SigB 蛋白对各毒力因子在蛋白表达层面的影响,解析SigB 与其调控操纵子互作的激活机制。
单增李斯特菌是一种食源性人兽共患病原菌,人和动物通过摄入污染该菌的食物而感染,引发李斯特菌病。近几年,我国时有李斯特菌病的临床病例发生[12],李斯特菌污染即食食品的报道也多次出现。Wang 等[13]于2018年在自贡市即食食品中分离到的单增李斯特菌携带超强毒力基因。Chen 等[14]于2018年在即食蔬菜中分离到多株单增李斯特菌。随着人们饮食结构的调整,即食食品、生食食品所占比重越来越大,也为单增李斯特菌的防控增加了难度,开发快速检测试剂盒势在必行。多克隆抗体作为检测工具具有成本低、周期短,且能识别多个抗原表位、增强靶蛋白信号、提高检测灵敏度等优点。本研究获得的SigB 蛋白和多克隆抗体为快速检测试剂盒的研发提供了可靠的试验工具。
本研究通过原核表达系统获得了高纯度的可溶性单增李斯特菌SigB 蛋白,并通过免疫兔体成功制备了高效价的多克隆抗体,所制备的多克隆抗体能与SigB 蛋白发生特异性结合,且该多克隆抗体在SigB 蛋白缺失的单增李斯特菌中未检测到目的蛋白,表现出良好的抗体特异性。本试验获得的SigB 蛋白以及多克隆抗体为SigB 蛋白的生物学功能研究以及单增李斯特菌的快速检测提供了技术支撑,为阐明单增李斯特菌的毒力调控和抗应激机制奠定了基础,对防控李斯特菌病、保障食品卫生安全具有深远意义。
——一道江苏高考题的奥秘解读和拓展

