经鼻内镜鼻内翻性乳头状瘤手术临床分析
沈楚 陈玉赞 黄文龙 黄国伍
鼻内翻性乳头状瘤(nasal inverted papilloma,NIP)是临床常见的鼻腔、鼻窦良性肿瘤,为上皮源性肿瘤,发病率约占鼻腔、鼻窦肿瘤的0.5%~4.0%[1],多发生于中年男性,因具有侵袭性、高复发率、易恶变的临床特点,故又称之为交界性上皮源性肿瘤,其对放化疗不敏感,故手术一直是其首选的治疗方式。既往鼻侧切开入路鼻腔外侧壁切除是此病的基本手术方式,视野宽广,肿物切除较彻底,尤其对原发于筛窦内的肿瘤有一定优势,但手术创伤大、鼻腔功能受损和面部遗留瘢痕等固有缺陷使其应用越来越少,随着鼻内镜技术的不断提高及术前高分辨率CT、MRI的应用,为彻底切除肿瘤奠定良好基础,大宗病例研究已证实,鼻内镜手术可有效控制NIP的术后复发率[2]。我科自2015年1月~2020年5月,采用经鼻内镜联合其他手术入路治疗NIP患者27例,取得良好疗效,现报道如下。
资料与方法
1 临床资料
选取2015年1月~2020年5月在我科手术治疗的NIP患者27例,其中男18例,女9例;年龄28~76岁,平均56.7岁;病程1月至10余年;初次手术者24例,术后复发再手术者3例;26例为单侧发病,1例为双侧。主要症状包括进行性加重的鼻塞、流涕、嗅觉减退、涕中带血或反复鼻出血,可伴不同程度头晕、头痛。根据Krouse分级标准[3]分为:Ⅰ级:病变只限于鼻腔;Ⅱ级:病变限于筛窦、上颌窦内侧上部;Ⅲ级:病变包括上颌窦的外侧或下部或侵入额窦、蝶窦;Ⅳ级:病变侵犯外鼻或鼻窦外结构或伴恶变。本组Ⅰ级2例,Ⅱ级5例,Ⅲ级17例,Ⅳ级3例。
2 方法
患者术前行鼻内镜检查、鼻窦CT和MRI检查,术后病理均确诊为NIP,2例伴局灶恶变。手术采用局部浸润麻醉(2例)或气管插管静吸复合全麻并控制性低血压(25例),伴有鼻中隔偏曲并影响手术操作者先行鼻中隔矫正术。Ⅰ级患者鼻内镜直视下彻底切除肿瘤及肿瘤根蒂周围约5mm黏膜,根蒂部采用双极电凝或低温等离子烧灼后术腔明胶海绵填塞。Ⅱ级患者鼻内镜下先切除鼻腔肿瘤组织,后切除钩突,肿瘤病变累及筛窦者开放筛窦,切除筛窦内肿瘤;累及上颌窦内侧上部者,根据肿瘤范围扩大上颌窦自然口,切除部分鼻腔外侧壁,利用0°、30°和70°等各种角度镜直视下彻底切除肿瘤。病变累及额隐窝者,开放筛窦后切除额隐窝肿瘤组织并开放额窦,双极电凝或低温等离子烧灼根蒂部粘膜,磨钻磨除根蒂部增生骨质,术腔填塞明胶海绵和膨胀海绵。Ⅲ级患者病变累及上颌窦下壁或外侧壁,5例采用鼻内镜联合柯氏入路切除肿瘤,12例采用鼻内镜下泪前隐窝联合中鼻道入路切除肿瘤,注意保护膜性鼻泪管下端及下鼻甲。病变侵及蝶窦者,切除鼻腔肿瘤后开放后组筛窦,经后筛开放蝶窦前壁,清理窦内病变组织。原发于蝶窦者,经蝶筛隐窝由蝶窦自然口进入窦腔切除肿瘤。Ⅳ级患者,1例局灶恶变并侵及翼腭窝、上颌窦前壁,骨质破坏明显,采用鼻内镜联合柯氏入路,充分暴露上颌窦前壁、后外侧壁和翼腭窝,内镜直视下彻底切除肿瘤,磨除肿瘤根蒂部骨质。1例起源于上颌窦底壁伴局灶恶变,采用鼻内镜联合柯氏入路切除肿瘤。1例起源于筛顶,突破硬脑膜并侵入颅内,鼻内镜下彻底切除肿瘤并一期修复颅底缺损。所有患者术后全身应用抗生素及止血药物3~5d,48h后逐步取出鼻腔填塞物,每日鼻内镜检查及换药1次,术后5~12d出院。出院后每2~4周换药1次至术腔完全上皮化。
3 统计学方法
采用SPSS 23.0软件包进行统计学分析,计数资料采用χ2检验,P<0.05为差异有统计学意义。
结果
27例患者手术顺利,术后症状减轻或消失,未出现眶内和颅内并发症,Ⅳ级患者1例术后前2周出现眶下神经分布区明显麻木感,随后逐渐减轻至1月左右完全消失。所有患者随访1~5年,3例术后复发,其中1例术后3月复发,门诊处理疗效欠佳,术后6月再次入院行鼻内镜泪前隐窝入路手术治疗,随访至今未复发,另外2例分别于术后2月和5月肿瘤根蒂部复发,门诊鼻内镜检查及时处理后定期随访至今未复发,两组复发率比较,见表1。

表1 单纯鼻内镜手术与鼻内镜联合柯氏入路手术复发率的比较
讨论
鉴于NIP的生物学特点,手术的关键一是彻底切除向外生长侵犯的肿瘤及其累及的鼻腔鼻窦组织,二是彻底切除肿瘤根蒂部及临近的黏膜和骨质,因此需根据肿瘤的根蒂部位和累及的范围选择不同的手术入路,我们的体会是,术前细致的鼻内镜检查和阅片是准确判断肿瘤根蒂部位和累及范围的重要手段,合适的手术入路、良好的手术器械和娴熟的鼻内镜手术技能是确保手术成功的关键。
1 术前鼻内镜检查
主要观察肿瘤的外在表现,探查肿瘤的侵犯范围和起始部位。表麻和收缩鼻腔黏膜后,以剥离子分离肿瘤和鼻中隔、中鼻甲、下鼻甲等解剖标志,肿瘤原发于上述部位时,可见肿瘤表面黏膜与正常鼻腔粘膜相延续。注意与鼻息肉鉴别,乳头状瘤表面不平,呈乳头颗粒状实性肿物,透明度差,常充填中鼻道并累及总鼻道,而鼻息肉表面光滑,血管纹路清晰,呈半透明状,需注意的是部分病例中二者可混合存在,给诊断带来困难,我们的体会是单侧鼻腔、鼻窦发病者,术前鼻腔活检或术中快速病理非常必要,活检时取深部及病变与正常交界区组织送检可显著提高一次性诊断率。本组7例患者,初诊考虑鼻窦炎伴鼻息肉,后经细致的鼻内镜检查后怀疑NIP,遂行活检或术中快速病理证实,避免了误诊。
2 术前影像学检查
高分辨率CT对判断肿瘤起源和鼻腔、鼻窦病变范围有重要作用,能准确判断肿瘤侵及范围和分期[4],我们在诊疗过程中也深有体会,多数情况下CT可清楚显示肿瘤范围及其和鼻腔、鼻窦的关系,通过骨窗判断肿瘤与鼻窦骨质及颅底和眼眶骨质的关系,单侧鼻腔、鼻窦内结节状、条索状或不规则形软组织影,软组织影内若含低密度气泡-“气泡征”(图1),是NIP的特征性表现。研究发现,约一半以上病例CT检查显示有局限性骨质增生现象,且骨质增生部位与术中发现肿瘤的根蒂部一致,可能与局部骨质重塑导致钙化有关[5],结合鼻内镜检查结果,有助于我们对根蒂部的准确判断。需要注意的是,并非所有NIP均有此特征性表现,此外高分辨率CT有较高的空间分辨率,但密度分辨率低,当肿瘤生长堵塞鼻窦开口伴发鼻窦炎时,就很难区分肿瘤与伴发的鼻窦炎,导致对肿瘤侵及范围判断扩大化。此时MRI的优势就体现出来,MRI上NIP最可靠的形态学特征为脑回征,这可能是由于上皮回旋内翻入基质层所致,据此区分肿瘤和炎性组织(图2),同时便于判断肿瘤与周围软组织如眶内容、脑组织的关系[6]。MRI还有助于与恶性肿瘤相鉴别,应用钆造影剂后,NIP呈不均匀增强,而恶性肿瘤呈低强度信号[7]。结合我们的诊治体会,对NIP常规高分辨率CT检查,肿瘤范围较广与周围软组织界线不清时,需行MRI检查。
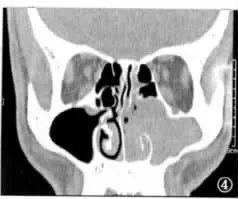
图1 NIP典型CT表现(气泡征)
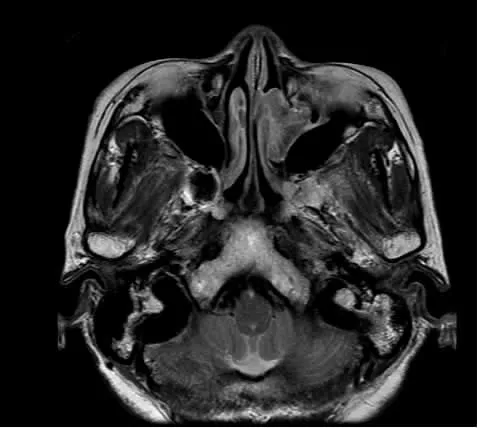
图2 NIP典型MRI表现(脑回征)
3 术式的选择和术中要点
NIP手术治疗的目的是应用精细解剖技术,将病变黏膜在骨膜下层彻底切除(骨骼化),而合适的手术入路对完整切除肿瘤起着决定作用。研究发现,尽管病变的范围可能较广,但其根蒂部位范围通常不超过15mm左右,决定手术疗效的关键是能否清晰暴露肿瘤根蒂部并实现对其彻底切除,其临床意义高于肿瘤侵及的范围[8],我们的体会是手术入路取决于能否实现对肿瘤根蒂部的暴露和切除,这有赖于细致的鼻内镜检查和高分辨率CT、MRI扫描,而肿瘤的范围不是最主要参考因素。随着各种角度镜、手术器械和鼻内镜技术的进步结合文献报道和我们的体会,Ⅰ~Ⅲ级患者和部分Ⅳ级(如局灶恶变)患者完全可在鼻内镜下彻底切除,但对于肿瘤体积巨大侵及外鼻、起源于额窦外侧、瘤体大部分已恶变等内镜下难以彻底切除的病例,鼻内镜联合外入路(如鼻侧切开、柯氏入路等)是推荐的手术入路[9]。本组27例患者,20例采用单纯鼻内镜下切除,7例采用鼻内镜联合柯氏入路切除(术前判断肿瘤起源于上颌窦底壁或后外侧壁,部分病例伴恶变),两种手术入路术后复发率比较无统计学差异,提示单纯鼻内镜手术切除是安全、有效的。瘤体较小时,内镜下容易暴露其根蒂便于切除。肿瘤范围广时,除根据术前鼻内镜和影像学检查判断外,需要在切除的过程中探寻根蒂,因NIP的非根蒂部分是外生性生长,其与正常或炎症的鼻窦黏膜间界限是清晰的,辨识较容易,而肿瘤的根蒂部是与鼻腔或鼻窦壁粘连的,辨识较难,这有助于我们对根蒂部的判断。对于非根蒂部分,我们的体会是采取钳取方式较好,因NIP有一定韧性,钳夹一部分可连带切除一串,可使用直头或翘头筛窦咬钳。在临近重要结构(如前颅底、眶纸板、蝶窦外侧壁)时,宜使用切钳或电动切割器,切除时尽量避免损伤邻近的正常鼻窦粘膜,这对术后鼻腔功能恢复有重要意义。
术中出血多影响术野,也是导致残留和并发症的重要原因,本组3例患者术中出血均超过600ml,其中1例约1000ml,我们的体会是除术中控制性降压外,用含1‰肾上腺素纱条压迫可有效止血,除止血目的外,借助纱条的推挤作用不断显露肿瘤的切除部位以便于操作。此外相较于传统切吸器,使用低温等离子切除肿瘤可极大减少术中出血,保持术野清晰,缩短手术时间,值得推荐[9]。对于术中出血量多(>600ml)的患者,术后复查血常规,必要时输血有助于术后恢复和避免术腔感染。
切除根蒂位于筛窦的肿瘤组织时,应广泛切除筛窦气房,如筛顶骨质和纸样板受侵,我们的体会是切除肿瘤的同时尽可能保持硬脑膜和眶骨膜的完整,确因切除侵入颅内或眶内肿瘤造成缺损者,务必一期严密修复缺损,可取鼻中隔软骨片或中鼻甲骨片、自体肌肉组织和筋膜(推荐大腿外侧肌肉和筋膜,可取组织量大且抗感染能力强)“嵌塞法”修复缺损,本组1例起源于筛顶并侵入颅内,内镜下彻底切除肿瘤后取中鼻甲骨片一期修复颅底缺损,术后予抗感染、降颅压等治疗,患者术后恢复良好,未出现各种颅内并发症。
肿瘤根蒂位于上颌窦内侧壁或鼻腔外侧壁并累及窦口鼻道复合体者,切除范围应包括鼻腔外侧壁、筛窦。若中鼻甲和下鼻甲尚未侵及,应尽量保留或仅切除可疑部分。基底不在上颌窦内侧壁,经泪前隐窝入路行窦内肿瘤切除时,应保留鼻腔外侧壁粘膜和保护泪道,游离出鼻泪管后,继续分离黏骨膜,磨除上颌窦额突骨质后,整个上颌窦腔显露无遗,0°镜下可直视齿槽隐窝、泪隐窝、翼腭窝等死角。肿瘤累及上颌窦前内下壁及前外侧壁范围较广导致手术操作仍受限时,可同时用咬骨钳向外侧咬除部分梨状孔骨质以获得满意操作空间。肿瘤切除后我们建议在下鼻道前部开一“窗口”,便于术后鼻内镜随访时观察窦腔黏膜上皮化和肿瘤复发情况,本组2例上颌窦腔内肿瘤复发皆因此及时发现而果断处理,成功避免了二次手术。
蝶窦内肿瘤多由筛窦侵犯所致,原发者甚少(本组1例,经蝶筛隐窝蝶窦开口处进入蝶窦腔切除),因蝶窦前壁多已破坏,可从切除筛窦肿瘤开始,追踪肿瘤进入蝶窦,无需刻意寻找蝶窦口。若术前影像学提示蝶窦外侧壁骨质破坏,内镜下观察肿瘤有搏动,提示瘤体可能与颈内动脉粘连,应使用低温等离子或电动切割器慢慢切除,切不可钳夹,宁可留下少许肿瘤组织也要确保不损伤颈内动脉。
NIP原发于额窦极少,本组亦无原发于额窦病例,多为筛窦所累及,我们的体会是对于额窦腔未被累及者,即KrousⅡ级患者,彻底切除肿瘤组织和病变粘膜,开放额窦口即可。额隐窝和额窦口的处理需要在45°或70°镜下操作,处理额窦口周围病变时,尽可能保持粘膜完整,以防日后窦口狭窄,注意勿损伤额窦后壁及前颅窝。对于肿瘤原发于额窦或额窦内广泛侵犯者,文献报道[10]可于内镜下切除筛泡、额隐窝后,于鼻中隔前上部开窗,切除肿瘤时根据需要开放对侧额隐窝,最后切除双侧额窦底和额窦中隔。若肿瘤累及额窦外侧或眶上部、前壁,经鼻内镜难以抵达上述部位,可于眼眉内侧端小切口,额窦前壁开窗,内镜辅助下切除肿瘤。
术中肿瘤的根蒂部残留是复发的重要原因,本组3例术后复发皆为此因,术中应将肿瘤根蒂组织连所附着的骨膜和骨质一并切除,且与正常粘膜有至少5mm的安全缘,术中我们用长柄磨钻磨除肿瘤根蒂部骨质,若根蒂部骨质位于眶骨膜或颅底骨质不能完全切除,用双极电凝或低温等离子烧灼肿瘤根蒂部位可有效减少复发。此外NIP的鼻内镜手术中几乎所有患者都是肿瘤和阻塞性炎症同时存在,在彻底切除肿瘤的基础上,适当开放受阻塞的鼻窦。
4 术后定期随访观察
NIP的术后定期随访至关重要,是减少二次手术的重要手段,复发多在术后6个月内,我们的体会是术后前6个月至少每2周复查一次,清理术腔痂皮、囊泡并观察肿瘤根蒂处有无复发,疑似复发者及时切除组织送病理检查明确,复发处再次予以双极电凝或低温等离子烧灼,本组2例患者通过严密随访早期发现复发并及时处理避免了二次手术,对连续2~3次门诊处理仍复发者,建议尽早行二次手术避免肿瘤恶变,本组1例患者门诊连续处理效果不佳后予鼻内镜泪前隐窝入路再手术后未复发。复发者需严密随访(1次/2周持续1年,1年后未复发者改为1次/月并至少随访3~5年)。对术腔上皮化良好始终无复发者,手术6个月后改为每2~3月复查1次并至少随访1~2年,期间辅以鼻喷激素和鼻腔生理盐水冲洗可保持鼻腔清洁并减少囊泡和肉芽组织增生。

