斑马鱼notch3基因真核表达载体的构建及其表达分析
吴坤坤 徐行 季策 任建峰 李伟明 张庆华
(1. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室,上海 201306;2. 上海海洋大学 国家水生动物病原库,上海 201306;3. 密歇根州立大学渔业与野生生物系,东兰辛 48824,美国)
Notch分子是一种跨膜的信号受体,在发育模式、细胞命运决定、细胞生存和增殖调控与免疫等方面都发挥着重要作用[1-2]。Notch信号通路调控着神经细胞增殖、分化和凋亡之间的平衡[1,3],对细胞分化也起着决定性作用,同时Notch受体还可以通过调节干细胞及其谱系和其他细胞过程,继续在成人组织的维持和修复中发挥重要作用。notch基因最先在果蝇中被发现,该基因突变可造成黑腹果蝇(Drosophila melanogaster)翅膀边缘缺刻(notch),故被命名为notch,果蝇中只有一个notch基因[4]。随着基因在进化过程中的复制和多样性变化,在人体中产生了4个Notch同源基因(Notch1-4),它们既有重叠的功能,又有各自的功能[5-6]。Notch分子是单次跨膜分子,在内质网和高尔基体产生,经过Furin蛋白酶切割成熟之后形成一个以非共价键结合的单次跨膜蛋白,包括胞内段(notch intracellular domain,NICD)、 跨 膜 区(transmembrane domain,TMD和胞外段(extracellular domain,NECD)3部分[7]。在受到蛋白水解酶切割时被激活是Notch的一个基本特征。在被激活时Notch受体会被金属蛋白酶和γ-分泌酶切割加工,随后释放的Notch受体胞内段NICD进入细胞核,NICD在入核后与DNA结合转录因子CSL组成一个临时的核转录复合物。一旦NICD绑定到CSL上,NICD便会募集其他激活蛋白包括Mastermind(MAM)/Lag-3形成三元复合体,进而募集ARCL/MED介导转录激活复合物诱导下游靶基因的转录表达[8]。
Notch3作为4个Notch分子的一员,在生物的发育、修复和免疫等过程中都发挥着重要作用,特别是在一些疾病中。研究表明,Notch3也有很高的配体非依赖性特征,这可能与Notch3的功能和病理特征有关[9]。在T细胞急性淋巴细胞白血病(T-ALL)中,通过鉴定染色体易位,异常的Notch信号首次与人类癌症联系在一起[10]。在很多病例中Notch3的过度表达都是引发疾病的重要原因之一[11-12]。特异性针对Notch3 结构域的阻断抗体已被证明具有抗白血病的效果[13]。而且Notch3分子同Notch1分子一样,能够调节类似的下游致癌基因,包括驱动细胞生长调节因子Myc[14]。另有研究发现,Notch3与NF-κB(nuclear factor-кB)家族关系密切,Notch3受体表达的下调会抑制NF-κB信号通路,而NF-κB信号通路又是免疫学中的重要通路[15]。以上研究表明Notch3在发育和免疫方面都有着重要作用,Notch3分子可能具有复杂的分子调控机制,使其表现出不同的生物学功能。因此,有必要进行详细的研究。
斑马鱼(Danio rerio)是一种新兴的实验动物,其易于饲养和繁殖,具有透明的胚胎,适合于胚胎发育、神经生成和高通量毒理学等研究。斑马鱼胚胎的透明性允许在发育的所有阶段应用高分辨率成像技术。受精后5 d(5 days post fertilization,5 dpf)以内的斑马鱼胚胎被欧盟指令(2010/63/EU)以及美国的实验动物管理和使用委员会(Institutional Animal Care and Use Committee,IACUC)视为不受保护的生命阶段。因此,斑马鱼胚胎是能够很好代替其他成年动物的模式生物[16]。在一些微生物感染的实验中,斑马鱼作为实验动物的优势尤为明显[17]。同时,作为一种脊椎动物,与线虫和果蝇相比,斑马鱼在进化上与哺乳动物的关系更密切,在一些药物研究中可以更容易地推断出在人类中应用的效果[18]。因此,斑马鱼模型具有更强的研究潜力。为了进一步研究Notch3分子在发育、炎症和天然免疫方面的作用机制,本研究克隆了斑马鱼notch3基因的胞内段(notch3 intracellular domain,N3ICD),并构建了真核表达载体,将其转染到HEK293T细胞中。亚细胞定位发现重组的真核表达载体可以在细胞核中表达,同时蛋白质印迹(Western blot,WB)结果显示N3ICD蛋白能够正常表达。
1 材料与方法
1.1 材料
1.1.1 实验用鱼 实验用AB品系斑马鱼购自中国科学院生物化学与细胞生物学研究所斑马鱼平台,参照WESTERFIELD要求[19],饲养于本实验室的斑马鱼养殖系统中。实验按照上海海洋大学动物实验伦理审查委员会(SHOU-DW-2016-002)的要求进行。
1.1.2 实验细胞 实验所用HEK293T细胞(人胚肾细胞)由海军军医大学医学免疫学国家重点实验室惠赠,本实验室按照ATCC数据库方法将细胞进行保种和培养。
1.1.3 主要试剂 普通DNA产物纯化试剂盒(TIANGEN,DP204-02),胰蛋白酶TrypLETMExpress(Gibco,1950685),快速质粒小提试剂盒(BIOMIGA,PD1222-01 50), 简 单 培 养 基 Opti-MEM(Gibco,1894141),DMEM培养基(HyClone,AD24464275),转染试剂FuGENE HD Transfection Reagent(Promega,0000352595),哺乳动物表达载体p3XFLAG-CMV-7(SIGMA),同源重组试剂2×ClonExpress Mix(诺唯赞,C115-02-AA),Bovine Serum Albumin(SIGMA,WXBC7961V),20×PBS( 生 工,D609KA5801),TritonTMx-100(SIGMA,053K00262V),多聚甲醛( 生 工,CB05BA0005),Alexa FluorTM488goat antimouse lgG9(H+L)(Invitrogen,1834337), 小 鼠 抗FLAG-tag单克隆抗体(YSASEN,30503ES60),Goat anti-Mouse IgG(H+L)Secondary Antibody,HRP(Invitrogen,31430),β-actin,Rabbit pAb(YSASEN,30102ES40),Peroxidase-Conjugated Goat Anti-Rabbit IgG(H+L)(YSASEN,33101ES60)引物合成及菌液测序均在生工生物工程(上海)有限公司进行。Dual-Luciferase® Reporter Assay System 及 FuGENE Hd均购于Promega公司。实验涉及NF-κB家族rela和nfκb1基因启动子报告基因载体 pGL3-rela-promoter-Enhancer和 pGL3-nfκb1-promoter-Enhancer均由本实验室自行构建。
1.2 方法
1.2.1 斑马鱼notch3胞内段真核表达载体的构建 根据NCBI网站上登录的斑马鱼notch3基因(NM_131549.2)的CDS区设计的引物如表1所示。以1 dpf的野生型斑马鱼的cDNA为模板,利用高保真酶进行PCR扩增,扩增的体系为:PrimeSTAR®Max DNA Polymerase 12.5 μL,DNA Template 20 ng,Forward Primer 1 μL,Reverse Primer 1 μL,ddH2O 9.5 μL,扩增的程序为98℃预变性20 s,98℃变性30 s、65℃退火30 s、72℃延伸1.5 min,共34个循环,72℃终延伸5 min,4℃保存。将PCR产物纯化回收,使用限制性内切酶PstⅠ和BamHⅠ对质粒载体p3xFLAG-CMV-7进行双酶切。载体p3xFLAGCMV-7的质粒图谱请见http://www.biofeng.com/zaiti/buru/p3XFLAG-CMV-7.html,将切开的载体用DNA纯化试剂盒纯化。纯化之后用同源重组连接酶2×ClonExpress Mix将PCR纯化产物和酶切后的载体p3xFLAG-CMV-7相连接,产物转化至DH5α感受态细胞中,涂布含有氨苄抗性的平板,12 h后挑单克隆并摇菌,3 h后将部分阳性克隆送测序,另一部分进行保存,将测序成功的菌液提取质粒。

表1 N3ICD引物扩增序列Table 1 N3ICD primer amplification sequence
1.2.2 Notch3氨基酸序列生信分析 利用SMART在线分析斑马鱼Notch3结构域,通过DNAMAN将斑马鱼Notch3氨基酸序列与人(Homo spaiens)、小鼠(Mus musculus)和鲤鱼(Cyprinus carpio)的Notch3氨基酸序列进行比对。基于各物种Notch3的氨基酸序列使用MEGA7.0软件利用邻接法(NJ)构建系统进化树。
1.2.3 pCMV-N3ICD亚细胞定位 将构建好的pCMV-N3ICD质粒转染至HEK293T细胞中。转染前,将细胞接种到35 mm玻璃底培养皿中,融合率达到70%-80% 时进行转染。在培养皿用HD转染试剂将pCMV-N3ICD和pCMV载体质粒各自转染500 ng。转染24 h后,将细胞用4%多聚甲醛固定15 min,用1×PBS漂洗3次,并在-20℃下用100%甲醇透化10 min,然后用1×PBS漂洗3次。在封闭缓冲液(1×PBS / 5% 正常山羊血清/0.3% Triton X-100)中将样品孵育1 h。封闭后,添加抗体缓冲液(1×PBS/1% BSA/0.3% TritonX-100/1∶1 000小鼠抗FLAG-tag单克隆抗体)4℃下孵育12-16 h。再用1×PBS漂洗3次,加入包含偶联荧光素二抗并室温下避光孵育1-2 h,1×PBS漂洗3次,添加DAPI,并将样品在黑暗中孵育1-2 h。用1×PBS冲洗3次后,在共聚焦显微镜下观察标本并拍照。
1.2.4 斑马鱼N3ICD的蛋白表达分析 将重组质粒pCMV-N3ICD脂质体法转染HEK293T细胞24 h后提取蛋白。根据BCA 法对蛋白进行定量。取25 μg样品进行SDS-PAGE聚丙烯胺凝胶电泳,将样品转至NC膜上,封闭10 h,PBST漂洗滤膜3次,每次5 min,以鼠源FLAG-tag抗体为一抗(1∶3 000倍稀释)并孵育3 h,然后PBST漂洗滤膜3次,每次5 min,以山羊抗鼠为二抗(1∶3 000倍稀释)孵育3 h,再用PBST漂洗滤膜3次,每次5 min,ECL显色,发光,分析Western blot结果。
1.2.5 双荧光素酶报告基因活性分析及功能验证 HEK293T细胞培养于10% FBS-DMEM培养液中,置于5% CO2,37℃无菌培养箱中,每48 h传代1次。HEK293T细胞转染前24 h接种于24孔细胞培养板中,接种的细胞密度约5.0×104/孔,汇合率达到80%。具体步骤为:用10 cm细胞培养皿培养HEK293T细胞,待细胞汇合度80%-90%时吸出旧培养基,贴壁加入2 mL DPBS缓冲液,轻轻晃动后吸除DPBS,重复清洗2次。加入500 μL细胞消化胰酶,于37℃培养箱消化1 min,轻敲培养皿底部使贴壁细胞完全脱落,加入10倍体积的DMEM完全培养基(含有10% FBS)终止消化,并转移至15 mL离心管中800 r/min离心3 min。吸去上清,加入适量DMEM完全培养基重悬细胞,用血球计数板进行计数。24孔板中每孔铺1×105个细胞,37℃培养。
将斑马鱼真核表达载体pCMV- notch3、NF-κB家族基因启动子重组质粒pGL3-rela-promoter-Enhancer或 pGL3-nfκb1-promoter-Enhancer和 TK 内参荧光报告基因载体共转至HEK293T细胞中,检测过表达notch3基因对下游NF-κB家族rela和nfκb1基因启动子活性的影响。转染体系中对照组为:pCMV-Tag2B 400 ng、pCMV- notch3 0 ng、pGL3-relapromoter-Enhancer/pGL3-nfκb1-promoter-Enhancer 100 ng、pRL-TK 10 ng;实验组为:pCMV-Tag2B 100 ng、pCMV- notch3 300 ng、pGL3-rela-promoter-Enhancer/pGL3-nfκb1-promoter-Enhancer 100 ng、pRL-TK 10 ng。转染24 h后按照Dual-Luciferase® Reporter Assay System说明书并用多功能酶标仪(FlexStation3)进行双荧光素酶报告基因检测。每组3次技术重复,实验重复3次,结果用平均值±标准误(mean±SEM)表示,用Prism 6软件进行显著性差异分析,P<0.05表示具有显著性差异。
2 结果
2.1 Notch3氨基酸序列生物信息学分析
生信分析结果显示斑马鱼Notch3编码2 468个氨基酸,主要由6个部分构成,23-1 379位点为35个EGF重复序列,1 385-1 503位点为3个NL区域,1 507-1 563位点为NOD结构域,1 575-1 637位点为NODP结构域,1 791-2 003位点为6个ANK结构域,以及2383-2446位点为DUF功能未知的结构域。斑马鱼与鲤鱼Notch3氨基酸一致性最高为92.64%,与人和小鼠一致性分别为54.85%和54.15%。用NJ法构建系统进化树结果表明,哺乳动物Notch3聚为一大支,两栖类和鱼类Notch3聚为另一大支,而斑马鱼的Notch3又与硬骨鱼类聚为一支,而哺乳动物各自聚为一个分支(图1)。
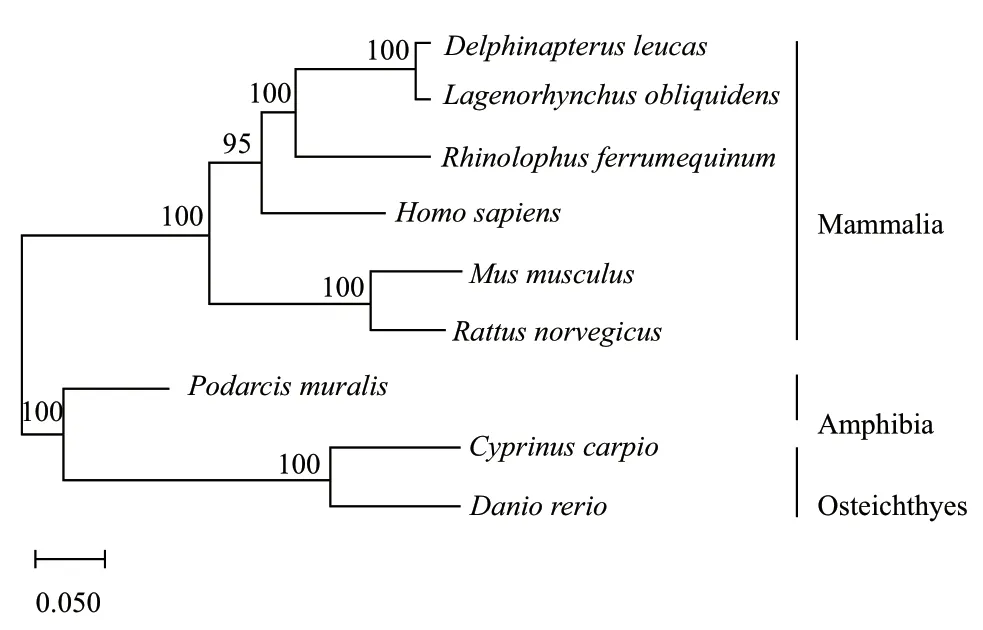
图1 NJ法构建Notch3进化树Fig. 1 Construction of Notch3 evolutionary tree by NJ method
2.2 斑马鱼notch3基因胞内段的扩增以及真核表达载体的构建
以1 dpf大小野生型斑马鱼的cDNA为模板,设计引物克隆notch3基因的胞内段。电泳结果显示,在约2 500 bp处出现单一条带(图2),与预测的目的片段大小一致。然后将PCR产物进行纯化,纯化之后将其与双酶切后的载体p3xFLAG-CMV用同源重组的方式连接,并经过转化和菌液PCR筛选出阳性克隆。将构建的真核表达载体命名为pCMVN3ICD,并经测序验证其与预测信息一致。

图2 notch3基因胞内段的克隆(A)及重组质粒的构建(B)Fig. 2 Cloning of notch3 gene Intracellular domain(A)and construction of recombinant plasmid(B)
2.3 重组质粒亚细胞定位
为了验证构建好的重组质粒的表达位置,进行细胞免疫荧光实验。我们用DAPI试剂标记细胞核(蓝色荧光),FLAG抗体标记pCMV-N3ICD(绿色荧光),并进行了明场观察,pCMV质粒用作对照。在共聚焦显微镜下,pCMV-N3ICD聚集在HEK293T细胞核中,这说明成功构建了pCMV-N3ICD真核表达载体(图 3)。

图3 pCMV-N3ICD在HEK293T细胞中的定位Fig. 3 Localization of pCMV-N3ICD in HEK293T cells
2.4 利用Western blot分析N3ICD蛋白的表达
为了验证重组质粒在HEK293T细胞中的表达情况,我们采用了蛋白质免疫印迹法分析。转染pCMV-N3ICD质粒的实验组使用Flag抗体出现了明显的特异性条带,而转染p3×FLAG-CMV的载体质粒的对照组中未见相关条带,表明实验组有N3ICD目的蛋白的表达(图4)。

图4 Western blot检测N3ICD蛋白的表达(通过Flag标签显示)Fig. 4 Expression of N3ICD protein was detected by Western blot(shown by Flag tag)
2.5 过表达斑马鱼notch3基因对NF-κB家族基因启动子活性的影响
将构建好的重组质粒pCMV-notch3分别与NF-κB家族rela和 nfκb1启动子报告基因共转至HEK293T细胞,即在HEK293T细胞中过表达斑马鱼notch3基因,利用双荧光素酶报告系统检测细胞中NF-κB家族rela和nfκb1启动子报告基因的转录活性。结果显示过表达斑马鱼notch3基因后,pGL3-rela-promoter-Enhancer和 pGL3-nfκb1-Enhancer启 动子的转录活性均显著升高,rela启动子活性约为对照组的4.5倍,nfκb1转录活性约为对照组活性的7倍(图5)。
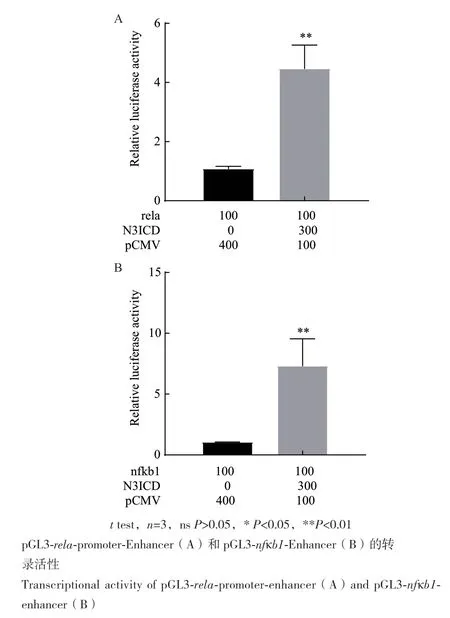
图5 过表达斑马鱼notch3基因Fig. 5 Overexpression of notch3 gene
3 讨论
Notch信号是胚胎和成年动物组织中调节细胞命运的重要信号通路。很多研究都表明了其在发育中的重要作用,在哺乳动物中,Notch和TGF信号通路的相互调节可以延缓肾间质纤维化的进程[20]。同时,Notch 信号通路参与调控肺动脉内皮细胞的凋亡及肺动脉血管平滑肌细胞表型转换的过程,可以导致肺动脉高压肺血管重构的发生[21]。此外,Notch信号被认为是影响肿瘤细胞与肿瘤微环境(tumor microenvironment,TME)的重要通路之一,Notch 信号能够介导许多分子的分泌,从而影响TME 中的细胞功能[22]。还有研究表明Notch1和Notch3之间的相互作用促进了鳞状细胞癌的增殖及上皮间质转化和肿瘤的发生[23]。最近的研究发现,Notch3对发育和人类的健康都十分重要,Notch3也越来越受到关注,如Notch3信号传导的异常会促进血管的过度出芽[24],还能够影响常染色体显性遗传脑动脉病以及癌症等[25]。然而,相较于Notch3,Notch家族的其他成员具有更明显的多效性作用,所以对于Notch3的研究还不深入。本研究构建了斑马鱼N3ICD真核表达载体,对其序列特征进行了生物信息学分析,并从测序、亚细胞定位和Western blot等方面进行了验证,旨在进一步研究Notch3不同于其他Notch蛋白的独特调控方式,为探究Notch3在发育和免疫中的功能打下基础。同时为Notch3的异常表达和调控而导致的疾病,开发出更具针对性的治疗方案提供帮助。
近年来,越来越多的证据表明,Notch信号参与了天然免疫反应的调节,特别是巨噬细胞活化和极化的调控。在过去的几年中,多项研究表明,Notch信号在髓样细胞(尤其是巨噬细胞)的分化和激活中具有关键作用[26],并参与炎症性相关疾病的发生。在不同的炎症疾病模型中,Notch受体表达的增加能够引起病理性炎症[27]。Notch3通过其活性、表达改变或错误调节与人类疾病密切相关。在大肠癌患者中,Notch3表达与肿瘤分级,淋巴结的存在以及远端转移呈正相关,并且在间质大肠癌肿瘤中特异上调[28]。同时在哺乳动物中Notch3在炎症控制时也起重要作用,有报道显示Notch3能够影响NF-κB活化和促炎巨噬细胞的发育,Notch3可以促进NF-κB的激活并能够促进由TLR-4激活的巨噬细胞中促炎基因的表达[29]。在上述结果中,我们所构建的N3ICD真核表达载体能够明显增强NF-κB家族中rela和nfκb1启动子的活性。这不仅说明了我们构建的真核表达载体能够正常表达并行使功能,也进一步证明了Notch3与NF-κB家族密切相关,并能够影响NF-κB通路的活化,由此可见Notch3在炎症反应和免疫应答中也发挥着重要作用。我们的实验结果能够为今后于斑马鱼中深入研究Notch3在发育生物学、先天免疫及炎症等方面的功能提供帮助。
4 结论
本研究成功构建了斑马鱼N3ICD真核表达载体,并进行了表达分析,所构建的N3ICD真核表达载体能够对NF-κB家族中rela和nfκb1启动子的活性产生影响,使其活性明显升高。

