甜瓜黑斑病菌的拮抗细菌筛选、鉴定及发酵条件优化
施兆荣 孙述俊 张广荣 梅大海 刘彦超 杨成德
(1.甘肃农业大学植物保护学院/甘肃省农作物病虫害生物防治工程实验室,兰州 730070;2.甘肃省白银市农业技术服务中心,白银 730900)
甜瓜(Cucumis melo L.)果肉含有丰富的水分和维生素,市场需求量大且经济效益高,因此在世界各地均有栽培,我国甜瓜生产为华东、中南、西北主产区三足鼎立的布局。近年来,甜瓜连年种植,重茬面积越来越大,病原菌积累越来越多,导致甜瓜病害发生日趋严重,特别是甜瓜黑斑病更是普遍发生的病害之一[1-2]。甜瓜黑斑病是由链格孢属(Alternaria spp.)真菌引起的严重病害,发病后多数叶片染病枯死,同时可危害成熟期果实。目前化学防治是最主要的防治措施,但长期使用化学农药极易使病原菌产生抗性,也会在果实上造成农药残留污染环境。由于生物防治是利用生物的代谢产物或生物体本身来拮抗病原菌,对环境和人类安全无害,因此利用优良拮抗细菌对甜瓜病害进行生物防治已成为目前研究的热点之一,如李怡等[3]从甜瓜根际酸性土壤中分离筛选到1株耐铝甜瓜枯萎病的拮抗菌 A2(Pseudomonas sp.),杨良等[4]从新疆甜瓜根际土壤中分离到1株甜瓜细菌性斑点病拮抗菌P-13(Streptomyces rochei),马英元等[5]从高抗甜瓜品种内分离出枯草芽胞杆菌(Bacillus subtilis)Mg15,其对甜瓜白粉病具有显著防治效果,刘建利等[6]报道乌拉尔甘草的8株内生细菌对甜瓜采后病害抑制能力较强。但有关利用甜瓜内生细菌防治其病害的报道未见报道。因此,本试验通过平板稀释分离法从健康甜瓜植株中分离内生细菌,筛选甜瓜黑斑病菌的优良拮抗菌,对其进行形态学和分子生物学鉴定,并进行发酵条件优化,旨在为甜瓜黑斑病的生物防治提供菌种资源,也为内生细菌资源的开发利用提供依据。
1 材料与方法
1.1 材料
1.1.1 供试材料 供试病原真菌:甜瓜黑斑病菌(Alternaria tenuissima)保存于甘肃农业大学植物保护学院植物病理实验室。
供试拮抗内生细菌:分离自2020年6月采集的健康甜瓜植株。
1.1.2 供试培养基 供试培养基A:马铃薯200 g,蛋白胨10 g,蔗糖20 g,水1 000 mL;B:NYD培养基;C:LB培养基;D:玉米淀粉3 g,(NH4)2SO410 g,KH2PO415 g,蔗糖 10 g,水 1 000 mL;E:BPY培养基;F:NA培养基;G:YPG培养基;参考文献[7-9]配制。
1.2 方法
1.2.1 内生细菌的分离及拮抗菌株的筛选 将采集到的甜瓜根、茎、叶和果实采用平板稀释法分离内生细菌,为了检验分离材料表面是否还存在活微生物,先将表面杀菌消毒后最后一遍冲洗的无菌水涂布在培养基平板上,将培养皿放在与分离的内生细菌相同温度环境下的恒温箱中培养3-5 d。若发现皿中无菌落出现,证明分离到的微生物是内生菌,否则,该分离结果不能使用[10]。挑取不同形态的单菌落采用平板划线法纯化并编号保存备用。
以甜瓜黑斑病菌为指示菌,采用平板对峙法[11]筛选拮抗内生细菌。抑制率(%)=(对照组菌落直径-处理组菌落直径)/(对照组菌落-菌饼直径)×100%。
采用离体甜瓜接种。在表皮光滑、健康的甜瓜果实上用接种针制造伤口,接种浓度为107CFU/mL的甜瓜黑斑病病原菌孢子悬浮液,36 h后接种初步筛选的拮抗细菌的菌液,并用接种清水作对照3次重复,7 d后测量病斑大小,计算防治效果。
(2) 任给O1,O2∈O(X),csO1,csO2∈τ,下证csO1∩csO2∈τ。由O1∩O2∈O(X),又只需证csO1∩csO2=cs(O1∩O2)即可。
防效(%)=(对照病斑直径-处理病斑直径)/对照病斑直径×100%。
1.2.2 优良拮抗细菌的鉴定 形态学鉴定:将纯化后的优良内生拮抗细菌接于NA培养基,置28℃恒温箱中培养3 d后,观察描述菌落形态,18-24 h菌龄进行革兰氏染色并在显微镜下观察、拍照[12]。
分子生物学鉴定:利用TIANGEN细菌基因组DNA试剂盒按其说明方法提取内生细菌的基因组DNA。使用通用引物 27F(5′-AGAGTTTGATCCTGGCTCAG-3′)/1492R(5′-GGTTACCTTGTTACGACTT-3′)进行16S rDNA的PCR扩增。扩增体系为50 μL,反应体系 :Mix 25 μL、DNA 2 μL、27F和 1492R 各 2 μL、ddH2O 19 μL;扩增程序为94℃预变性5 min;94℃变性1 min,48℃退火30 min,72℃延伸1 min,32个循环,最后72℃延伸8 min。使用gyrB基因引物:UP-1(5′-GAAGTCATCATGACCGTTCTGCAYGCNGGNGGNAARTTYGA-3′)/UP-2R(5′-AGCAGGGTAC GGATGTGCGAGCCRTCNACRTCNGCRTCNGTCAT-3′)进行gyrB序列扩增。50 μL反应体系与16S rDNA的反应体系相同;反应程序:94℃预变性4 min,94℃变性1 min,57℃退火1 min,72℃延伸70 s,35个循环,最后72℃延伸10 min。将PCR扩增产物送兰州天启基因公司测序,将测得的序列与GenBank中的相关数据进行Blast相似性分析,并与GenBank数据库中已报道的相似序列用Mega(7.0)软件的邻接法构建系统发育树。
1.2.3 优良拮抗内生细菌发酵条件优化
1.2.3.1 种子液制备 将优良拮抗内生细菌接种于装有50 mL NA培养基的150 mL锥形瓶中,在28℃、180 r/min的条件下培养24 h,制得种子液备用。
1.2.3.2 基础培养基的优化 将1.1.2中的供试培养基A-G溶液装入150 mL的锥形瓶中50 mL,3次重复,灭菌后接入2 mL种子液,在温度28℃、转速180 r/min的恒温振荡箱中培养24 h,通过测定发酵菌液的OD600确定生物量,以确定最佳基础培养基。
1.2.3.3 碳源、氮源和无机盐优化 分别以蔗糖、玉米淀粉、麦芽糖、甘露醇和D-果糖代替1.2.3.2优化的基础培养基中的碳源,以无碳源作对照;以尿素、(NH4)2SO4、KNO3、NH4Cl和硝酸钠代替基础培养基中的氮源,以无氮源作对照;以KH2PO4、CuSO4、CaCl2、NaCl、ZnSO4和 CaCO3代替培养基中的无机盐,以不加无机盐为对照。其他方法同1.2.3.2,优化碳源、氮源和无机盐。
1.2.3.4 正交试验 将优化的最佳碳、氮源和无机盐分别设置为 0、5、10、15、20、25、30 g/L,其他方法同1.2.3.2,优化碳、氮源和无机盐最适浓度。

表1 L9(33)正交试验设计Table 1 Design of L9(33)orthogonal experiment
1.2.3.5 培养条件优化 采用优化培养基组合,依次进行发酵条件优化,并将优化结果应用于下一条件优化。设置转速为 120、150、180、210 和 240 r/min,温度为20、24、28、32和36℃,150 mL锥形瓶装液量为10、30、50和70 mL,接种量为0.1%、0.2%、0.3%、0.5%、1%、5%、10%、15%和20%,pH为4、5、6、7、8、9、10和自然条件下的pH7.5;每个处理重复3次,测定发酵液的吸光度(OD600),优化培养条件。
1.2.3.6 最适发酵时间优化 采用优化最适培养基组合与最佳发酵条件,设置发酵时间为2、4、6、12、18、24、30、36、42、48、54、60 和 72 h, 每个处理重复3次,测定发酵液的吸光度(OD600),确定最适发酵时间。
2 结果
2.1 内生细菌的分离及拮抗菌株的筛选
从采集到的健康甜瓜植株上共分离获得50株内生细菌,21株对甜瓜黑斑病菌具有拮抗作用(表2),其中G2的抑菌率最高,达76.41%(图1)。
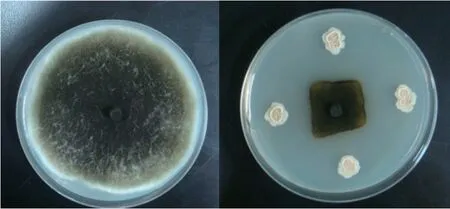
图1 菌株G2对甜瓜黑斑病菌的拮抗效果Fig.1 Effect of strain G2 against melon black spot

表2 甜瓜黑斑病菌拮抗菌的筛选Table 2 Screening of antagonistic bacteria against melon black spot
拮抗菌株对甜瓜黑斑病的防效试验结果表明(表3),菌株G2病斑大小明显小于清水对照。处理7 d后,菌株G2对甜瓜黑斑病的防效达到44.90%。
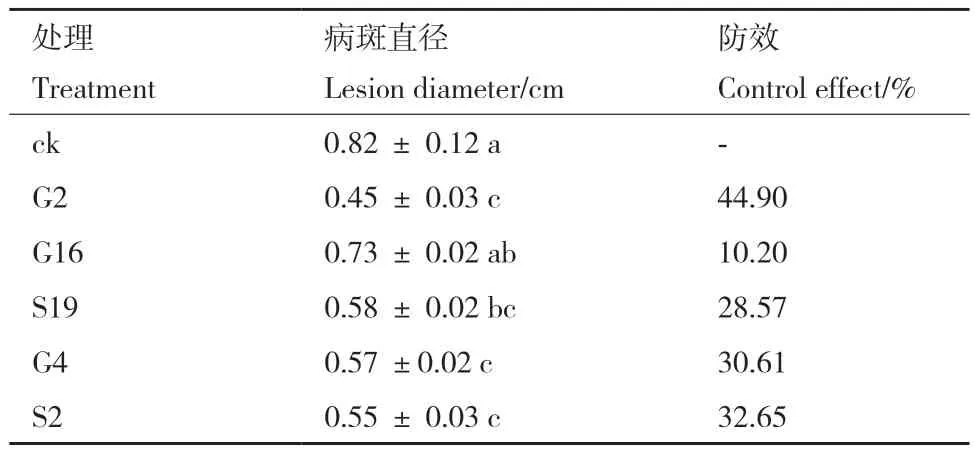
表3 拮抗菌株对甜瓜黑斑病的防效Table 3 Control effects of antagonistic strains on melon black spot
2.2 拮抗菌株G2的鉴定
2.2.1 形态学鉴定 菌株G2在NA培养基上菌落呈白色近圆形,表面干燥,无光泽,边缘不规则,不透明,菌落中间褶皱突起(图2-A);革兰染色呈阳性,菌体呈杆状,两端钝圆(图2-B)。
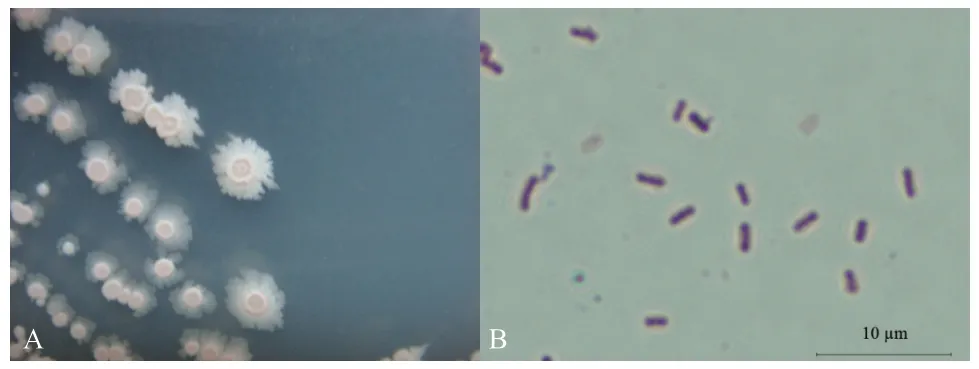
图2 菌株G2的单菌落(A)和革兰氏染色(B)Fig.2 Colony(A)and Gram stain(B)of strain G2
2.2.2 基因序列分析鉴定 以菌株G2的DNA为模板,采用16S rDNA与gyrB序列对其进行扩增和测序,分别获得1 444 bp和1 191 bp的基因片段(GenBank登录号分别为MW467894、MW490569),对其进行BLAST分析比对并构建系统发育树(图3),结果显示与16S rDNA基因序列与枯草芽孢杆菌同源性达到100%和99%,gyrB序列与枯草芽孢杆菌同源性达到97%和96%,且在系统发育树上聚在一起,结合形态特征将其鉴定为枯草芽孢杆菌。

图3 菌株G2基于16S rDNA和gyrB序列的系统发育树Fig.3 Phylogenetic tree of strain G2 based on 16S rDNA and gyrB sequence
2.3 拮抗内生细菌发酵条件优化
2.3.1 基础培养基优化 结果表明,菌株G2在G培养基中培养24 h时生物量最大,其OD600为2.219,显著高于其它培养基(P<0.05),说明G培养基为最适基础培养基(图4)。
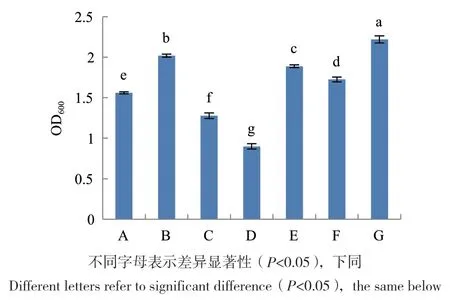
图4 基础培养基对菌株G2生长的影响Fig.4 Effect of basal medium on the growth of strain G2
2.3.2 碳源、氮源和无机盐优化 单因素试验结果表明,菌株G2在以玉米淀粉为碳源时OD600值最小为0.710,说明玉米淀粉不利于G2的生长,以蔗糖、D-果糖或葡萄糖为碳源时其生物量显著高于其它碳源(P<0.05),OD600分 别 为 2.223、2.239和 2.219,且三者间差异不显著,但由于葡萄糖成本较低,性价比较高,因此选择葡萄糖作为最佳碳源(图5);以硝酸钠和蛋白胨为氮源时发酵菌液OD600值显著高于其它氮源(P<0.05),且两者差异不显著,由于硝酸钠成本较低,因此选用硝酸钠作为最佳氮源(图6);由于G培养基中没有无机盐的存在,参考其它含量配比将无机盐的浓度统一设置为5 g/L,试验结果表明以CuSO4、ZnSO4和CaCl2为无机盐时显著低于不加无机盐时发酵菌液吸光值,说明其抑制G2的生长,以NaCl为无机盐时OD600最大为2.233,且NaCl更加常见、易于储存,所以选择NaCl作为最佳无机盐(图7)。
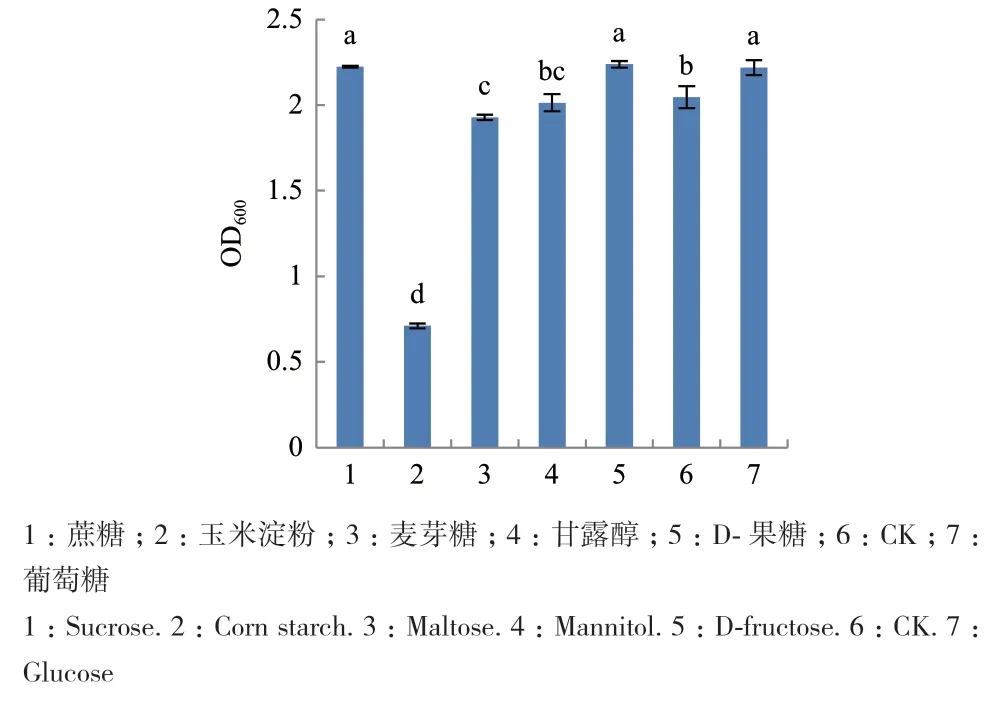
图5 碳源对菌株G2生长的影响Fig.5 Effects of carbon sources on the growth of strain G2
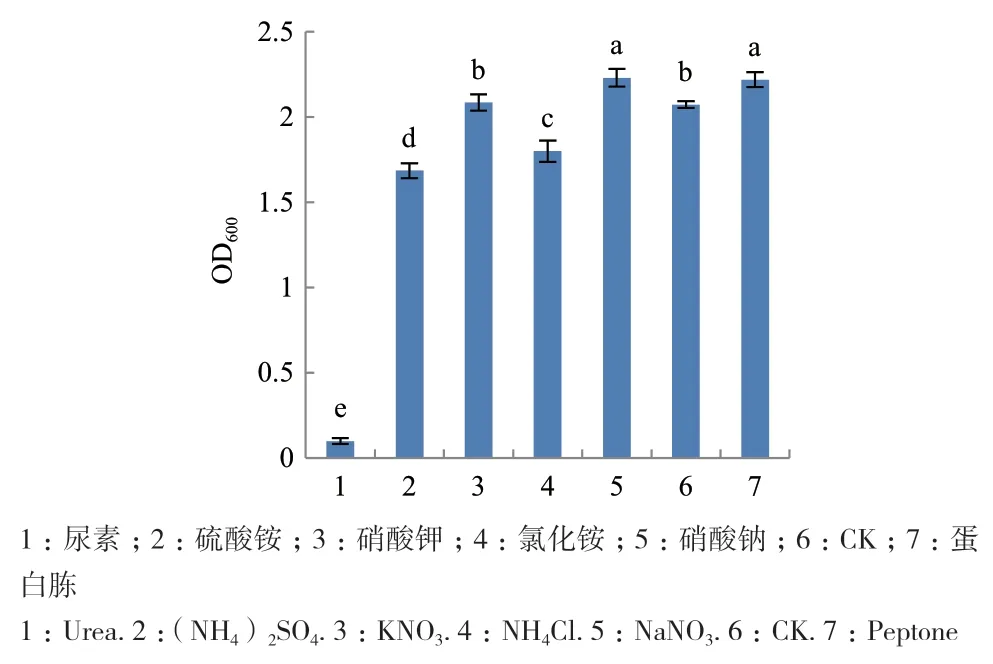
图6 氮源对菌株G2生长的影响Fig.6 Effects of nitrogen sources on the growth of strain G2
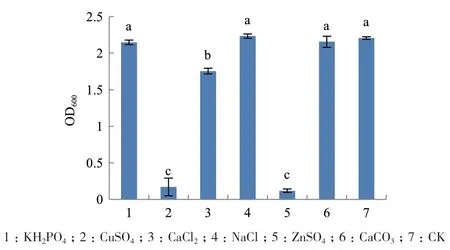
图7 无机盐对菌株G2生长的影响Fig.7 Effects of inorganic salts on the growth of strain G2
2.3.3 正交试验优化 当葡萄糖浓度在20、25或30 g/L时发酵液吸光值显著高于其它浓度(P<0.05)(图8);当硝酸钠在25 g/L时发酵液吸光值最大,其次为15 g/L和20 g/L(图9);当NaCl在0和5 g/L时发酵菌液吸光值较高,其次为15 g/L(图10)。因此选择葡萄糖的浓度为20、25或30 g/L,硝酸钠的浓度为15、20或25 g/L,NaCl的浓度为0、5和15 g/L进行正交试验。

图8 葡萄糖浓度对菌株G2生长的影响Fig.8 Effects of glucose concentration on the growth of strain G2
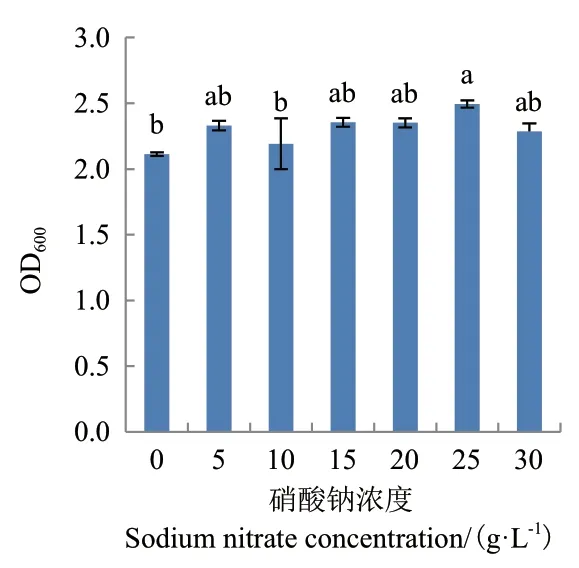
图9 NaNO3浓度对菌株G2生长的影响Fig.9 Effects of sodium nitrate on the growth of strain G2
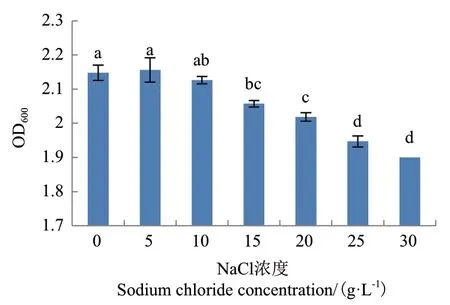
图10 NaCl浓度对菌株G2生长的影响Fig.10 Effects of sodium chloride on the growth of strain G2
正交试验结果表明(表4),6号处理的生物量最高,OD600为2.586,高于最优展望组合:葡萄糖20 g、硝酸钠25 g、NaCl 10 g、酵母膏10 g和水1 000 mL的OD600值2.543,但与除1、9与CK外无显著差异,由于处理6所需成本较低,故确定最适宜菌株G2生长的碳源、氮源和无机盐的浓度配比为葡萄糖20 g、硝酸钠30 g、酵母膏10 g和水1 000 mL。
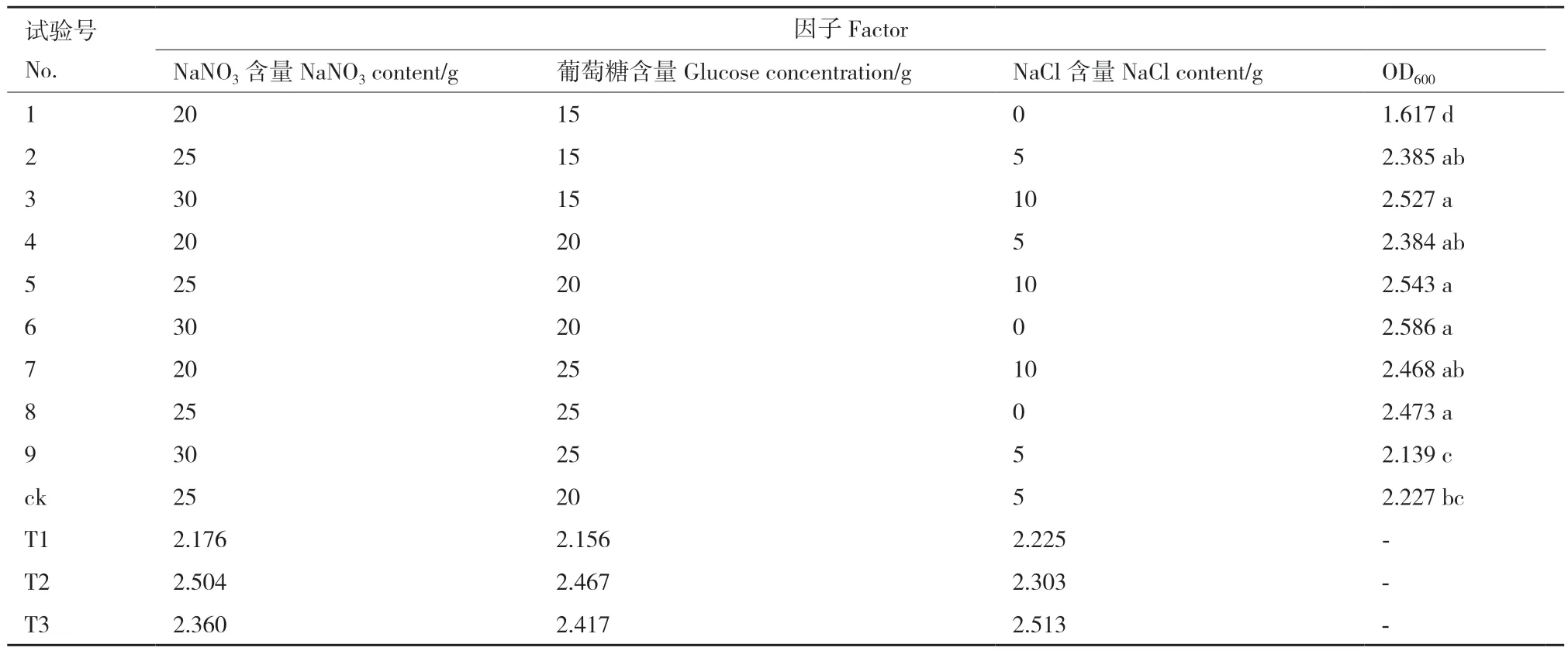
表4 正交试验优化Table 4 Orthogonal experiment
2.3.4 培养条件优化
2.3.4.1 转速优化 菌株G2在120-150 r/min均能生长,在转速为120 r/min时,发酵液OD600值为1.779,显著低于其它转速(P<0.05),菌株在转速为150 r/min时,发酵液OD600值最大,为2.354(图11),因此最佳转速为150 r/min。
2.3.4.2 温度优化 在20℃时发酵液的OD600仅为0.114,显著低于其它温度(P<0.05),在32℃时菌株生物量达到最大,OD600为2.652,之后生物量随温度的增加呈下降趋势(图12),因此菌株生长的最适温度为32℃。
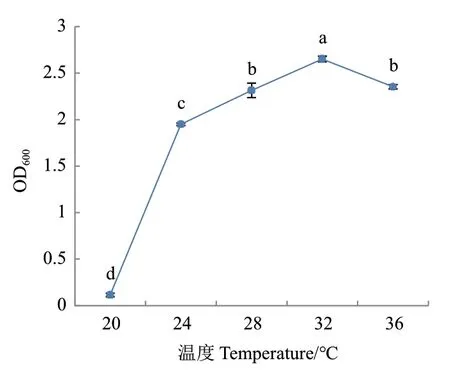
图12 温度对菌株G2生长的影响Fig.12 Effects of temperature on the growth of strain G2
2.3.4.3 装液量和接种量优化 当装液量为30 mL或50 mL时其发酵液OD600值分别为2.655和2.693(图 13),显著高于其它条件(P<0.05),但两者之间差异不显著,由于在装液量为50 mL时更为经济,因此最佳装液量为150 mL摇瓶中装液50 mL。

图11转速对菌株G2生长的影响Fig.11 Effects of rotation speed on the growth of strain G2
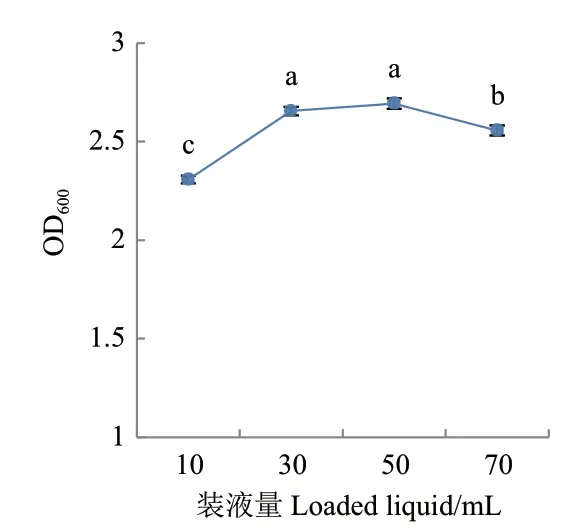
图13 装液量对菌株G2生长的影响Fig.13 Effects of liquid volumes on the growth of strain G2
对接种量的优化结果表明(图14),当接种量超过0.5%后菌株的生物量随着接种量的增加而逐渐减少,接种量在0.1%-0.5%之间差异不显著,但在0.2%时OD600值最大,为2.758,因此确定最佳接种量为0.2%。
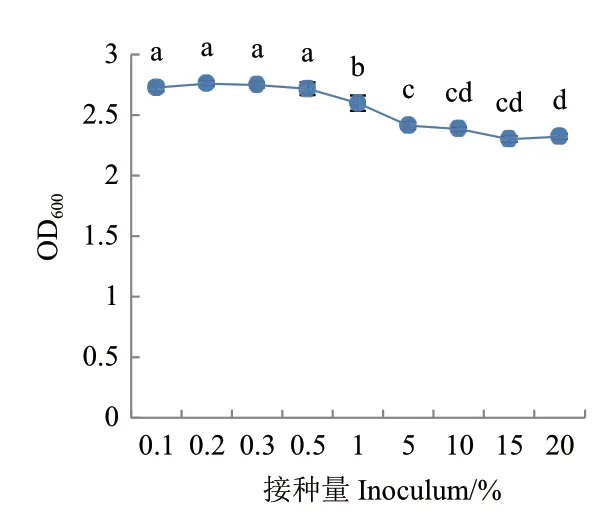
图14 接种量对菌株G2生长的影响Fig.14 Effects of inoculation size onthe growth of strain G2
2.3.4.4 初始pH优化 试验结果表明(图15),菌株G2在pH为5-10均能正常生长,当pH为5-9时生物量较大,显著高于pH为4和10(P<0.05),但各处理之间差异不显著,其中由蒸馏水直接配制的培养基(对照)的pH值为7.5,其OD600最大为2.554,因此最适初始pH为7.5。

图15 不同pH对菌株G2生长的影响Fig.15 Effects of different pH values on the growth of strain G2
2.3.5 最适发酵时间优化 结果表明(图16),菌株G2的延缓期为4 h,之后进入对数期,到18 h菌株的生物量逐渐趋于稳定,此时OD600为2.654。因此菌株最佳发酵时间为18 h。

图16 发酵时间对菌株G2生长的影响Fig.16 Effects of fermentation time on the growth of strain G2
3 讨论
甜瓜黑斑病是由链格孢菌引起的甜瓜重要病害之一,然而长期、连续用药使病原菌产生了抗药性,导致化学药剂防治效果逐年下降,并且化学药剂残留严重污染农产品和环境,危及人畜健康。消费者对食品中的农药残留和环境安全日益关注,对开发病害控制的替代方法的需求也在不断增加[13]。内生细菌存在于宿主植物的内部组织中,可以在植物体内繁殖和生长,不易受环境条件影响,在自然发生的生物防治和人工应用于植物病害生物防治实践中,都显示出良好的优势和应用前景,成为生物防治中有潜力的生防菌而加以利用[14]。本试验从甜瓜健康植株的根、茎、叶和果实中采用平板稀释法分离出内生细菌50株,与高增贵等[15]从25叶期甜瓜根茎部共分离纯化了内生细菌81株相比本试验分离数量较少,与马元英等[5]从甜瓜高抗白粉病品种MR-1′不同组织中共分离纯化到31株内生细菌相比本试验分离数量较多,这可能与植株的生育期和品种等有关,也可能是化学消毒剂的使用导致内生细菌数量和种类减少;本试验利用细极链格孢作指示菌进行平板对峙试验,21株内生细菌抑菌率在70%以上,占总菌株的42%,其中菌株G2抑菌率最高,达76.41%,高于兰琴英等[16]从红豆杉中分离的TB02和TB03对细极链格孢的抑制率,可见菌株G2在防治细极链格孢引起的病害时具有较大潜力。
近年来微生物分类更新周期快,对菌株准确鉴定的难度越来越大,因此需要将传统的方法与先进的分子生物学方法相结合,本试验根据病原菌形态学特征,结合16S rDNA与gyrB基因分析将菌株G2鉴定为枯草芽孢杆菌。目前在国内外的研究中,枯草芽孢杆菌由于其次级代谢产物多、对环境友好等优势成为生防菌关注的热点之一[17],如利用枯草芽孢杆菌防治葡萄灰霉病(Botrytis cinerea)[18]、库尔勒香梨黑头病(Alternaria brassicicola)[19]、小麦赤霉病(Fusarium graminearum)[20]和玉米叶斑病(Bipolaris papendorfii)[21]。
发酵条件的优化是提高生物农药制剂的抑菌效果、节约其生产成本的关键问题,也是生防菌株从实验室走向市场的重要步骤[22]。目前,研究微生物发酵条件优化的方法有单因素法、多因子法、正交实验法和响应面法等,这些方法都有自身的优点和缺陷。本试验采用单因素法和正交试验法对枯草芽孢杆菌菌株G2进行液体发酵条件优化,结果表明最适发酵培养基配方为葡萄糖20 g、硝酸钠30 g、酵母膏10 g和水1 000 mL;最优发酵条件为摇床转速150 r/min,温度32℃,150 mL摇瓶装液50 mL,最佳接种量为0.2%,培养基初始pH为7.5;其最佳发酵时间为18 h。该研究与陈莉等[23]报道的发酵时间相同,但装液量较高、最佳转速与温度较低,因此更高效;与张慧等[24]对枯草芽胞杆菌CS27的研究结论除接种量相差很大外其他发酵条件均一致,本试验接种量为0.2%远远低于文献报道的10%,可能是因菌株G2对培养条件的要求较低,在发酵过程中可快速繁殖,节省成本和时间;大多数研究[23-24]表明枯草芽孢杆菌的最佳初始pH为6-7.5之间,与本试验结果相似,说明该菌适宜在中性条件下生长;但培养基配方与其均有所差别,可能是由于菌株生物学特性差异所致。本试验对筛选出的优良拮抗菌进行了液体发酵,下一步将对田间防效进行试验,以期能开发出稳定性好、防效高的微生物源农药。
试验结果表明枯草芽孢杆菌对细极链格孢引起的甜瓜黑斑有显著抑制作用,为甜瓜黑斑病的生物防治提供菌种资源,也为内生细菌资源的开发利用提供依据。
4 结论
分离得到50株内生细菌,21株对细极链格孢具有拮抗作用,11株的抑制率达到70%以上,其中菌株G2的抑菌率最高,达76.41%,经形态特征和基因序列分析鉴定为枯草芽孢杆菌(Bacillus subtilis),其最优发酵培养基为葡萄糖20 g、硝酸钠30 g、酵母膏10 g和水1 000 mL,最优发酵条件为摇床转速150 r/min,温度32℃,150 mL摇瓶装液50 mL,最佳接种量为0.2%,培养基初始pH为7.5,其最佳发酵时间为18 h。

