木槿品种对镉胁迫的生理响应及耐镉能力评价
杨馥榕 王晓红 肖琪 方娟 李立华
(中南林业科技大学风景园林学院,长沙 410004)
2014年《全国土壤污染状况调查公报》显示,西南、中南地区土壤中重金属含量超标严重,其中镉的点位超标率最高,为7.0%[1]。随着镉污染的日益严峻[2],土壤中超标的重金属镉会造成植株长势不佳甚至死亡,进而对生态环境造成严重影响。镉具有高毒性与高迁移性,被植物吸收后可以通过食物链直接或间接进入人体,威胁人的身体健康[3],如水稻(Oryza sativa)[4]。土壤改良技术中种植耐镉能力强或镉富集能力强的植物性价比最高,既改良土壤又美化环境。对于城市绿地而言,美化环境更为重要,种植耐镉能力强的植物更具有实用性。早在上个世纪,Prasann等[5]便发现光叶子花(Bougainvillea glabra)、红椿(Toona ciliata Roem)、使君子(Quisqualis indica)等植物有清除土壤、淤泥中重金属的作用,是很好的重金属富集植物,还能够有效地净化土壤。许艳萍等[6]对大麻(Cannabis sativa)进行了镉胁迫实验,发现它不仅具有高镉耐受能力,还具有高镉富集能力,是很好的土壤净化植物,白桦(Betula platyphylla Suk)[7]、火炬树(Rhus Typhina Nutt)[8]等植物也有类似的报道,另外还发现同种植物不同品种的耐镉能力差异较大[9]。
木槿(Hibiscus syriacus L.)为锦葵科木槿属落叶灌木,在我国分布广泛,因其花色丰富、花期漫长,一直是优良的夏季观花植物,乡村、城市均适宜种植,应用前景广阔。以往研究发现,木槿能在一定程度上抵御盐碱[10]、铝[11]的胁迫,而且不同品种对干旱[12]、低温[13]等恶劣环境的耐受性有差异。王小雪[14]、邓勇[15]先后对木槿同属植物海滨木槿(Hibiscus hamabo)、红麻(Hibiscus cannabinus)进行镉胁迫研究,发现它们具有较强的耐镉能力,推测木槿可能也具有较强的耐镉能力。目前关于木槿耐镉能力的研究比较薄弱,国内文献鲜见报道,故而对不同木槿品种进行镉胁迫研究具有重要意义。为此,选择观赏价值较高、湖南生长良好、抗逆性普遍较强的3个木槿品种进行镉胁迫实验,品种分别为‘牡丹’(‘f. paeoniflorus’)、‘红星’(‘Hong xing’)与‘白花重瓣’(‘f. albus-plenus’),通过对其生长、生理指标的测定,探讨并比较3个品种在不同时间、不同镉浓度下的耐受能力,选出耐受能力最强的品种,为木槿在镉污染地区的推广与利用提供理论依据。
1 材料与方法
1.1 材料
以来自湖南省森林植物园的‘牡丹’、‘红星’与‘白花重瓣’2年生扦插苗为实验材料,统一种植,每盆装入800 g干土,栽苗1株,置于中南林业科技大学风景园林学院楼顶,缓苗30 d,选取生长状况良好、长势一致的植株作为试验材料。
1.2 方法
1.2.1 试验方法 试验于2020年6-9月进行,将CdCl2·2.5H2O配成Cd2+含量为8 g/L的母液,于每天傍晚,每盆取5 mL母液进行稀释,均匀浇灌,浇灌结束的处理组,使用清水继续浇灌,直至盆内Cd2+浓度分别达到 0、50、100、200、400 mg/kg,以0 mg/kg处理组为对照(CK)。每个处理3株,重复3次。
处理0、60 d,利用游标卡尺和量尺测定固定植株的株高、地径。处理0、15、30、45、60 d时,于早上(8:00-9:00)每组随机采摘位置、大小、数量一致的成熟叶片,清洗干净后备用。测定时,叶绿素A+B含量利用丙酮浸泡法,可溶性蛋白含量利用考马斯亮蓝 G-250染色法,游离脯氨酸含量利用茚三酮显色法,SOD活性利用氮蓝四唑(NBT)光还原法,丙二醛含量利用TBA 显色法等方法进行测定[16-17]。
1.2.2 数据分析 利用EXCEL 2016软件进行数据统计、SPSS 22.0软件进行数据分析、Origin 2018软件进行绘图,采用比较隶属函数值得方法进行耐Cd性评价。
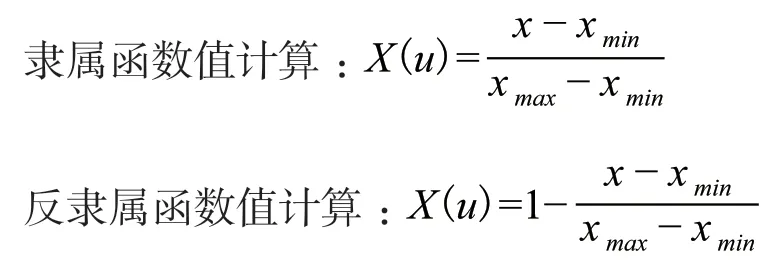
公式中,X(u)为测定指标的隶属函数值,x、xmin、xmax分别表示该指标的平均值、最小值和最大值。若该指标与植物的耐镉能力呈正相关则用隶属函数值计算方式,反之则用反隶属函数值计算方式。根据每个品种的各指标的隶属函数值的平均值比较得出3个木槿品种的耐镉能力排序。
2 结果
2.1 镉胁迫对木槿品种生长特性的影响
处理60 d后随胁迫浓度的升高,‘牡丹’的株高增长量逐渐下降,‘红星’和‘白花重瓣’则先上升后下降;地径增长量则完全相反,‘牡丹’先上升后下降,‘红星’和‘白花重瓣’持续下降(表1)。‘牡丹’的株高增长量在200、400 mg/kg处理组的株高增长量与CK相比,分别显著下降了78.5%、84.3%;‘红星’400 mg/kg处理组的株高增长量与CK相比,显著下降了62.6%;‘白花重瓣’变化不显著;3个木槿品种的地径增长量变化均不显著。极高浓度(400 mg/kg)镉胁迫对3个品种的生长均有抑制作用,其它浓度处理对株高、地径增长量的影响有所不同,株高增长量的变化幅度更大。
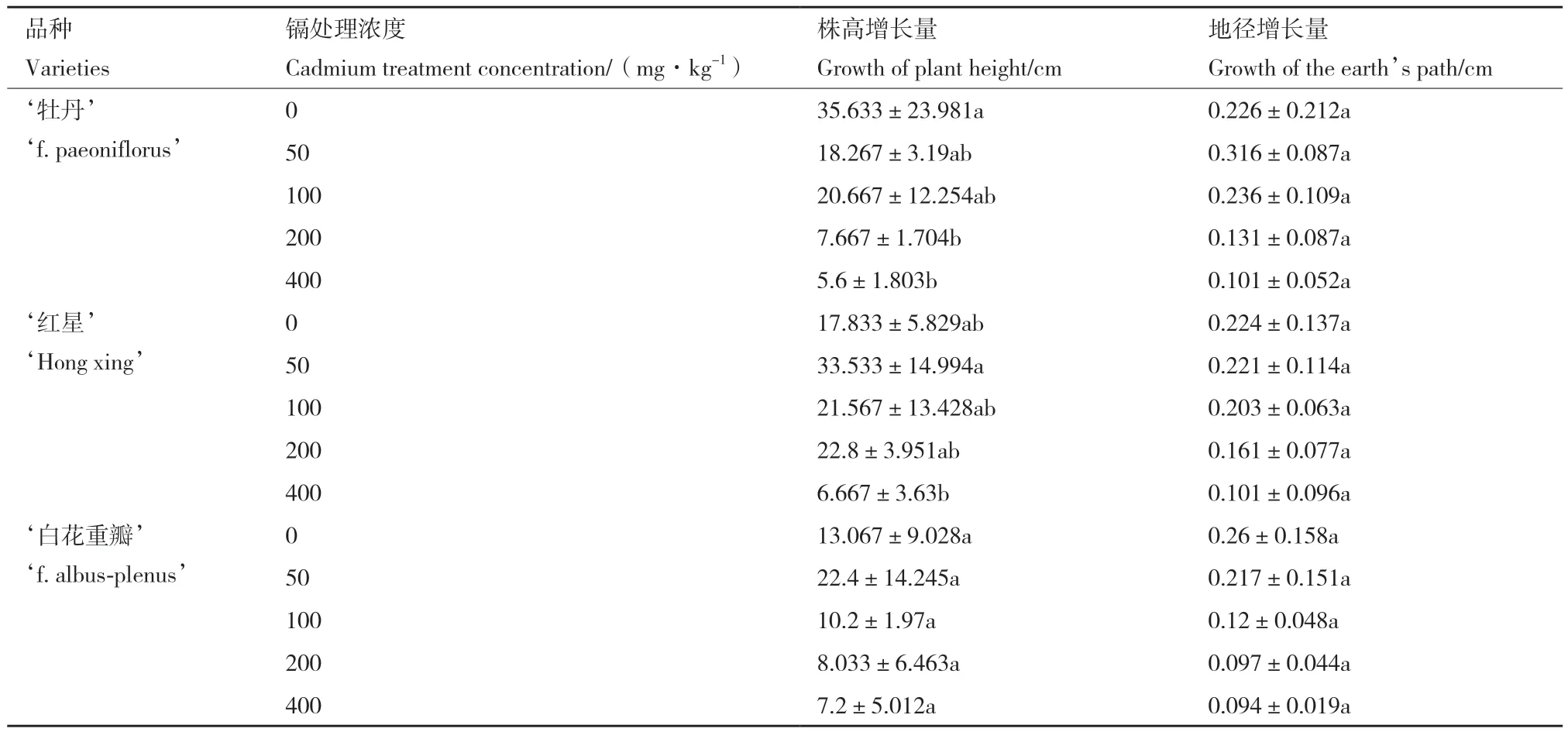
表1 不同镉浓度处理60 d后3个木槿品种生长指标变化情况Table 1 Changes of growth indexes of three Hibiscus syriacus varieties treated with different cadmium concentrations for 60 d
2.2 镉胁迫对木槿品种生理特性的影响
2.2.1 叶片叶绿素A+B含量变化影响 木槿叶片叶绿素A+B含量随着胁迫浓度的升高逐渐下降或呈先上升后下降(图1)。第45天,‘白花重瓣’200、400 mg/kg处理组的叶绿素A+B含量与CK相比分别显著下降了14.5%、18.1%(图1-C)。第60天,‘牡丹’50、100、200、400 mg/kg处理组的叶绿素A+B含量比CK相比分别显著下降了20.5%、67.5%、75.6%、75.3%( 图 1-A);‘红星’100、200、400 mg/kg处理组分别显著下降了56.3%、66.7%、77.3%(图1-B);‘白花重瓣’100、200、400 mg/kg处理组分别显著下降了36.8%、49.9%、57.0%(图1-C)。低浓度(50 mg/kg)镉胁迫使得叶绿素A+B含量有轻微升高;高浓度(200、400 mg/kg)镉胁迫使得叶绿素A+B含量下降明显,而且随着时间延长,下降程度加剧;3个品种中,‘牡丹’即使在低浓度处理下,叶绿素A+B含量依旧下降明显,而‘白花重瓣’在高浓度处理下叶绿素A+B含量最先出现显著下降。

图1 镉胁迫下3个木槿品种叶绿素A+B含量变化情况Fig. 1 Changes in chlorophyll A+B content of three H.syriacus varieties under cadmium stress
2.2.2 叶片可溶性蛋白含量变化情况 木槿叶片可溶性蛋白含量,在胁迫前期,随着胁迫浓度的上升先上升后下降;在胁迫后期,随着胁迫浓度的上升逐渐降低(图2)。‘牡丹’处理30 d,400 mg/kg处理组与CK相比显著下降了17.4%;处理45 d,200、400 mg/kg处理组与CK相比分别显著下降了14.7%、17.8%;处 理 60 d,100、200、400 mg/kg处 理 组与CK相比分别显著下降了21.5%、39.7%、46.4%(图2-A)。‘红星’处理45 d,400 mg/kg处理组与CK相比显著下降了19.0%;处理60 d,100、200、400 mg/kg处理组与CK相比分别显著下降了32.9%、42.4%、44.0%(图2-B)。‘白花重瓣’处理45 d,400 mg/kg处理组与CK相比显著下降了15.9%;处理60 d,100、200、400 mg/kg处理组与CK相比分别显著下降了21.5%、22.2%、29.2%(图2-C)。可以看出,高浓度镉胁迫下,‘牡丹’的可溶性蛋白含量下降程度最为明显。
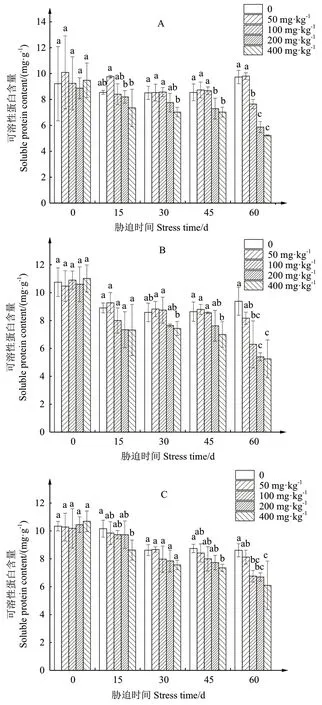
图2 镉胁迫下3个木槿品种可溶性蛋白含量变化情况Fig. 2 Changes in soluble protein content of three H.syriacus varieties under cadmium stress
2.2.3 叶片游离脯氨酸含量变化情况 木槿叶片游离脯氨酸含量多随着胁迫浓度的上升而升高,唯有‘牡丹’在处理60 d时,400 mg/kg处理组的游离脯氨酸含量出现急剧下降(图3)。‘牡丹’处理30、45 d,400 mg/kg处理组与CK相比差异显著,分别上升了149.3%、250.0%;处理60 d,50、100、200、400 mg/kg处理组与CK相比差异显著,分别上升了71.0%、130.2%、118.3%、79.9%(图3-A)。‘红星’处理30 d,400 mg/kg处理组与CK相比差异显著,上升了158.8%;处理45 d,100、200、400 mg/kg处理组与CK相比差异显著,分别上升了65.0%、112.2%、165.4%;处理60 d,100、200、400 mg/kg处理组与CK相比差异显著,分别上升了77.1%、151.9%、215.0%(图3-B)。‘白花重瓣’处理15、30、45 d,400 mg/kg处理组与CK相比差异显著,分别上升了90.7%、208.8%、149.5%;处理60 d,200、400 mg/kg处理组与CK相比差异显著,分别上升了118.1%、155.5%(图3-C)。据游离脯氨酸变化情况可知,与另外两个品种相比,‘牡丹’的游离脯氨酸含量最先出现下降。

图3 镉胁迫下3个木槿品种游离脯氨酸含量变化情况Fig. 3 Changes of free proline content in three H. syriacus varieties under cadmium stress
2.2.4 叶片丙二醛含量变化情况 木槿叶片丙二醛含量与游离脯氨酸含量变化趋势大致相似,但‘红星’高浓度镉胁迫处理组出现明显下降(图4)。‘红星’处理60 d,400 mg/kg 处理组的丙二醛含量与CK相比差显著下降了34.9%(图4-B);‘白花重瓣’处理15 d,200、400 mg/kg处理组与CK相比分别显著上升57.4%、60.5%(图4-C)。其中,高浓度镉胁迫对‘白花重瓣’的丙二醛含量的影响最小,至胁迫后期仍未出现明显下降。
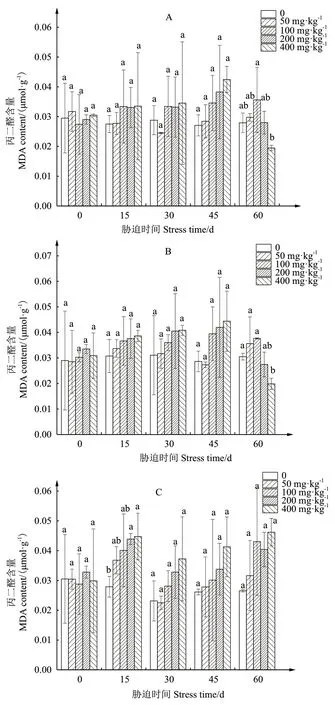
图4 镉胁迫下3个木槿品种丙二醛含量变化情况Fig. 4 Changes of MDA content in three H. syriacus varieties under cadmium stress
2.2.5 叶片SOD活性变化情况 随着胁迫浓度的上升,木槿的叶片SOD活性呈逐渐上升或先上升后下降趋势。‘牡丹’处理15 d,100、200、400 mg/kg处理组的SOD活性与CK相比显著上升17.8%、90.4%、108.9%;处理30 d,400 mg/kg处理组上升73.5%(图5-A)。‘红星’在400 mg/kg处理组下,处理30、60 d,SOD活性与CK相比分别下降了61.6%、43.7%(图5-B)。‘白花重瓣’100 mg/kg处理组下处理60 d,SOD活性变化与CK相比显著上升了70.9%(图5-C)。低浓度镉胁迫下,3个品种的SOD活性均有上升趋势;极高浓度镉胁迫下,‘红星’、‘白花重瓣’的SOD活性明显下降,而‘牡丹’的SOD活性仍保持上升。

图5 镉胁迫下3个木槿品种SOD活性变化情况Fig. 5 Changes of SOD activity in three H. syriacus varieties under cadmium stress
2.3 木槿品种耐Cd 能力综合评价
植株健康程度受多种指标影响,为避免评价的片面性,对多项指标进行隶属函数综合评价,根据评价结果对3个木槿品种的耐镉能力进行排序(表2)。在50、100 mg/kg处理组,3个木槿品种耐镉能力:‘红星’>‘白花重瓣’>‘牡丹’;在200 mg/kg处理组,3个木槿品种耐镉能力:‘红星’>‘牡丹’>‘白花重瓣’;在400 mg/kg处理组,3个木槿品种耐镉能力:‘白花重瓣’>‘红星’>‘牡丹’。这说明不同品种对不同镉浓度的耐受能力有所差别,其中‘红星’在镉浓度<400 mg/kg处理组的耐受能力最强;‘白花重瓣’在400 mg/kg处理组的耐受能力最强。
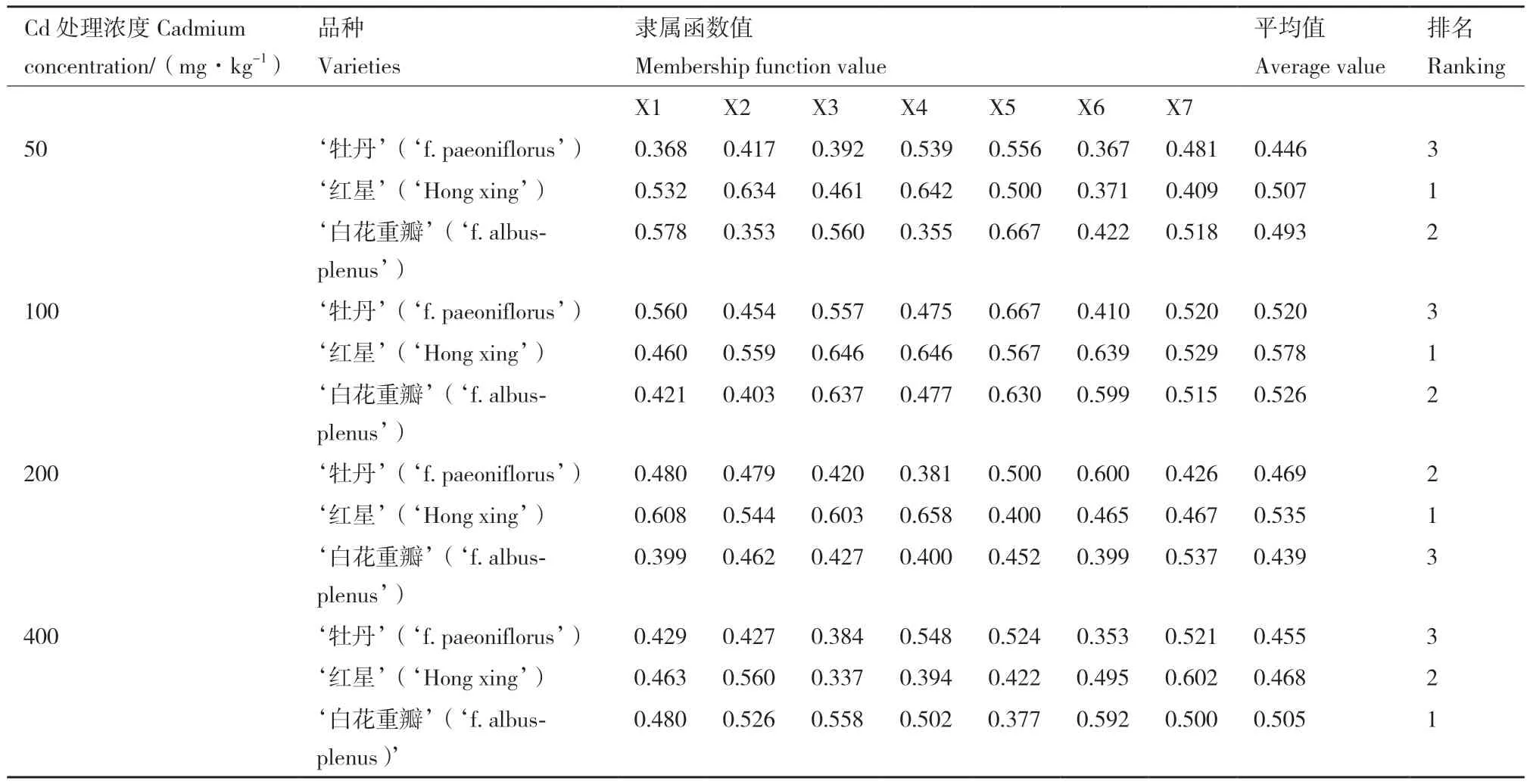
表2 3个木槿品种耐镉能力综合评价Table 2 Comprehensive evaluation of Cd resistance of three H. syriacus varieties
3 讨论
低浓度(50 mg/kg)镉处理下,木槿的株高、地径增长量较之CK有所上升,而叶绿素A+B含量、可溶性蛋白含量有短暂上升,但之后仍会出现下降。推测原因如下:第一,轻度胁迫下,植物产生应激反应导致株高、地径增长量与叶绿素A+B含量出现短暂上升;第二,轻度胁迫下,为调节体内的渗透平衡、缓解镉胁迫毒害,植株会产生镉结合蛋白将镉运出细胞,使得蛋白质含量上升;第三,随着时间延长,植物体内镉不断积累,胁迫程度加深,植株代谢受抑制。
当土壤中镉含量为100、200、400 mg/kg时,株高、地径增长量、叶绿素含量以及可溶性蛋白含量下降程度随时间延长逐渐加深。王佳星[18]、温瑀[19]等的实验结果表明,随胁迫浓度、胁迫时间的增加,胁迫程度逐渐加深,植物生长受抑制,出现矮小化、叶片黄化萎蔫。宋子文等[20]发现随胁迫浓度增加,大青杨(Populus ussuriensis Kom.)的株高、地径、叶绿素含量有显著下降。植株遭受镉毒害后,可能出现叶绿体结构被破坏、叶绿素合成相关酶活性降低、叶绿素分解相关酶活性提高,或者出现根系吸收的水分、营养物质减少,这些均会导致叶绿素合成受阻、分解加快[21-22],使得叶绿素含量降低。与此同时,可溶性蛋白的合成、水解相关酶可能也发生了类似变化,造成可溶性蛋白合成受阻、分解加剧[23],从而导致可溶性蛋白含量的降低。孙初赛[24]、刘翰升[25]等的研究证明,镉胁迫浓度对叶绿素、可溶性蛋白含量有低促高抑作用,且随着胁迫时间的延长,促进效果减弱、抑制效果加强[26-27]。
镉胁迫往往伴随着氧化胁迫,因此植物的抗氧化能力能一定程度反映其镉耐能力[28]。本次研究发现,木槿的游离脯氨酸含量、丙二醛含量、SOD活性和胁迫浓度呈正相关,但长时间、高浓度胁迫下,其含量均会出现不同程度的下降。胁迫前期,可能是因为活性氧的上升激活了植物的氧化应激机制,通过产生并积累大量的SOD与游离脯氨酸来抵御氧化胁迫,前者用于清除活性氧,后者可以调节渗透平衡、保护各种膜结构和酶类物质;以此同时,仍有部分膜结构被活性氧破坏,使得丙二醛含量出现上升。胁迫后期,因植物抵御氧化胁迫的能力是有限的[29],超出耐受限度后,随着SOD活性的降低或游离脯氨酸含量的下降,膜脂过氧化加剧,丙二醛含量继续上升,但当植物体内的细胞膜结构被大量破坏后,丙二醛含量也出现下降。这一结果证实了闫晶[30]、刘翰升等[31]的结论,但其中丙二醛含量的变化趋势与马月花等[32]关于黄芪(Astragalus propinquus Schischkin)的研究结果不符,这可能是因为植物材料、胁迫浓度与胁迫时间的不同造成的差异。
通过隶属函数方法分析发现,不同品种对不同浓度的镉耐受能力有差异。各浓度处理下,‘牡丹’耐受能力普遍偏低或最低;在50、100、200 mg/kg浓度处理下,‘红星’的耐受能力均最强;在400 mg/kg处理下,‘白花重瓣’的耐受能力最强。
4 结论
镉处理对木槿植株生长有低浓度促进、高浓度抑制的作用,而且随着胁迫时间的延长,促进效果减弱,抑制效果加强。3个木槿品种的耐镉能力因胁迫浓度有所差异,‘牡丹’的耐受能力最弱,但仍适宜长期种植在低浓度(50 mg/kg)镉污染土壤中;‘红星’的耐受性在中、高浓度(100、200 mg/kg)镉污染土壤中高于‘白花重瓣’,在极高浓度(400 mg/kg)镉污染土壤中低于‘白花重瓣’;3个木槿品种在镉含量>100 mg/kg时均不适宜长期种植。综合判断,在土壤镉浓度≤50 mg/kg时,3个品种均值得推广;在50 mg/kg<土壤镉浓度<100 mg/kg时,‘红星’更值得推广;在土壤镉浓度≥100 mg/kg时,3个品种的生长、生理受抑制严重,不适宜长期种植。

