Hedgehog 信号通路在咀嚼力缺乏牙槽骨中的表达变化
张 帅, 扈梓悦, 牛萍萍, 孙 瑶
(上海牙组织修复与再生工程技术研究中心,同济大学口腔医学院,同济大学附属口腔医院口腔种植科,上海 200072)
由于现代人精细饮食的增加, 咀嚼频率及进食时间的减少导致颌骨咀嚼力下降。 一定程度的力学刺激有助于维持骨稳态,多项研究表明,在下颌骨发育期间,咀嚼刺激不足会出现下颌骨体积减小、骨量降低及髁突软骨变薄等现象[1-2]。有报道显示,儿童颌骨发育不足及牙列发育异常也与食物刺激有关[3]。然而,关于牙槽骨如何响应咀嚼力学变化,从而影响颌骨骨密度和骨改建的相关机制并不明确。
现有研究显示,Hedgehog 通路在发育过程中通过调节成骨及破骨过程, 发挥重要的骨调节作用[4-5]。在小鼠体内, 成熟成骨细胞中Hedgehog 信号增强会通过甲状旁腺激素相关蛋白 (parathyroid hormone-related protein, PTHrP) 及核因子κ B 受体活化因子配体 (receptor activator of nuclear factor-κB ligand, RANKL)驱动破骨细胞的产生[6]。多项研究证实, 机械力下的成骨及破骨活动可通过Hedgehog信号通路介导[7-8]。 通过牙槽骨咀嚼力缺乏模型,探究弱咀嚼力环境下Hedgehog 通路在颌骨发育中的变化, 为进一步研究牙槽骨量维持的关键因素及Hedgehog 在其中的作用奠定基础。
1 材料和方法
1.1 动物模型建立
将48 只3 周龄C57BL/6J 雄性小鼠随机分为2 组,即正常饮食组(HD,对照组)及软食组(SD,实验组)。 正常饮食组喂养常规颗粒动物饲料,软食组以相同成分粉末状饲料喂养, 于1 周和3 周后经3%戊巴比妥钠(40 mg/kg)腹腔麻醉后取小鼠下颌骨。 所有小鼠均为SPF 级,购于上海南方模式生物研究中心, 实验经同济大学伦理委员会批准(TJLAC-017-027)。
1.2 仪器与设备
组织处理脱水仪、 石蜡切片机(Thermo Fisher Microm 公司,美国);HE 染色试剂盒(上海威奥生物科技有限公司,中国);TRAP 染色试剂盒(Sigma 公司,美国);山羊血清(福州迈新生物技术开发有限公司,中国);DMP1-C-8G10.3 抗体(贝勒牙学院秦春林教授赠予, 美国);CTSK 抗体 (Thermo Fisher Scientific 公司,美国);荧光二抗IgG(Invitrogen 公司,美国);4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)(Sigma 公司,美国);抗淬灭剂(Thermo Fisher Scientific 公司,美国);Goldner 三色染色液(上海雷根生物科技有限公司,中国);直立荧光显微镜和图像分析系统 (Nikon 公司, 日本);Transcriptor First Strand cDNA Synthesis Kit(Roche公司, 瑞士);TRIzol (Ambion 公司, 美国);PCR SYBR Green Master Mix(上海翊圣生物科技有限公司, 中国);Light Cycler 96 实时荧光定量PCR 仪(Roche 公司,瑞士)。
1.3 实验方法
1.3.1 Micro-CT 数据分析 小鼠下颌骨经4%多聚甲醛固定48 h 后,运用micro-CT 机(型号:micro-CT50;Scanco Medical 公司,瑞士)进行扫描。 选取下颌第一磨牙(first molar, M1)根分叉下方牙槽骨作为感兴趣区域(region of interest, ROI),上缘起自根分叉顶点,下缘止于根尖连线处。 选取分析参数:骨体积分数(bone volume/total volume, BV/TV)、骨小梁数目(trabecular number, Tb.N)、骨小梁厚度(trabecular thickness, Tb.Th)、 骨小梁分离度(trabecular seperation, Tb.Sp)。
1.3.2 形态学染色 固定后的下颌骨经10%乙二胺四乙酸 (ethylene diamine tetraacetic acid,EDTA)脱钙3~4 周后,用组织处理仪梯度脱水,石蜡包埋,行4 μm 厚度切片。选取合适切片,经二甲苯及梯度乙醇脱蜡水化, 常规行HE 染色、Goldner 三色染色及TRAP 染色,甲基绿复染,烘干后用中性树脂封片,显微镜下观察拍照。
1.3.3 免疫荧光染色 选取合适的切片,经二甲苯及梯度乙醇脱蜡水化, 于37 ℃温箱中用透明质酸酶修复,用磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗后,37 ℃恒温箱中血清封闭,其后孵育一抗DMP1(1∶200)、CTSK 抗体(1∶150)过夜。 洗掉一抗,依据种属选择相应二抗,室温孵育,PBS 冲洗,孵育DAPI,用PBS 冲洗后滴加荧光防淬灭封片剂,封片,镜下观察。
1.3.4 RNA 提取及RT-qPCR 分析 提取软食组及正常饮食组小鼠下颌骨,剔去多余软组织,剪除前后方及磨牙下方硬组织, 仅留下颌磨牙区牙槽骨。 利用TRIzol 法提取总RNA,经逆转录试剂盒逆转录为cDNA 后, 应用RT-qPCR 分析初级纤毛及Hedgehog 相关基因, 如IFT88、SMO、PTCH1、GLI1等表达情况。 引物序列如表1 所示。

表1 引物序列Table 1 Primer sequences
1.4 统计学分析
使用SPSS 20.0 与GraphPad Prism 8.0 软件进行分析,2 组间比较采用独立样本t检验,实验数据用均数±标准差(±s)表示,P<0.05 被认为差异具有统计学意义。
2 结果
2.1 软食组小鼠磨牙根分叉区牙槽骨骨量显著降低
2 组小鼠分别饲养1 周、3 周, 固定取材后,micro-CT 结果(图1)显示,软食组小鼠相较于正常饮食组, 其下颌骨不同区域骨量具有不同程度降低,尤其以髁突和牙槽骨较为明显。 在牙槽骨中,以第一磨牙(M1)根分叉下方牙槽骨丧失最为严重。软食组主要表现为近根方1/2 的腔隙显著扩大, 近冠方1/2 牙槽骨骨密度明显降低。 根分叉区牙槽骨的定量分析结果表明,软食喂养1 周时,即4 周龄小鼠BV/TV 降低约25%,Tb.N 和Tb.Th 不同程度降低,Tb.Sp 上升,骨量出现显著降低。 软食喂养3 周时,即6 周龄小鼠较4 周龄软食组小鼠骨丢失进一步加重,但定量分析显示骨丢失速度减缓,说明软食组小鼠骨稳态异常。

图1 Micro-CT 扫描和定量分析结果Figure 1 Micro-CT scans and quantitative analysis results
2.2 根分叉下方牙槽骨根方1/2 处骨丧失较为明显
HE 染色结果(图2)可见,软食喂养1 周后,软食组小鼠第一磨牙下方牙槽骨出现明显的骨吸收。原有的位于根方的牙槽骨生理性腔隙进一步增大,且出现一些散在的不连续空腔,冠方牙槽骨尚无显著变化。 软食喂养3 周后,软食组小鼠根分叉区域牙槽骨吸收加重,根方散在腔隙逐渐连接,且范围进一步向冠侧蔓延,同时冠方也开始出现了一些骨吸收形成的散在空腔。
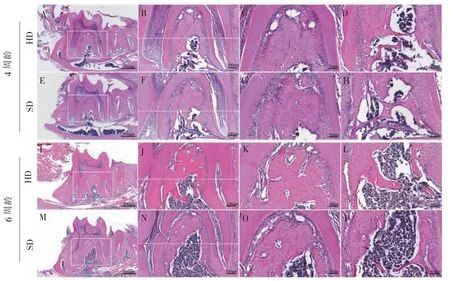
图2 小鼠下颌第一磨牙HE 染色结果Figure 2 HE staining results of mouse mandibular M1
2.3 根分叉下方牙槽骨冠方1/2 处矿化程度降低
牙本质基质蛋白(dentin matrix protein 1,DMP1)是主要由骨细胞表达的一种基质蛋白,在骨发育及矿化中发挥重要作用。 免疫荧光染色结果发现,软食组小鼠较正常饮食组根分叉区DMP1 阳性细胞信号区域显著减少,意味着软食组小鼠牙槽骨矿化能力减弱。 与根方相比,冠方1/2 区域差异更明显。Goldner 三色染色分别以绿色和红色来显示成熟的矿化骨与不成熟类骨质。如图3 所示,4 周龄软食组小鼠正处于生长发育阶段,M1 磨牙区牙槽骨冠方红染非矿化骨较多。6 周龄小鼠已近成年,此时非矿化骨在2 组间无显著差异。
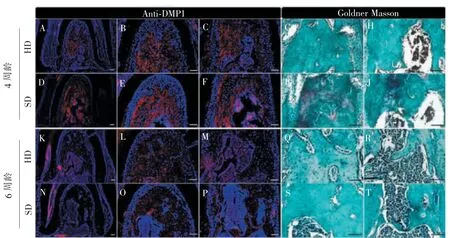
图3 第一磨牙牙槽骨DMP1 及Goldner 三色染色结果Figure 3 DMP1 and Goldner trichrome staining results of alveolar bone of M1
2.4 软食组小鼠磨牙根分叉区牙槽骨破骨活性增强
由于软食组小鼠主要表现为从牙槽骨量丢失为主的骨改建,所以检测了其破骨活性。TRAP 染色结果显示,软食喂养1 周后,TRAP 阳性细胞数量上升,TRAP 阳性区域面积减少,且主要集中在根方牙槽骨处。 软食组3 周即小鼠6 周龄时,发育基本成熟,此时软食组TRAP 染色略强于对照组,但2 组均显著低于4 周龄时。 CTSK 的染色结果基本与TRAP 染色一致。 详见图4。

图4 M1 牙槽骨TRAP 及CTSK 染色结果Figure 4 TRAP and CTSK staining results of alveolar bone of M1
2.5 软食组小鼠Hedgehog 及初级纤毛相关基因表达上升
提取下颌骨磨牙区牙槽骨RNA,分析咀嚼力缺乏下Hedgehog 相关基因的表达变化。 RT-qPCR 结果表明,软食组小鼠Hedgehog 通路下游分子SMO、PTCH1、GLI1 的mRNA 表达水平均呈现不同程度上调。 在软食喂养早期,小鼠4 周龄时,相关mRNA水平呈现明显的上调。 随喂养时间增加,因咀嚼力缺乏而导致的相关mRNA 表达水平上调减缓。与初级纤毛相关的IFT88 的mRNA 水平在软食喂养1 周及3 周后均呈现显著上调。 这些结果表明Hedgehog及初级纤毛参与咀嚼力缺乏时骨改建的调节过程。详见图5。
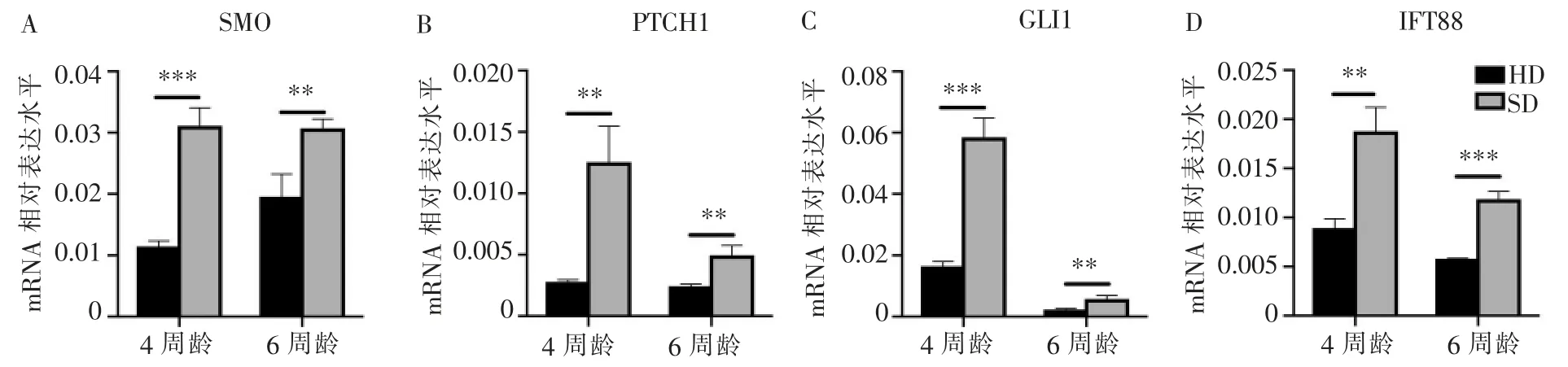
图5 Hedgehog 通路及初级纤毛相关基因表达情况Figure 5 The expression of Hedgehog pathway and primary cilia related genes
3 讨论
在下颌骨生长发育期间,长期进食软食会引起咀嚼力不足,造成下颌骨骨量降低。 本研究中,小鼠进食软食1 周即4 周龄时,磨牙区牙槽骨即出现了骨量显著降低、矿化能力减弱、出现未成熟骨、破骨活性明显增强、Hedgehog 信号通路显著上调的变化,这些可能与此时下颌骨处于发育阶段,骨改建较为活跃相关。 而进食3 周软食即小鼠6 周龄时,颌骨发育基本完成,下颌骨基本处于一个较为稳定的阶段,此时骨丢失速度降低,骨量较4 周龄时仅轻度下降, 不成熟骨消失, 破骨细胞活性及Hedgehog信号通路相关基因表达略有上涨。 这些结果表明牙槽骨发育早期阶段机械刺激的重要作用。
此前已有多项研究探讨了机械应力在颌骨发育及乳恒牙列替换萌出中的作用机制。Wu 等[9]利用小型猪模型证明了颌骨内源性应力通过integrinβ1-Runx2-Wnt 通路调控牙列替换。 Men 等[10]探讨GLI1+细胞作为一种牙周膜干细胞响应咬合力维持骨稳态。 此外,一些临床研究揭示错颌畸形导致的咀嚼刺激不足, 使髁突及下颌骨密度降低及不对称发育[11]。 而咀嚼刺激不足又进一步影响牙齿形态及咀嚼肌、舌肌等功能,继而影响颌骨发育[12]。
Hedgehog 信号通路在骨发育和维持体内骨稳态方面发挥重要作用。 多项研究表明,Hedgehog 信号主要是Sonic hedgehog(SHH)及Indian hedgehog(IHH)通过多种途径参与骨代谢调节的[13-14]。随着年龄增加,Hedgehog 信号逐渐减弱。研究发现,当成骨细胞中HH 信号增强时,其可通过调节PTHrP 介导的RANKL 与OPG 的表达来诱导破骨细胞的生成与骨吸收[4]。 另一项研究也证实,经SHH 处理的小鼠的骨髓基质细胞在体外显示出增强的破骨细胞潜力,导致骨改建及骨强度降低[6]。 Shimo 等[15]也发现, 源于口腔肿瘤的SHH 可以刺激肿瘤微环境下颌骨中破骨细胞的生成及骨吸收。 Kohara 等[16]的实验证实,抑制Hedgehog 可以抑制破骨细胞生成,同时增加骨量。 针对Hedgehog 通路的调节是应对骨吸收的一个重要措施。
Hedgehog 通路的下游分子SMO、PTCH1、GLI1等均在破骨调节过程中发挥作用。 小鼠破骨细胞中SMO 的特异性缺失可减轻衰老小鼠骨小梁骨量降低[16]。PTCH1 表达水平升高会抑制SMO 与HH 的转导,导致骨量降低[17]。 GLI1 阳性细胞作为一种力学响应细胞参与牙槽骨改建过程[18]。 在经典Hedgehog信号转导中,PTCH1 通过抑制SMO 发挥负向调节作用,而SMO、GLI1 等则发挥正向调节作用。 基于本研究中PTCH1 与SMO 的同步上调,提出以下猜想: ①PTCH1 通过影响SMO 的亚细胞定位影响Hedgehog 信号转导,但关于PTCH1 调控SMO 的相关机制仍不清楚[19],目前相关研究指出,二者之间可能存在第二信使如胆固醇等参与了这一过程;②PTCH1 的核心功能是调节SMO 进入初级纤毛膜, 部分研究表明,SHH 可独立于PTCH1/2 激活SMO[20];③RT-qPCR 仅能反映mRNA 水平,与转录翻译后的蛋白水平可能存在差异。 此外, IFT88 是Hedgehog 下游的重要信号转运蛋白。 Kitamura 等[21]发现IFT88 突变的小鼠下颌骨缩短,且Hedgehog 信号下调,证实IFT88 通过调节SHH 参与下颌骨发育过程。
本研究中,咀嚼刺激不足导致了下颌牙槽骨骨量降低, 伴随着Hedgehog 下游相关分子SMO、PTCH1、GLI1、IFT88 的表达上升, 这些结果将为后续研究力学及Hedgehog 通路在骨量维持中的作用提供理论基础。 此外,探究颌骨响应力学机制可以为饮食习惯提供指导,初级纤毛可为研究这一过程提供了一个新的视角,但其如何响应机械刺激参与破骨活动仍需进一步研究。

