PD-1抗体联合治疗对肝切除术后难治性复发肝癌患者生存率及免疫功能的影响
崔丽敏,赵冀安
肝癌为较常见的癌症[1]。目前临床较常用的治疗方案为手术切除、血管介入及射频消融(RFA)等,但术后多存在较高的复发率[2-4]。而肝癌复发后患者常合并肝内多发病变、大血管侵犯及远处转移,导致无法进行二次手术。临床晚期肝癌的一线靶向抑制剂索拉菲尼、瑞格菲尼等对患者生存期的延长效果有限,因此临床需要更佳的治疗方案,改善患者病情,延长患者生存时间[5]。肝癌的局部治疗有RFA、微波消融(MWA)、经导管肝动脉化疗栓塞(TACE)等。随着临床研究的深入,抗程序性死亡蛋白-1(PD-1)抗体药物的研究也逐渐增多,这类药物可拮抗PD-1和PD-L1的结合,恢复机体内功能性T细胞的功能[6]。本研究选取我院收治的肝切除术后难治性复发肝癌患者,观察局部治疗、酪氨酸激酶抑制剂(TKI)联合PD-1抗体治疗的临床效果及安全性。现报告如下。
1 资料与方法
1.1一般资料 收集我院2019年5月—2021年3月收治的肝切除术后难治性复发肝癌60例的临床资料。纳入标准:年龄>18岁;术后影像学检查结果提示至少具有以下特征之一:肝内复发病灶>3个;累及主要血管,如侵及门静脉、肝静脉或腔静脉致血管内癌栓形成;腹膜内淋巴结转移;侵犯肝脏邻近组织及脏器和腹膜腔种植转移;肺、骨、脑等远处转移;预期生存时间>3个月。排除标准:合并其他恶性肿瘤;不能遵医嘱者;重度不良反应无法治疗者。按照治疗方法分为对照组和研究组各30例。2组性别、年龄、Child-Pugh分级、转移部位等方面比较差异无统计学意义(P>0.05),具有可比性。
1.2方法 对照组给予TKI类药物[仑伐替尼8 mg(体质量<60 kg)或12 mg(体质量>60 kg),1/d;或阿帕替尼850 mg,1/d]口服,用药前根据疾病特点进行局部治疗:肝内3~5个复发病灶行RFA或MWA治疗;肝内>5个复发病灶给予TACE治疗;肿瘤侵犯大血管或肝外转移患者给予局部放射治疗。研究组在对照组基础上给予PD-1抗体(帕博利珠单抗200 mg,每3周1次;或纳武利尤单抗3 mg/kg,每3周1次)静脉滴注。治疗期间根据美国国立癌症研究所“不良事件常用术语标准(第4版)”[7],当出现3级及以上治疗相关不良事件时,减少用药剂量或暂停治疗,直至不良事件得到控制。
1.3观察指标
1.3.1生存情况:观察并记录2组中位总生存期及中位无进展生存期;比较2组6个月总生存率、无进展生存率及1年总生存率、无进展生存率。
1.3.2疗效评估:对2组定期检查血常规、凝血功能、肝功能、肿瘤指标等,并进行影像学检查。治疗结束后,根据RECIST实体瘤评价疗效[8],完全缓解:肿瘤体积缩小>50%,患者相关临床症状显著减轻或消失;部分缓解:肿瘤体积缩小30%~50%,患者临床症状有所缓解;稳定:肿瘤体积缩小15%~30%;进展:肿瘤体积缩小<15%,临床症状及相关病情加重。客观缓解率=(完全缓解+部分缓解)/总例数×100%;临床获益率=(完全缓解+部分缓解+稳定)/总例数×100%。
1.3.3不良事件:记录2组治疗任意级别及3/4级不良事件发生情况。
1.3.4免疫功能:检测2组治疗前及治疗1、3、6个月T细胞亚群水平。采患者不同时间段早晨空腹外周静脉血2 ml,放置肝素抗凝管内,染色、洗涤、上机。1500 r/min离心5 min,去除上清液,100 μl PBS重悬细胞,加入100 μl荧光抗体PBS,摇匀避光静置30 min,加入500 μl PBS,摇匀后5000 r/min离心5 min,去除上清液,洗涤1次,采用六色流式细胞仪(美国BD公司)检测CD3+、CD4+及CD8+水平。

2 结果
2.1生存情况 研究组和对照组中位总生存期分别为8.1(6.2~17.6)个月及7.5(6.1~11.3)个月,中位无进展生存期分别为8.0(6.4~17.5)个月及6.4(2.0~11.5)个月。研究组和对照组治疗后6个月总生存率分别为97.5%和68.0%,治疗后1年总生存率分别为95.0%和55.0%。研究组治疗后6个月和1年总生存率均高于对照组,差异有统计学意义(P<0.01)。见图1。研究组治疗后6个月和1年无进展生存率分别为86.7%和86.8%,对照组分别为58.5%和52.0%。研究组治疗后6个月和1年无进展生存率高于对照组,差异有统计学意义(P<0.01)。见图2。
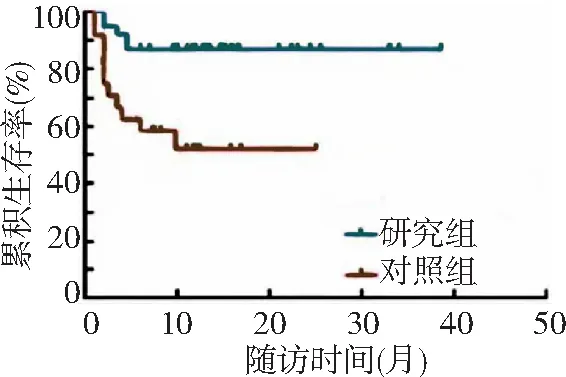
图1 2组肝切除术后难治性复发肝癌总生存率比较
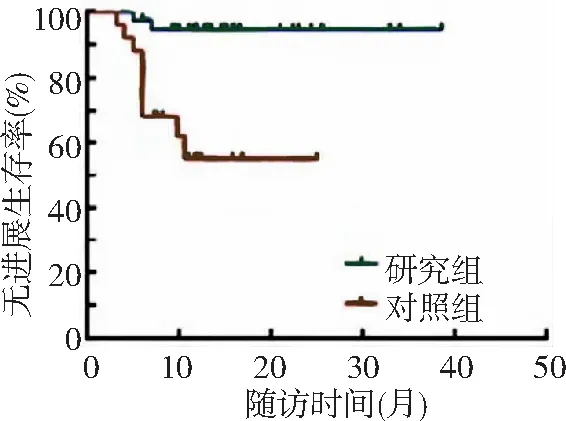
图2 2组肝切除术后难治性复发肝癌无进展生存率比较
2.2临床疗效 研究组治疗后临床获益率高于对照组,差异有统计学意义(P<0.05)。见表1。
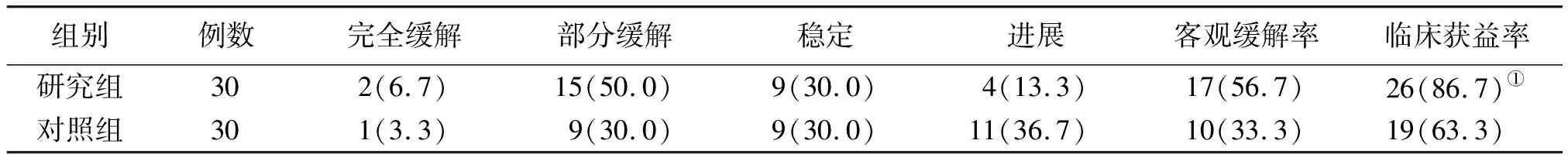
表1 2组肝切除术后难治性复发肝癌临床疗效比较[例(%)]
2.3不良事件发生情况 2组任意级别及3/4级不良事件发生率比较差异无统计学意义(P>0.05),且均未出现治疗相关死亡。见表2。

表2 2组肝切除术后难治性复发肝癌治疗不良事件发生情况[例(%)]
2.4免疫功能 2组治疗后1、3、6个月CD3+、CD4+水平均高于治疗前,CD8+低于治疗前(P<0.05)。研究组治疗后1、3、6个月CD3+、CD4+水平均高于对照组,CD8+水平低于对照组(P<0.01)。见表3。

表3 2组肝切除术后难治性复发肝癌不同时间段免疫功能指标比较
3 讨论
肝癌是目前临床较为常见的恶性肿瘤之一,临床多采用肝癌根治术进行治疗,但术后较高的复发率及转移率仍是最常见的问题[9]。肝癌术后难治性复发患者因肿瘤侵袭性较强,往往临床预后较差,生存时间短,生活质量明显下降[10]。针对此类患者治疗方案的制订仍是临床医生所面临的问题。
目前,再次手术切除是复发性肝癌的标准治疗方法,但研究表明,术后复发的患者仅有7%~30%可进行再切除[11]。究其原因在于患者肝硬化加重、复发病灶多发性,且首次手术所导致的腹腔粘连、门静脉高压、肝脏体积缩小、肝脏血管解剖发生改变等都会增加再次手术难度及风险[12]。随着靶向治疗的不断发展,肝癌领域的治疗研究也取得了重大进展。TKI靶向药物如索拉非尼、仑伐替尼、瑞格非尼等已陆续获批用于晚期肝癌的一线或二线治疗。局部消融治疗方法为RFA及MWA,针对病灶较少的患者效果显著,且可以反复多次进行治疗,对病灶较多、肿瘤较大的复发患者,TACE效果更佳[13]。因此本研究针对不同病灶数量的患者采用不同的局部治疗。免疫治疗是通过增强患者机体自身的免疫功能,促进其对肿瘤细胞的杀伤,PD-1/PD-L1信号通路已被临床证实会抑制机体内免疫细胞功能[14]。PD-1主要表达于T细胞、B细胞、活化的单核细胞及树突状细胞,当其与肿瘤表达的PD-L1相结合便会减弱免疫系统对肿瘤细胞的识别,从而出现肿瘤细胞免疫逃逸[15]。随着临床对免疫治疗的研究,PD-1抗体如纳武利尤单抗、帕博利珠单抗等因其安全有效性也被批准用于肝癌的二线治疗[16]。随着临床治疗的不断完善与进步,各种治疗方案也都取得了一定的临床效果,但由于术后难治性复发肝癌病情复杂,单一治疗对患者的生存情况改善不明显。国内研究表明,针对术后难治性复发肝癌患者应选择联合治疗,以延长生存时间,提高生活质量[17]。有研究报道,帕博利珠单抗联合仑伐替尼在不可切除肝癌治疗中有较高的安全性[18]。
本研究结果显示,研究组6个月总生存率及无进展生存率、1年总生存率和无进展生存率均高于对照组,治疗后研究组临床获益率高于对照组。提示三种方式联合治疗可有效提高临床疗效及患者生存率。本研究还显示,研究组治疗后1、3、6个月CD3+、CD4+水平均高于对照组,CD8+水平低于对照组,提示PD-1抗体可有效提高患者免疫功能,增强机体免疫对肿瘤细胞的作用。本研究发现,2组任意级别及3/4级不良事件发生率比较差异无统计学意义,提示三种方式联合治疗并未增加不良反应,两组均未出现治疗相关死亡,提示局部治疗、TKI类药物口服联合PD-1抗体静脉滴注治疗安全性较高。
综上所述,局部治疗、TKI及PD-1抗体联合治疗肝切除术后难治性复发肝癌安全有效,可提高机体免疫功能,进一步提高患者生存率。

