兰州百合多糖片段对X 射线诱导的小鼠骨髓有核细胞损伤的保护作用
郭 忠 马建秀 马艳庆 宋 雷 汪晨净 郭 淼 夏 溪 赵 晋
(西北民族大学医学部药理学教研室 西北民族大学西北民族地区环境生态与人群健康实验室 兰州 730030)
尽管放射性诊断和治疗技术得到了广泛提高,但正常组织仍会受到不同程度的损伤,因此提高诊断和治疗技术的同时,做好电离辐射导致的机体损伤防护是提高放疗患者生活质量的关键。辐射防护剂是一类能够清除辐射产生的活性氧、防止基因突变、对机体具有保护作用的物质。在接触放射性物质前后使用,均能预防、减轻放射病的临床症状,促进患者早期康复。多糖(Polysaccharide)在自然界中分布广泛,具有多种重要功能。近年来,学者们在对多糖的免疫增强作用、抗肿瘤、抗氧化、抗衰老、降血脂、抗病毒等功能研究的同时,发现多糖在辐射防护方面也具有很重要的作用[1-3]。百合多糖(Lily polysaccharide,LP)具有免疫调节、降血糖、抗氧化的药理作用,以及具有抗肿瘤、抗疲劳、清除自由基和延缓肺组织纤维化等药理作用[4]。本实验通过研究兰州百合多糖片段(LLP)对X射线辐射导致急性放射性损伤小鼠的防护效果,以期为临床运用百合多糖作为辐射防护剂提供科学依据。
1 材料与方法
1.1 材料
兰州百合购自兰州市黄河药材市场;碘化丙啶(Propidium iodide,PI)(美国lsbio 公司);鼠抗γH2AX 单克隆抗体(美国Upstate Technology 公司);其余试剂均为国产分析纯。Olympus AX70荧光显微镜(日本Olympus 公司);FACSCalibur 流式细胞分析仪(美国Becton Dickinson 公司);DYY-6C型电泳仪(北京市六一仪器厂)。
X 射线辐照装置为美国RX-650 Cabinet XRadiator System:能量100 kVp(Kilovolt peak,峰值电压),电流5 mA,吸收剂量率1.38 Gy/min,照射野20 cm×20 cm。
1.2 兰州百合多糖片段的制备
1.2.1粗多糖提取纯化
百合粗多糖提取自兰州百合干燥鳞茎粉末中。采用超声辅助热水法,上清液浓缩至原体积的1/4后,在浓缩液中加入80%的无水乙醇,4 ℃保存12 h 即得粗多糖。粗多糖用Sevage 法(V氯仿∶V正丁醇=5∶1)纯化去除蛋白质[5]。
1.2.2LLP的制备
使用DEAE-52-纤维素柱(80 mm×610 mm,北京索拉里奥科技有限公司)从粗多糖中分离LLP片段。用超纯水、0.04 mol/L NaCl 和0.1 mol/L NaCl分别洗脱,洗脱液采用苯酚硫酸-紫外分光光度法(UV-1800PC,上海美帕达仪器有限公司)检测,根据洗脱模式收集主要馏分,然后在水浴中氮气流保护下用0.1 mol/L HCl 水解主要馏分。水解后,在水解液中加入20%NaOH,调节pH为7.0后透析浓缩,无水乙醇沉淀。干样品用Sephadex G-50 柱(50 mm×600 mm,Sigma Chemical Co.,USA)分离,用3 L 超纯水洗脱,Sephadex G-100柱(3.5 mm×600 mm,Sigma Chemical Co.,USA)纯化,并用1.8 L超纯水洗脱,得到LLP[6]。平均分子量为8 629.8 Da。
1.3 动物模型的制备、分组及给药
选用清洁级昆明小鼠,体重为(22±2) g,4~5周龄,雌雄各半,购自兰州大学动物实验中心(合格证号:No.62000800000374),饲养于兰州大学实验动物中心(许可证号:SCXK[甘]2018-0002)。动物分组及处理:依据预实验结果,用基础饲料适应性喂养3 d后将无不良反应,进食、饮水和活动正常者纳入实验。50只小鼠随机平均分成5组,每组10 只,雌雄各半。实验分5 组:(1)正常对照组,不照射,以蒸馏水代替药物;(2)单纯照射组,X射线照射,以蒸馏水代替药物;(3)低剂量LLP+照射组,X 射线照射,每天灌胃给药(50 mg/(kg·d));(4)中剂量LLP+照射组,X射线照射,每天灌胃给药(100 mg/(kg·d));(5)高剂量LLP+照射组,X 射线照射,每天灌胃给药(200 mg/(kg·d))。连续给药7 d,末次给药后以X 射线对第(2)~(5)组小鼠进行一次性全身照射,吸收剂量率为1.38 Gy/min,总剂量为4.0 Gy,建立急性放射性损伤小鼠模型。照射24 h后进行实验。
1.4 BMNCs收集、含量分析及嗜多染红细胞微核检测
取小鼠的双侧股骨,用磷酸缓冲盐溶液(PBS)(含0.1%肝素钠)收集股骨BMNCs。用红细胞裂解液常温下裂解10 min,离心去上清,PBS洗涤,获得BMNCs后进行计数。上面实验取出的骨髓液置于玻片上制成涂片,待涂片自然风干后甲醇固定5~10 min,放入吉姆萨缓冲液中染色15~20 min,立即用蒸馏水冲洗晾干,镜检。每只小鼠计数1 000个嗜多染红细胞中的微核细胞数。通过吉姆萨染色法来测定电离辐射诱导小鼠骨髓微核率的发生[7]。
1.5 BMNCs DNA损伤检测
1.5.1彗星试验
消化并调整细胞浓度为4×107L-1;将50 μL 1%的低熔点琼脂糖凝胶(Agarose type Ⅶ)均匀铺开于毛玻片上,室温下放置备用。将400 μL 的上述细胞和1.2 mL 1%低熔点琼脂糖凝胶40 ℃下预热,混匀后迅速铺到第一层凝胶上(约1.4 mL),室温固化3 min。将载玻片浸没于新配制的预冷裂解液中(含0.4~0.5 mg/mL 蛋白酶K,使用前加入),4 ℃裂解l h,小心移入37 ℃孵箱孵育18~20 h;Tris-硼酸盐缓冲液(45 mmol/L Tris-硼酸;1 mmol/L EDTA,pH=8.5)漂洗载玻片3 次,每次30 min。将载玻片静置于电泳槽中30 min。注意液面高于载玻片2 mm,避光;调整缓冲液液面高度,使电压为16~18 V,电流约7 mA,电泳25 min。1%H2O2固定玻片10 min,双蒸水充分洗涤。PI(5 g/mL)染色30 min,置于密闭湿盒中,4 ℃保存(在24 h 内观察,以防止荧光淬灭)。在荧光显微镜(10×40倍)紫外光(UV)的激发下,DNA图像呈橘红色。每个载玻片拍摄至少50个细胞,每个药物剂量3张片子。本实验重复3次。图片用CASP 软件分析。计算彗星尾长、头部DNA百分含量、尾部DNA 百分含量、尾矩(Tail moment,TM)和 Olive 尾 矩(Olive tail moment,OTM)等指标。TM 定义为迁移的平均距离与彗尾部DNA 的分数的乘积。OTM 计算方法:尾部光密度重心与头光密度重心之间的距离×尾部DNA百分含量[8]。
1.5.2流式细胞仪分析γH2AX荧光强度
将BMNCs(照射后不同组别)用-20 ℃预冷的75%乙醇固定,并置于-20 ℃条件下48 h以上。将固定好的细胞离心除去乙醇,并用含有3%BSA和0.05%Tween-20 的PBS 洗涤细胞,加入γH2AX(Ser139)一抗,4 ℃过夜。细胞离心弃上清并用PBS 洗涤3 次,加入荧光二抗室温避光孵育1 h 。收集细胞并用PBS 洗涤1 次,再加入200 μL PBS悬浮细胞,用流式仪收集数据。最终结果以γH2AX(Ser139)荧光强度变化表示[9]。
1.6 BMNCs凋亡和周期分布检测
取分离的(照射后不同组别)约1×105个BMNCs,凋亡检测试剂盒染色后采用流式细胞仪分析细胞凋亡情况。用-20 ℃预冷的75%乙醇固定BMNCs,并置于-20 ℃条件下48 h 以上。将固定好的细胞离心除去乙醇,PBS 洗涤后碘化丙啶(PI)染色进行流式分析[10]。
1.7 统计学处理
2 结果
2.1 LLP对小鼠BMNCs数量和微核率的影响
LLP对辐照小鼠骨髓有核细胞数量和微核率的影响见表1。由表1 可知,未受辐照小鼠BMNCs数量为(8.77±0.73)×105mL-1。小鼠接受4 Gy 剂量24 h 后,BMNCs 数量明显下降。其中单纯对照组BMNCs 数量降至(4.83±0.39)×105mL-1(p<0.01),说明急性放射性损伤模型成立;相对于照射组,LLP的50 mg/(kg·d)剂量组BMNCs数量可升高至(5.43±0.45)×105mL-1,100 mg/(kg·d)和200 mg/(kg·d)剂量组BMNCs 数量分别为(7.03±0.51)×105mL-1(p<0.01)和(7.20±0.42)×105mL-1(p<0.01),表明LLP 可显著缓解辐照后BMNCs 数量的减少,并呈现出剂量依赖性。
表1 LLP对X射线诱导小鼠BMNCs数量和微核率的影响Table 1 Effects of LLP on the number of BMNCs and micronucleus rate in mice induced by X-ray (± s)

表1 LLP对X射线诱导小鼠BMNCs数量和微核率的影响Table 1 Effects of LLP on the number of BMNCs and micronucleus rate in mice induced by X-ray (± s)
注:n=10;*p<0.05,**p<0.01;a与对照组比较;b与单纯照射组比较。Note:n=10;*p<0.05,**p<0.01;a,compared with the control group;b,compared with the simple irradiation group.
吉姆萨染色法测定电离辐射诱导小鼠BMNCs微核率的结果显示,小鼠接受4 Gy 剂量24 h 后,BMNCs 微核率明显升高。不同剂量的LLP 均可使微核率降低,改善了染色体的损伤情况,并呈现出剂量依赖性。与对照组比较,差异有统计学意义(p<0.01)。
2.2 LLP 对X 射线诱导小鼠BMNCs DSB 的影响
中性彗星电泳检测结果显示,X 射线照射后24 h,小鼠BMNCs 呈现出彗星细胞指标的典型改变。对照组TM、OTM明显升高,不同剂量的LLP干预后均有所下降,100 mg/(kg·d)和200 mg/(kg·d)剂量组与对照组比较有显著性差异(p<0.01)(表2)。结果表明,LLP对急性放射性损伤引起的小鼠BMNCs DNA双链断裂有保护作用。
表2 LLP对X射线诱导小鼠BMNCs DSB的影响Table 2 Effects of LLP on DSB of mouse BMNCs induced by X-rays (± s)
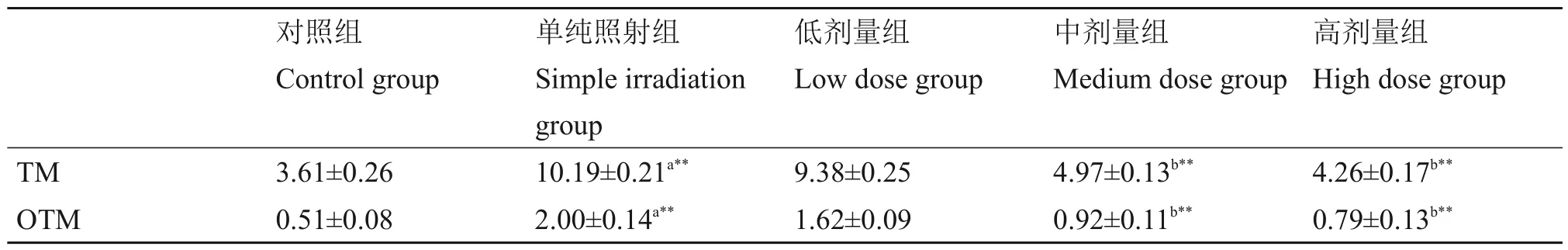
表2 LLP对X射线诱导小鼠BMNCs DSB的影响Table 2 Effects of LLP on DSB of mouse BMNCs induced by X-rays (± s)
注:n=10;*p<0.05,**p<0.01;a与对照组比较;b与单纯照射组比较。Note:n=10;*p<0.05,**p<0.01;a,compared with the control group;b,compared with the simple irradiation group.
2.3 LLP 对X 射线诱导BMNCs γH2AX 荧光强度的影响
流式细胞仪分析结果显示,X 射线诱导的BMNCs γH2AX 荧光强度从190.33±11.93 上升到523.33±18.77(p<0.01)。与对照组比较,低、中、高剂量组可降低至420.33±10.97、278.00±11.16 和204.00±12.53(p<0.01),有显著性差异(表3)。结果也表明,LLP 对急性放射性损伤引起的小鼠BMNCs DNA双链断裂有保护作用,并呈现出剂量依赖性。
表3 LLP对小鼠BMNCs γH2AX荧光强度、凋亡率和周期分布的影响Table 3 Effects of LLP on γH2AX fluorescence intensity,apoptosis rate,and cycle distribution of mouse BMNCs(± s)
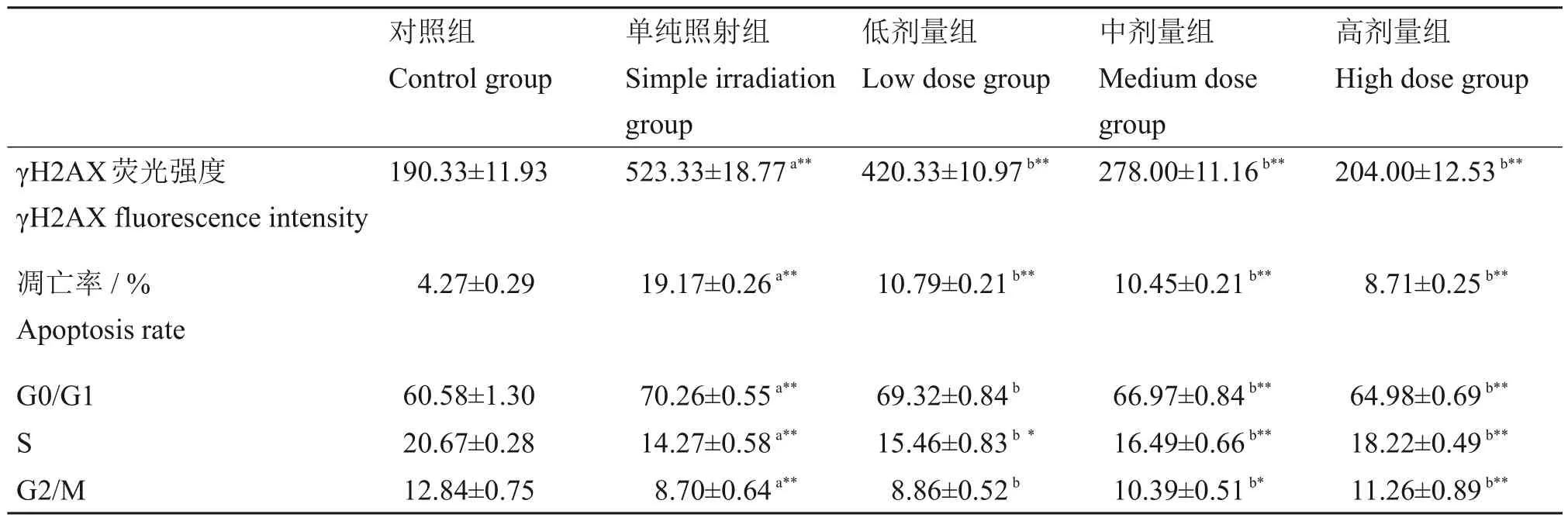
表3 LLP对小鼠BMNCs γH2AX荧光强度、凋亡率和周期分布的影响Table 3 Effects of LLP on γH2AX fluorescence intensity,apoptosis rate,and cycle distribution of mouse BMNCs(± s)
注:n=10;*p<0.05,**p<0.01;a,与对照组比较;b,与单纯照射组比较。Note:n=10;*p<0.05,**p<0.01;a,compared with the control group;b,compared with the simple irradiation group.
2.4 LLP对X射线诱导BMNCs凋亡和周期分布的影响
流式细胞仪分析结果显示,X 射线诱导的BMNCs 凋亡率从(4.27±0.29)%上升到(19.17±0.26)%。50 mg/(kg·d)剂量组可降低至(10.79±0.21)%;100 mg/(kg·d)和200 mg/(kg·d)剂量组分别为(10.45±0.21)%和(8.71±0.25)%,与对照组比较,差异有统计学意义(p<0.01)(表3)。
流式细胞仪分析结果显示,各组小鼠BMNCs细胞周期大多处于G0/G1 期,4 Gy 的X 射线照射后24 h细胞周期呈现重新分布,G0/G1期细胞比例明显增加,S 期和G2/M 期比例明显减少。不同剂量组的细胞周期比例均有不同程度的影响,50 mg/(kg·d)剂量组引起S 期比例有所上升(p<0.05);100 mg/(kg·d)和200 mg/(kg·d)剂量组引起S期比例明显上升(p<0.01);100 mg/(kg·d)和200 mg/(kg·d)剂量组引起G0/G1 期比例明显降低(p<0.01);200 mg/(kg·d)剂量组引起G2/M 期比例明显上升(p<0.01)(表3)。结果表明:LLP对急性放射性损伤小鼠BMNCs细胞周期改变有一定的影响,并减轻骨髓细胞凋亡速度。
3 讨论
从天然来源提取的多糖数量众多且毒性低。体内外实验表明,多糖通过抗氧化、免疫调节、保护造血系统和防止DNA 损伤等作用具有抗辐射活性[11]。本文研究了兰州百合多糖片段是否对辐射诱导的小鼠BMNCs损伤具有保护作用。
造血系统对电离辐射十分敏感,大于1 Gy 的剂量即可引起造血系统损伤,因此造血系统损伤是一种比较常见的辐射引起的机体损伤。骨髓对辐射具有高敏感性。骨髓DNA 含量和有核细胞数可以反映机体造血功能状态,骨髓有核细胞减少是射线对骨髓不良反应的直接表现[12]。本研究对小鼠骨髓有核细胞的数量和微核率进行观察,证明LLP保护DNA 损伤可能是通过增加骨髓有核细胞数量以及降低微核率发挥作用(表1)。
研究发现,中性单细胞凝胶电泳检测的DSB的初始损伤多不能反映细胞的放射敏感性,而多以经过一定时间修复后残留损伤或初始损伤与残留损伤的比值作为观察指标[13]。本研究选取辐照后24 h 的小鼠骨髓有核细胞进行中性彗星实验。TM 为彗星迁移的平均距离与彗尾部DNA 分数的乘积值。OTM为尾部与头部的光密度重心间距×尾部DNA 百分含量。实验结果显示,LLP 对急性放射性损伤引起的小鼠骨髓有核细胞DSB 具有明显的防护效应。辐射损伤早期即可诱发DNA 迁移各项指标变化,其变化幅度具有特征性剂量-效应关系[14]。兰州百合多糖有助于恢复辐射损伤修复,呈现出剂量依赖性(表2)。
γH2AX 抗体标记是探测DSB 存在的金标准。细胞在DNA损伤后,H2AX 迅速地发生了磷酸化,并在DSB 位点凝集成焦点。免疫组化法、Western blot 和流式细胞计数法是最常用的鉴别γH2AX 阳性表达的方法。其中,流式细胞术即可通过γH2AX 荧光强度大小判断损伤程度,也可以用来评估DNA 损伤与细胞周期之间的关系[15]。不同剂量的兰州百合多糖均可降低γH2AX 阳性表达,表现出辐射损伤防护效应(表3)。
流式细胞仪分析结果显示,LLP可以减少X射线引起的骨髓有核细胞凋亡和G0/G1 期阻滞(表3)。电离辐射诱导的细胞周期阻滞是机体的一种保护性反应,一方面启动损伤的细胞进行自我修复,另一方面诱导不能修复的损伤细胞凋亡,以降低基因组的不稳定性,减少细胞癌变几率。虽然射线诱导的细胞周期阻滞大多为G2/M 期阻滞,但也不乏存在G0/G1 期阻滞的报道。马淑梅等[16]研究了不同剂量X 射线全身照射对小鼠骨髓细胞周期进程的影响,结果显示,0.5~6.0 Gy X射线全身照射后小鼠骨髓造血细胞出现明显的G1、G2 阻滞,S 期合成能力降低。谢漪课题组[17]研究了低剂量连续辐照引起的小鼠免疫系统的变化,实验结果表明,小鼠胸腺细胞的周期在照射后24 h 被阻滞在G2/M 期;外周血淋巴和胸腺细胞周期48 h被阻滞在G0/G1 期;脾脏淋巴细胞周期24 h 被阻滞在G0/G1期,48 h 被阻滞在S期。本次实验只做了4 Gy 的X 射线全身照射后24 h 对小鼠骨髓细胞的周期进程影响,将来的实验可以检测不同剂量的X 射线在照射后不同时间点对周期阻滞的影响是否有其他变化。
4 结论
研究结果显示,兰州百合多糖片段对放射性急性损伤小鼠骨髓有核细胞具有一定的保护作用,且有明显的剂量依赖性。主要是减少骨髓有核细胞损伤,降低微核率,以及降低辐射引起的DSB,还对辐射引起的细胞凋亡有保护作用。这对将兰州百合多糖作为辐射防护剂具有一定的参考价值。
作者贡献说明所有作者都对研究的构思和设计做出了贡献。材料准备、数据收集和分析由郭忠,马建秀,马艳庆,宋雷,汪晨净,郭淼和夏溪进行。手稿的初稿由郭忠,赵晋撰写,赵晋对手稿的最终版本进行了修改。所有作者阅读并认可了终稿。

