肺腺癌患者基因突变与临床特征的相关性
陆海燕 张越 景年财 卢义 郭环宇 杨吉利
(1长春中医药大学中医学院,吉林 长春 130012;2吉林省肿瘤医院中西医结合科)
肺腺癌是肺恶性肿瘤中最常见的一种病理类型,占40%~50%,其肺癌相关基因突变率远高于其他病理类型。有研究表明,表皮生长因子受体(EGFR)作为机体最主要的驱动基因,在中晚期肺腺癌患者中突变率高达51.4%〔1〕,此外还有间变性淋巴瘤激酶(ALK)、c-γOS原癌基因1受体酪氨酸激酶(ROS1)等基因位点突变,少见突变靶点如鼠类肉瘤病毒癌基因(KRAS)、鼠类肉瘤病毒癌基因同源物B1(BRAF)、间质表皮转化因子(MET)、转染期间重排(RET)、人类表皮生长因子受体(Her)-2等。明确驱动基因对于精准治疗非小细胞肺癌及判断预后具有重要意义。近年来,有关肺癌驱动基因状态与患者临床特征、肿瘤的生物学特性之间的相关性一直是研究热点。为更好探寻靶向治疗优势人群、了解肺腺癌患者驱动基因的外在临床特征及生物学特性,本文分析肺腺癌患者基本临床特征及分子表型表达与基因突变状态的相关性,为肺腺癌的临床诊疗及进一步科学研究提供参考。
1 资料与方法
1.1研究对象及诊断标准 选取2020年6月至2021年9月在吉林省肿瘤医院经病理或细胞学检测明确诊断为肺腺癌的87例患者,年龄39~81岁,患者均接受二代测序技术(NGS)进行肺癌驱动基因检测,其中突变基因阳性61例(70.1%)。临床分期参照国际抗癌联盟(UICC)非小细胞肺癌TNM分期(第八版)。
1.2纳入及排除标准 纳入标准:①经细胞学或病理学明确诊断为原发性肺腺癌患者;②已进行基因检测;③既往未进行相关治疗的初治患者;④年龄>18周岁。排除标准:合并有其他肿瘤者。
1.3试剂与方法 免疫组化结果由吉林省肿瘤医院病理科检测,采用链霉菌抗生物素蛋白-过氧化物酶连结(SP)法,以磷酸盐缓冲液(PBS)代替一抗作阴性对照,抗体 TTF-1、NapsinA及Ki67均购自福州迈新生物技术开发有限公司,使用PV-9000试剂盒及二氨基联苯胺(DAB)显色系统显色。免疫组化切片的阳性信号均呈棕黄色颗粒状,TTF-1和Ki67主要表达于细胞核,NapsinA主要表达于胞质。细胞核染色<5%为(-),染色≥5%为(+)〔2〕。
1.4统计学方法 采用SPSS25.0软件进行χ2检验或Fisher确切概率法。
2 结 果
2.1临床分期及突变亚型分布 临床分期Ⅰ~Ⅱ期4例(4.6%),Ⅲ期11例(12.6%),Ⅳ期72例(82.8%)。突变亚型具体分布:EGFR 45例(73.8%),其中19Del 20例(32.8%)、21L858R 18例(29.5%)、20ins 4例(6.6%)、L861Q 3例(4.9%),另外ALK 5例(8.2%),RET、KRAS各3例(4.9%),BRAF V600E、MET、ERBB-2各1例(1.6%),其他突变 2例(3.3%),复合突变(2个或以上基因位点突变)8例(13.1%)。
2.2突变基因状态与性别、年龄、吸烟情况及临床分期的关系 突变基因与吸烟关系密切,无吸烟史患者基因突变率明显高于有吸烟史者(P<0.05),突变基因与性别、年龄及临床分期差异无统计学意义(P>0.05)。突变基因亚型19Del、21L858R、ALK在TNM分期中比较有统计学差异(P<0.05),ALK表达阳性患者临床分期更早;3种亚型性别、年龄、吸烟史无统计学差异(P>0.05),均多见于年龄<65岁、无吸烟史的女性患者。因Ⅰ~Ⅲ期样本量较少,统计分析时合并样本以减少误差。余亚型因突变率低、样本量少,未纳入统计分析。见表1。
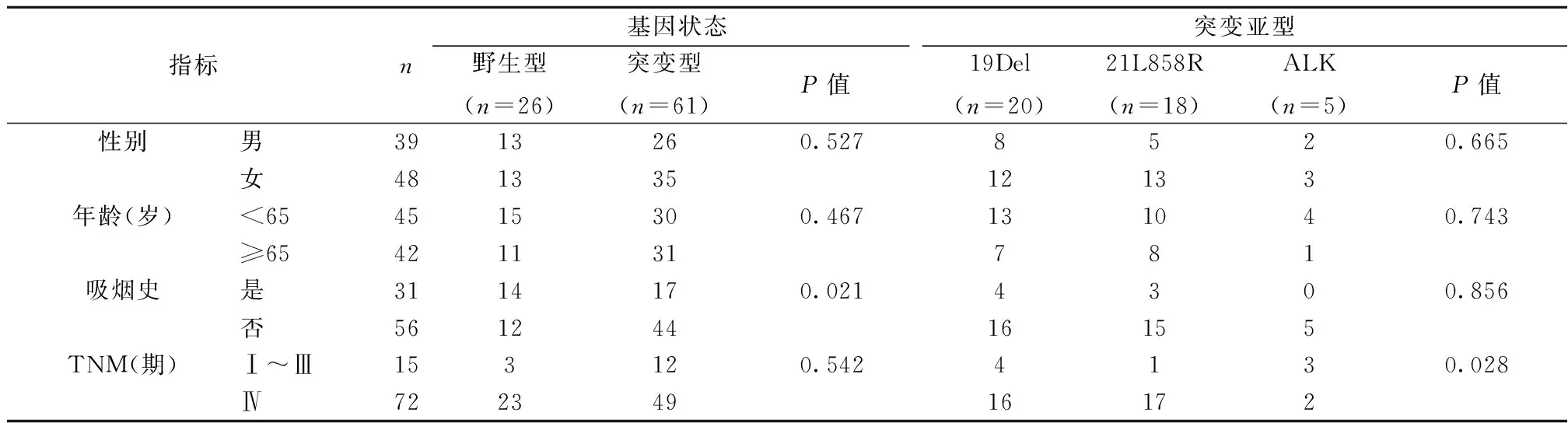
表1 突变基因与一般临床特征的关系(n)
2.3突变基因与转移部位的关系 纳入临床分期Ⅳ期患者,野生型23例,突变型49例,突变基因状态与转移部位无统计学相关(P>0.05)。余亚型因突变率低、样本量少未纳入统计分析。见表2。
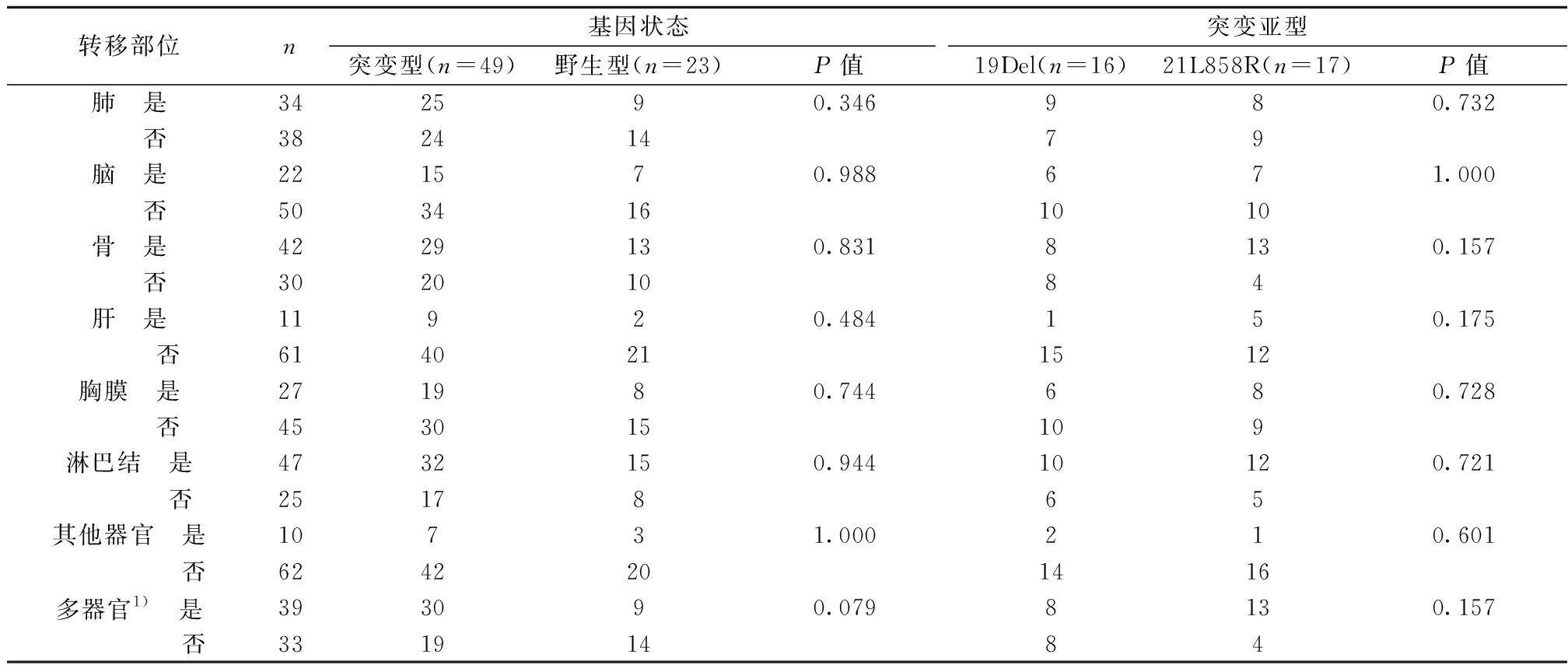
表2 突变基因与临床转移部位的关系(n)
2.4分子表型表达与一般临床特征的关系 42例获得TTF-1、NapsinA、Ki67免疫组化检测信息。TTF-1、NapsinA、Ki67表达情况与患者性别、吸烟情况、年龄均无相关性,NapsinA表达情况与基因突变有统计学意义(P<0.05),TTF-1、Ki67表达情况与基因状态无关。表明NapsinA阳性表达的患者,驱动基因阳性的可能性更大。见表3。
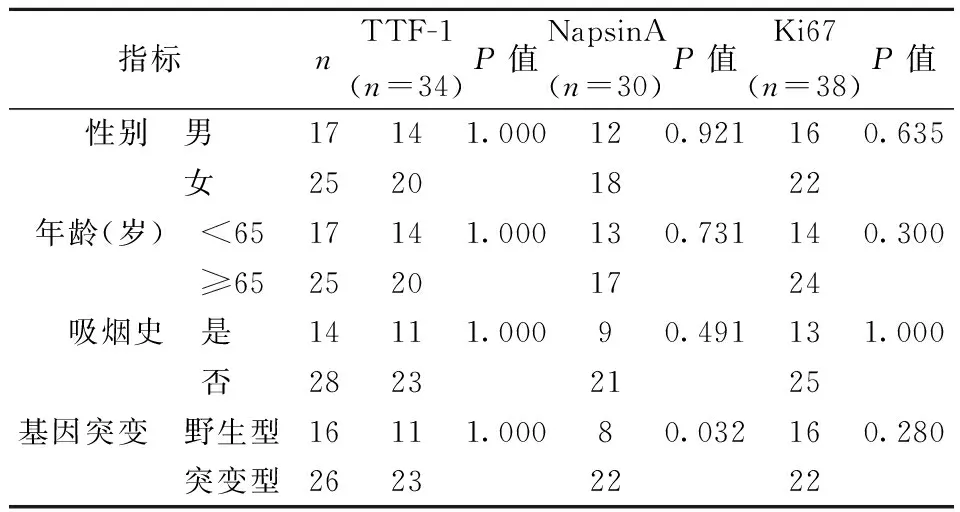
表3 TTF-1、NapsinA、Ki67阳性表达与一般临床特征的关系(n)
3 讨 论
据《2020年全球最新癌症负担数据》,中国肺癌发病率和死亡率分别为17.9%和23.8%〔3〕,是危及我国人民健康与生命安全最常见的诊断癌种和造成癌症死亡的主要原因。根据病理分型,肺癌分为非小细胞肺癌和小细胞肺癌两大类。其中非小细胞肺癌发病率为80%~85%〔4〕,其基因突变多存在于腺癌亚型中,以19Del、21 L858R突变类型为主。目前分子靶向治疗是肺腺癌的主要治疗模式。研究表明,基因突变多发生于肺腺癌中,且以不吸烟的女性多见〔5〕,本文与研究结果一致〔6〕。
免疫组化染色是肺癌病理诊断与鉴别诊断中必不可少的检测方式。TTF-1属于细胞核蛋白的一种,在胚胎时期参与肺及甲状腺的基因调控,因此对于肺及甲状腺来源的肿瘤有高表达性。研究显示在非小细胞肺癌中腺癌的TTF-1阳性表达率(60%~95%)远高于鳞癌,转移性肺腺癌中多无表达〔7〕,可作为鉴别诊断的标记物。另有多项临床研究表明TTF-1表达阳性患者在预后、中位无进展生存期等方面优于TTF-1阴性患者〔8~10〕。研究发现肺癌分化程度与TTF-1表达呈负相关,即高分化肺癌患者的TTF-1多呈阳性表达,其通过实验进一步发现TTF-1能参与控制肿瘤分化,限制恶性细胞转移〔11〕。这一结果为TTF-1呈表达阳性患者较阴性相比有较高生存率提供了理论依据。NapsinA是一种天门冬氨酸蛋白酶,广泛分布于Ⅱ型肺泡上皮细胞和肺泡巨噬细胞,能参与水解表面活性蛋白物质B,维持肺的正常形态与功能〔12〕。一项荟萃分析显示肺腺癌中NapsinA阳性表达率为70%~95%,且其敏感度及特异性高于TTF-1〔13〕。在肺鳞癌中低表达,肺神经内分泌癌多不表达,临床中多以TTF-1和NapsinA组合用于肺腺癌的诊断与鉴别诊断〔14〕。研究发现NapsinA高表达组5年总生存率(OS)为87.6%高于低表达组,NapsinA表达水平与预后生存呈正相关〔15〕,可作为早期肺腺癌患者生存预后的独立评价因素。研究表明TTF-1表达阳性肺腺癌患者较TTF-1阴性者有更高的基因突变率,尤以EGFR突变显著,且表达水平与基因突变呈正相关〔16,17〕。Li等〔18〕回顾性分析了339例肺腺癌患者后发现TTF-1与NapsinA均表达阴性者无基因突变,可考虑作为小标本检测时辅助诊断。Ki67是一种临床常用的反映细胞增殖情况的蛋白标志物。其与临床特征的关系,业界争议比较大。就其与肿瘤分化程度而言,多数学者认为Ki67表达水平越高,肺癌肿瘤分化程度越低〔19〕。
本研究表明肿瘤组织学中NapsinA表达阳性者更易发生驱动基因突变,为临床判定筛选基因检测人群提供参考,与现有临床研究结果相符。TTF-1、Ki67表达情况与基因状态无关,经分析可能与样本量少有关,再者所选取病例基因突变虽以EGFR为主,仍包含少见突变靶点样本,统计分析时未对此类样本进行剔除。目前有关基因突变类型与免疫组化的相关性研究多以EGFR为主,尚无涉及少见突变靶点的研究。这可能也是本次研究中影响统计学结果的一个重要因素。

